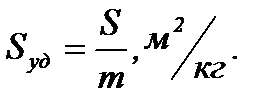Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 2 «Хімічна кінетика та рівновага. Каталіз»Содержание книги
Поиск на нашем сайте
Завдання 1. Вкажіть молекулярність і загальний порядок наступної реакції:
Напишіть рівняння для константи рівноваги та визначить у якому напрямку буде зрушуватися рівновага з підвищенням температури та тиску. Розв’язання Молекулярність – це число молекул, які зустрічаються в елементарному акті хімічної взаємодії. Дана реакція бімолекулярна. Порядок реакції – це сума показників степенів концентрацій (парціальних тисків)у виразі закону діючих мас. Для даної реакції маємо
Загальний порядок реакції 2+3=5.
За принципом Ле-Шательє: якщо на систему, яка знаходиться в рівновазі, застосувати зовнішній вплив (змінити Т, Р…), система буде противодіяти цьому і рівновага зміститься в сторону зменшення цього впливу. В зв’язку з тим, що для прямої реакції ΔН < 0, то підвищення температури зміщує рівновагу в сторону реакції з поглинанням тепла (ендотермічної, в сторону вихідних речовин). Для розрахунку впливу тиску розрахуємо число молей газу до (5 молів газу) та після (3 моля газу) реакції. При підвищенні тиску рівновага зміщується в сторону менших кількостей речовини газу. Завдання 2. При дослідженні терміну зберігання пенталгіну було показано, що протягом 50 діб при температурі 75 0С з препаратом не відбулося суттєвих змін. Чи можна зберігати ці ліки протягом 3,5 років при 25 0С? Розв’язання За стандартним виразом для обчислення терміну зберігання ліків знайдемо скільки часу можна зберігати ліки при температурі 25 0С (298 К)
де γ – температурний коефіціент, прийнятий ДЕРЖ Фармакопією γ = 2.
n – кількість десятків градусів між температурами T2 = 75 0С і T1 = 25 0С (n = 5). τТ – термін зберігання ліків при Т2 = 75 0С (за умовою τТ = 50 діб). Підставляючи числові значення, маємо
Оскільки, ліки можна зберігати при температурі Т1 = 25 0С протягом 4,4 років, то звичайно їх можна зберігати при цій температурі протягом 3,5 років.
Тема 3 «Розчини» Завдання 1 Визначте осмотичний тиск 2 %-ного розчину глюкози при 0 0С. Густина розчину 1035 г/дм3. Розв’язання Осмотичний тиск визначають за законом Вант-Гоффа
де с – молярність розчину (моль/м3); R – газова стала ( T – абсолютна температура (за умовою T = 273 K). Знайдемо молярність розчину. Якщо розчин 2 %-ний, то в 100 г розчину міститься 2 г глюкози, тоді в 1035 г розчину (в 1 л) міститься х г глюкози. Маємо пропорцію
Звідки х = 20,7 г. Знайдемо, якій кількості речовини відповідає ця маса:
М – молекулярна маса глюкози. Таким чином, маємо розчин глюкози, в 1 л якого міститься 0,115 моля речовини. Тобто, концентрація розчину становить 0,115 моль/л = 115 моль/м3. Підставляючи відомі величин до виразу для обчислення осмотичного тиску, маємо
Розмірність Тобто, осмотичний тиск 2 %-ного розчину глюкози становить 261018 Па.
Завдання 2 Опишіть механізм дії та виведіть рН гідрокарбонатного буферного розчину, якій підтримує стале значення рН (крові людини).
Розв’язання Буферний розчин – це розчин, здатний підтримувати сталу концентрацію іонів водню (рН) при додаванні певної кількості сильної кислоти або лугу, при розведенні та концентрування. Розглянемо, чому буферні розчини протидіють додаванню сильних кислот, лугів, розведенню та концентруванню. Для системи Н2СО3/NaHCO3 можна записати
Якщо до цієї системи додати сильну кислоту, то іони Н+ будуть взаємодіяти з
Із рівняння випливає, що сильна кислота замінюється еквівалентною кількістю слабкої кислоти. Згідно з законом розведення Освальда, підвищення концентрації слабкого електроліту знижує ступінь її дисоціації, в наслідок чого концентрація іонів Н+ у розчині буде змінюватися незначно, тобто рН суттєво не змінюється. При додаванні до буферного розчину лугу:
Луг реагує з Н2СО3 та замінюється еквівалентною кількістю солі, іони Розрахунок рН.
Запишемо вираз для константи дисоціації Н2СО3
Із рівняння знайдемо рівноважну концентрацію іонів водню:
Прологарифмуємо та помножимо на (-1) обидві частини рівняння, маємо
Отримуємо формулу для розрахунку
В зв’язку з тим, що рН буферного розчину залежить від співвідношення концентрацій солі та кислоти, то і при розбавленні, і при концентруванні цього розчину рН змінюватися не буде.
Тема 4 «Електрохімія» Завдання 1. Визначте напрям хімічної реакції
використовуючи значення стандартних електродних потенціалів полуелементів:
Розв’язання Складемо гальванічний елемент для даної реакції. Відбувається окиснення атомів заліза
та відновлення іонів кадмію
В гальванічному елементі негативним буде залізний електрод, а позитивним – кадмієвий. Схема гальванічного елемента:
За значеннями стандартних електродних потенціалів розраховуємо ЕРС цього гальванічного елемента:
В зворотньому гальванічному елементі відбувається максимально корисна робота nFE, яка дорівнює зменшенню енергії Гіббса:
де n – число електронів, які беруть участь в ОВР; F – число Фарадея (9,65.104 Кл/моль); Е – ЕРС гальванічного елемента. Якщо початкові активності реагентів дорівнюють одиниці, то маємо
де Δ G0 – стандартна зміна енергія Гіббса, Е0 – стандартна ЕРС.
В зв’язку з тим, що
Колоїдна хімія Тема 5 «Фізико-хімія поверхневих та сорбційних явищ». Завдання 1. Розрахуйте питому адсорбцію оцтової кислоти на вугіллі (в г/г вугілля), якщо 25,00 см3 0,198 М розчину оцтової кислоти збовтували із 3 г вугілля і після встановлення адсорбційної рівноваги на його титрування пішло 11,00 см3 0,050 М розчину NaOH. Розв’язання Рівноважна концентрація кислоти в розчині після адсорбції дорівнює
Оскільки початкова кількість кислоти у розчині складала С0·V ммоль, а рівноважна кількість Ср·V ммоль, то різниця між цими величинами адсорбувалася на поверхні сорбенту масою m:
Тема 6 «Загальна характеристика дисперсних систем. Класифікація, отримання та очищення дисперсних систем». Завдання 1. Визначте питому поверхню порошку тетрацикліну (в м2/кг), якщо частинки його осідають в водному середовищі на відстані 0,235 м за 1500 с (частинки мають сферичну форму). Густина тетрацикліну – 1,57 г/см3; води – 1 г/см3; вязкість води 1·10-3 Па·с. Розв’язання Швидкість ламінарного руху сферичної частинки, яка вільно осідає під дією сили тяжіння:
де g – прискорення сили тяжіння, p і p0 – густина частинок дисперсної фази та дисперсійного середовища відповідно; r – радіус частинок; η – в’язкість дисперсійного середовища. Визначаємо радіус частинок за рівнянням:
де υ – швидкість руху частинок, яку знаходять зі співвідношення шляху h до часу t, за який цей шлях було пройдено.
Питому поверхню знаходять як співвідношення поверхні частинки до її об’єму або маси:
Питома поверхня дисперсної системи зі сферичним частинками може бути розрахована за рівнянням
де r – радіус частинки; р – густина дисперсної фази. Знаходимо питому поверхню
|
||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 176; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.245.158 (0.009 с.) |

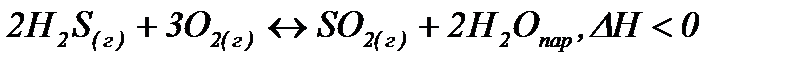 .
.


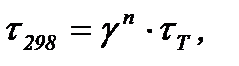

 .
.
 );
);

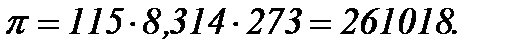



 -іонами солі, та утворювати слабодисоційовану кислоту
-іонами солі, та утворювати слабодисоційовану кислоту 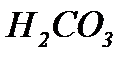 .
.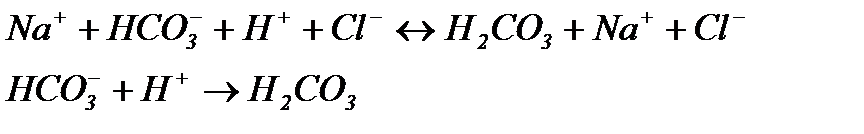
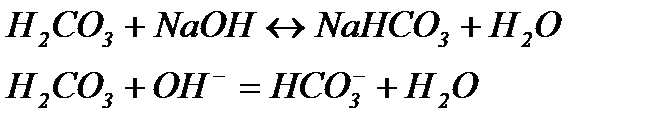
 зменшують дисоціацію Н2СО3, яка залишилася в розчині після добавлення невеликої кількість NaOH.
зменшують дисоціацію Н2СО3, яка залишилася в розчині після добавлення невеликої кількість NaOH.
 .
. .
. .
.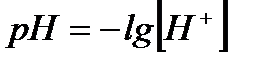 – водневий показник.
– водневий показник.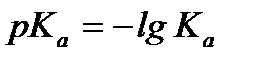 – кислотний показник.
– кислотний показник. .
.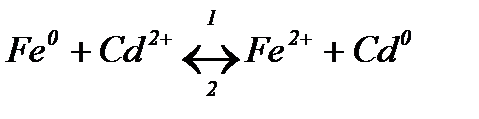 ,
, ,
, 



 .
.
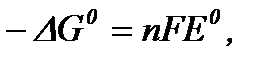

 <0, то реакція може перебігати в гальванічному елементі в прямому напрямку самодовільно. Максимальна робота при цьому дорівнює зменшенню свобідної енергії Гіббса (7720 кДж).
<0, то реакція може перебігати в гальванічному елементі в прямому напрямку самодовільно. Максимальна робота при цьому дорівнює зменшенню свобідної енергії Гіббса (7720 кДж).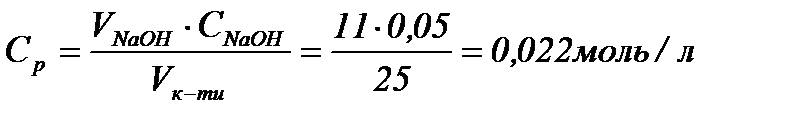




 або
або