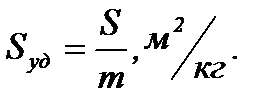Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 1. Хімічна термодінамикаСодержание книги Поиск на нашем сайте
ФІЗИЧНА ТА КОЛОЇДНА ХІМІЯ 1. ПОЯСНЮВАЛЬНА ЗАПИСКА Програма з дисципліни «Фізична та колоїдна хімія» для вищих медичних (фармацевтичних) закладів освіти України IV рівня акредитації складена для спеціальності «Фармація» 7.110201 напряму підготовки 1102 «Фармація» у відповідності з освітньо-кваліфікаційними характеристиками (ОКХ) і освітньо-професійними програмами (ОПП) підготовки фахівців, затвердженими МОН України, навчальним планом, розробленим на засадах Європейської кредитно-трансферної системи (ЕСТS) і затвердженим наказом МОЗ України № 930 від 07.12.2009 р. За навчальним планом спеціальності 7.110201 «Фармація» (освітньо-кваліфікаційний рівень - спеціаліст) вивчення фізичної та колоїдної хімії здійснюється впродовж V і VI семестрів 3-го року навчання. Програма структурована на розділи та теми відповідно до вимог «Рекомендацій щодо розроблення навчальних програм навчальних дисциплін» (наказ МОЗ України від 12.10.2004 р. № 492). Фізична та колоїдна хімія як навчальна дисципліна: Фізична та колоїдна хімія - одна із фундаментальних дисциплін у системі вищої фармацевтичної освіти, яка продовжує хімічну підготовку провізора. Знання теоретичних основ фізичної та колоїдної хімії необхідне для глибокого вивчення аналітичної, біологічної, фармацевтичної та токсикологічної хімії, фармакогнозії та технології ліків. Вивчення курсу фізичної та колоїдної хімії дозволить майбутньому фахівцю оволодіти певним мінімумом знань у галузі виготовлення, контролю якості та зберігання ліків, а також їх біотрансформації в організмі людини.
Програма дисципліни структурована на 2 розділи: Розділ 1. Фізична хімія 1. Хімічна термодінамика 2. Хімічна кінетика та рівновага. Каталіз 3. Розчини 4. Електрохімія Розділ 2. Колоїдна хімія 5. Фізико-хімія поверхневих та сорбційних явищ. 6. Дисперсні системи. Класифікація, методи одержання та очищення. 7. Молекулярно-кінетичні, оптичні та електричні властивості дисперсних систем. 8. Стійкість та коагуляція дисперсних систем. 9. Фізико-хімія ВМР (високомолекулярних речовин). Вивчення дисципліни «Фізична та колоїдна хімія» містить обзорні лекції, практичні заняття, лабораторні роботи і самостійну роботу студентів.
Теми лекційного курсу розкривають проблемні питання відповідних розділів фізичної та колоїдної хімії. Практичні заняття за методикою їх організацій є лабораторно-практичними. Проте кількість годин, відведених для лекцій і практично-лабораторних занять, недостатня для успішного засвоєння матеріалу повного курсу, тому передбачена систематична самостійна, індивідуальна робота студентів над теоретичним матеріалом. Для цього наводиться зміст програми «Фізична та колоїдна хімія» з переліком основних питань, які студент повинен знати з кожної теми, тестових та ситуаційних завдань до відповідних тем, а також відповіді на тестові завдання та приклади розв’язування ситуаційних завдань. Контроль за самостійною роботою студентів при засвоєнні розділів «Фізична хімія» та «Колоїдна хімія» здійснюється двома вхідними контрольними роботами, які проводяться під час навчальної сесії у письмовій формі з використанням тестових і ситуаційних завдань на першому практичному або семінарському занятті та будуть слугувати передмовою допуску до заліку або іспиту.
2. МЕТА ВИВЧЕННЯ НАВЧАЛЬНОЇ ДИСЦИПЛІНИ Мета вивчення фізичної та колоїдної хімії - кінцеві цілі встановлюються на основі ОПП підготовки провізора за фахом і є основою для побудови змісту навчальної дисципліни. Кінцеві цілі дисципліни: ■ Інтерпретувати з точки зору хімічної термодинаміки та класифікувати основні хімічні та фазові рівноваги та хімічні процеси для формування цілісного підходу до вивчення хімічних та біологічних процесів ■ Трактувати загальні закономірності перебігу хімічних реакцій ■ Трактувати загальні закономірності процесів сорбції ■ Класифікувати властивості розчинів неелектролітів, електролітів та ВМР ■ Класифікувати різні типи дисперсних систем ■ Класифікувати властивості дисперсних систем, їх стійкість ■ Пояснювати механізм виникнення електродного, дифузійного, мембранного та контактного потенціалів та способи їх визначення
3. ЗМІСТ ПРОГРАМИ ФІЗИЧНА ХІМІЯ ТЕМА 3. РОЗЧИНИ Конкретні цілі 1. Сильні електроліти. Міжіонна взаємодія у розчинах сильних електролітів. Теорія Дебая-Гюккеля. Іонна сила розчину електроліту. Коефіцієнт активності електроліту.
2. Буферні розчини, їх класифікація. Рівняння Гендерсона-Гассельбаха. Механизм буферної дії. Буферна ємність. Значення буферних розчинів для фармації. 3. Ідеальні та реальні розчини. Закон Рауля. Відхилення від закону Рауля в реальних розчинах. Ізотонічний коефіцієнт. 4. Зміна температурми замерзання та кипіння рідин при утворенні розчинів. Кріоскопія і ебуліоскопія. 5. Осмос. Осмотичний тиск. Осмолярність. Осмометрія. 6. Рівновага пара-рідина. Закони Коновалова. Азеотропні суміші. Фракційна перегонка. Застосування ректифікації у хімічному і фармацевтичному виробництві. Перегонка з водяною парою. 7. Розподіл речовини між двома не змішуваними розчинниками. Закон розподілу Нернста. Рівняння Шилова-Лепинь. Екстракція, її значення для фарації.
Джерела інформації: 1. Физическая и коллоидная химия / Под ред. В.И.Кабачного, - Харьков: Изд-во НФаУ, 2005, с. 72-109. 2. Физическая и коллоидная химия: Учебн. Для фарм. Вузов и факультетов / Под ред. К.И.Евстратовой.- М.: Высш. шк., 1990, с. 68-109, с.120-132.
Тестові завдання до теми 3 «Розчини»: 1. Часто при виготовленні екстемпоральної рецептури суміш твердих інгредієнтів розпливається в густу в'язку масу, або ж плавиться і перетворюється на рідину, що знижує терапевтичну активність як фізична несумісність. Це викликано утворенням:
A. Твердого розчину B. Механічної суміші C. Евтектичної суміші D. Рідкого розчину E. Газоподібного розчину
2. При виготовленні супозиторіїв (медичних свічок) підбір суміші жирових речовин, які плавляться при температурі тіла людини(32-370С) і не розм'якшуються при температурі нижче 320С, проводять за допомогою вивчення:
A. Діаграм "тиск насиченої пари - склад" B. Діаграм плавкості C. Діаграм стану "тиск - температура" D. Фазових діаграм E. Нічого з перерахованого
3.У фармацевтичній практиці широко використовується ізотонічний розчин натрію хлориду. Яку масу натрію хлориду необхідно взяти для приготування 100 грамів ізотонічного розчину?
A. 8,5 B. 0,85 C. 4,5 D. 0,45 E. 5,0
4. Розрахувати рН розчину, у якому [Н+] = 1,0·10-8 моль/л
A.14 B. 8 C. 6 D.4 E. 1
5. Другий закон Коновалова застосовується до нероздільно киплячих розчинів, які мають екстремальні точки на діаграмах стану і називаються:
A. Необмежено розчинними рідинами B. Ідеальними розчинами C. Азеотропними сумішами D. Обмежено розчинними сумішами E. Взаємно нерозчинними рідинами
6. Молярна концентрація розчину 0,1М, який з розчинів характеризується найбільшим осмотичним тиском?
A. Фенол B. Хлорид літію C. Хлорид калію D. Хлорид кальцію E. Етанол
7. Порушення водно-електролітного балансу у біосередовищах призводить до надлишку або недостатньої кількості води або електролітів. Дефіцит рідини зі збільшенням осмотичного тиску плазми характеризується як
A. Ізотонічна гіпергідратація B. Ізотонічна дегідратація C. Гіпертонічна дегідратація D. Гіпотонічна дегідратація E. Зменшення концентрації іонів в плазмі
8. Дібазол характеризується спазмолітичною і гипотонизивною дією. Для розрахунку об'єму хлороформу, потрібного для екстракції дибазола з водного розчину, необхідно знати:
A. Коефіцієнт дифузії B. Температуру кипіння хлороформу C. Температуру плавлення дибазола D. Коефіцієнт розподілу E. Ебуліоскопічну постійну води
9. Екстракція - найбільш поширений метод виділення речовини з системи. Яким розчинником краще екстрагувати йод з водного розчину, якщо коефіцієнти розподілу змінюється в ряду: K(CS2) >K(C6H6) >K(циклогексан)>K(C6H14) >K(C6H13OH)
A. Циклогексан B. C6H14 C. CS2 D. C6H12 E. C6H13OH
10. Максимальною величиною іонної сили при однаковій молярній концентрації характеризується розчин:
A. Кальцію хлорид B. Калію хлорид C. Калію йодид D. Натрію йодид E. Натрію фтори
Cитуаційні завдання до теми 3 «Розчини»: Завдання 1. Визначити осмотичний тиск 0,9 % розчину натрію хлориду, якій є ізотонічним плазмі крові при 00С. Густина розчину 1,005 г/м.
Завдання 2. Однією із необхідних умов гомеостазу живого організму є оптимальна концентрація іонів водню (рН), яку здатні підтримувати буферні розчини. Обгрунтуйте механізм дії та виведіть рівняння для розрахунку рН: а) гемоглобінового; б) оксигемоглобінового; в) білкового; г) фосфатного буферних розчинів. ТЕМА 4. ЕЛЕКТРОХІМІЯ Конкретні цілі 1. Електропровідність розчинів електролітів. Питома електрична провідність. Молярна електрична провідність, її залежність від розбавлення розчину електроліту. Молярна електрична провідність. Закон Кольрауша. 2. Механізм виникнення електродного потенціалу. Рівняння Нернста. Класифікація електродів: електроди першого та другого родів, газові, окисно-відновні, йонселективні (ПСЕ). 3. Оборотні та необоротні гальванічні елементи. Кола без переносу і з переносом. Концентраційні кола. Дифузійний потенціал. 4. Термодинамічні характеристики реакцій, що відбуваються в гальванічних елементах. Електроди порівняння та індикаторні електроди, що застосовують у різних видах потенціометричного титрування.
Джерела інформації: 1. Физическая и коллоидная химия / Под ред. В.И.Кабачного, - Харьков: Изд-во НФаУ, 2005, с. 110-139. 2. Физическая и коллоидная химия: Учебн. Для фарм. Вузов и факультетов / Под ред. К.И.Евстратовой.- М.: Высш. шк., 1990, с. 139-143, с. 160-175.
Тестові завдання до теми 4 «Електрохімія»: 1. Використовуючи значення стандартних окислювально-відновних потенціалів напівреакцій відновлення, визначте найсильніший окисник
A. Cl2+2e=2Cl- φ0=1,36B B. HClO+H++2e=Cl- +H2O φ0=1,49B C. ClO-+H2O+2e=Cl- +2OH- φ0=0,94B D. ClO3- +H++6e=Cl- +3H2O φ0=1,45B E. ClO4+8H++8e=Cl- +4H2O φ0=1,38B
2. Метод потенціометричного визначення рН, як найбільш універсальний, занесено в державну фармакопею. За допомогою якої з пар електродів визначають рН?
A. Цинковий - хлорсрібний
B. Мідний - каломельний C. Мідний - водневий D. Скляний - нас. каломельний E. Кисневий - хінгідронний
3. Каломельний електрод внесено в ДФ України, як допоміжний електрод для виміру рН. До якого типу електроду відноситься каломельний електрод?
A. Газовий B. Першого роду C. Другого роду D. Окислювально-відновний E. Ионселективный
4. Стандатний водневий електрод - це платинова пластина, занурена в розчин кислоти при температурі 298 К і р = 1.013(105 Па з активністю іонів Н3О+): A. 1 моль/л B. 0,5 моль/л C. 0,1 моль/л D. 0,2 моль/л E. 2,0 моль/л
5. Мембранний потенціал, що виникає між внутрішньою і зовнішньою сторонами клітинної мембрани, знаходиться в незбудженому стані, називається
A. Відновний потенціал B. Потенціал спокою C. Потенціал дії D. Потенціал ушкодження E. Стандартний потенціал
6. Амплітуда коливання (деполяризація і реполяризація) мембранного потенціалу, що виникає при збудженні клітини носить назву
A. Стандартний потенціал B. Водневий потенціал C. Окислювально-відновний потенціал D. Потенціал Донану E. Потенціал дії
7. Рівновага, що встановлюється в системі розчинів, розділених мембраною, непроникною хоч би для одного виду іонів, присутніх в системі (у клітинах роль таких непроникаючих іонів виконують іони білків), називається
А. Мембранна рівновага Донану В. Дифузійна рівновага С. Седиментаційна рівновага Д. Седиментаційно-дифузійна рівновага Е. Динамічна рівновага
8. Потенціал, що виникає на межі розділу двох розчинів, що містять один і той же електроліт різної концентрації, або двох розчинів різних електролітів внаслідок відмінності рухливості їх катіонів і аніонів, називається
A. Контактний потенціал B. Редокс-потенціал C. Стандартний відновний потенціал D. Дифузійний потенціал E. Стандартний окислювальний потенціал
9. Вкажіть редокс-пару, до якої І2/2І- є відновником. Е0 (І2/2І-) = 0, 54 В.
A. Cl2 → 2 Cl- (E0=1,36B) B. SO42- →S0 (E0=0,45B) C. Sn2+ → Sn4+ (E0=0,15B) D. 2S2O32- → S4O62- (E0=0,09B) E. 2H+ → H2 (E0=0,00B) Ситуаційні завдання до теми 4 «Електрохімія»: Завдання 1. Виходячи зі значень стандартних електродних потенціалів напівелементів а) б) в) складіть повне іонне рівняння ОВР і розрахуйте зміну вільної енергії Гиббса в реакції та вкажіть, чи можливо здійснити її в гальванічному елементі.
Завдання 2. Запищіть схему, розрахуйте стандартну ЕРС та максимальну роботу гальванічних елементів, складених із напівелементів а)
б)
в)
КОЛОЇДНА ХІМІЯ
ТЕМА 9. ФІЗИКО-ХІМІЯ ВМР. Конкретні цілі: 1. Поняття про ВМР, методи їх одержання і класифікація. Структура макромолекул, типи зв'язку між ними. Гнучкість макромолекул. Кристалічний та аморфний стан ВМР. Пружно-твердий, високоеластичний та пластичний стан полімерів. Зв'язок між будовою і механічними властивостями полімерів. 2. Набрякання і розчинення ВМР. Вплив різних факторів на величину набрякання. Ліотропні ряди. 3. В’язкість розчинів ВМР. Методи визначення в’язкості. Рівняння Ейнштейна, Бінгама, штаудінгера. Віскозиметричний метод визначення молекулярної маси полімерів.
4. Осмотичний тиск розчинів ВМР. 5. Поліелектроліти. Ізоелектрична точка і методи її визначення. 6. Мембранна рівновага Доннана, її значення для вивчення транспорту лікарських речовин у клітини організму. 7. Драглі (гелі) та їх властивості. Драглювання (желатинування): швидкість, механізм. Тіксотропія. Висолювання. Коацервація. Синерезис. Джерела інформації: 1. Физическая и коллоидная химия / Под ред. В.И.Кабачного, - Харьков: Изд-во НФаУ, 2005, с. 312-328. 2. Физическая и коллоидная химия: Учебн. Для фарм. Вузов и факультетов / Под ред. К.И.Евстратовой.- М.: Высш. шк., 1990, с. 460-474.
Тестові завдання до теми 9 «Фізико-хімія ВМР»: 1. Синтетичні високомолекулярні сполуки - контактні лінзи, які застосовують замість окулярів, - набрякають у вологому середовищі очей. Набряклий матеріал лінз містить певну кількість води(не більше і не менше), яка потрібна для надання матеріалу характерних оптичних властивостей. Це приклад:
A. необмеженого набрякання B. адгезійного набрякання C. синтетичного набрякання D. кінетичного набрякання E. обмеженого набухання
2. У ізоелектричній точці для розчинів високомолекулярних сполук:
A. відсутні заряджені полярні угрупування B. відсутній дифузний шар C. сумарний позитивний заряд полярних угрупувань дорівнює сумарному негативному заряду(потенціал дорівнює нулю) D. відбувається руйнування структури макромолекули E. нічого з перерахованого
3. Розчини високомолекулярних сполук (ліпофільних колоїдів) отримують:
A. прямим розчиненням дисперсної фази в дисперсійному середовищі B. механічним дробленням часток дисперсної фази C. конденсаційними методами D. ультразвуковим дробленням E. жодним з перерахованих методів
4. Стійкість розчинів високомолекулярних речовин порушується при додаванні до них різноманітних електролітів. Ефект, що висолює, залежить головним чином від:
A. тривалої дії B. рівня гідратації іонів C. швидкості руху іонів D. температури E. молекулярної маси електролітів
5. За яких умов обмежене набрякання желатину переходить в необмежене(створення розчину)
A. при охолодженні B. при нагріванні C. у присутності іонів SO42- D. у присутності іонів Cl‾ E. у рН середовищі, яке відповідає ізоелектричній точці
6. Ізоелектрична точка міозину м'яза дорівнює 5. При яких значеннях рН електрофоретична рухливість міозину дорівнює нулю? A. 2,0 B. 7,0 C. 4,0 D. 7,0 E. 5,0
7. α-амінокислоти - структурні одиниці білків. За своєю природою вони являються: A. неіногенними B. тільки катіонними електролітами C. тільки аніонними електролітами D. амфолітами E. нічого з перерахованого
Ситуаційні завдання до теми 9 «Основні поняття про ВМР»: Завдання 1. Білок плазми крові людини (альбумін) має молекулярну масу 69000. Розрахуйте осмотичний тиск розчину, який містить 2 г цього білку в 100 мл розчину при 25 0С. 4. ВІДПОВІДІ НА ТЕСТОВІ ЗАВДАННЯ ТЕМА 1 «Хімічна термодінамика». 1. С 2. С 3. Д 4. Е 5. А 6. Д 7. С 8. Е 9. С 10. В 11. Д
ТЕМА 2 «Хімічна кінетика та рівновага». 1. В 2. Е 3. Е 4. С 5. С 6. Д 7. А 8. Д 9. А 10.А
ТЕМА 3 «Розчини». 1. С 2.В 3.В 4.В 5.С 6. Д 7. С 8. Д 9. С 10. А
ТЕМА 4 «Електрохімія». 1.В 2.Д 3.С 4. А 5.В 6.Е 7.А 8.Д 9. A
ТЕМА 5 «Фізико-хімія поверхневих явищ». 1.А 2.Е 3.Д 4.С 5.А 6.А 7.С
ТЕМА 6 «Загальна характеристика дисперсних систем. Класифікація, отримання та очищення дисперсних систем». 1.А 2.Е 3.Д 4.А 5.В 6.А 7.Е 8.А 9.А 10.А
ТЕМА 7 «Молекулярно-кінетичні, оптичні та електричні властивості дисперсних систем». 1.Д 2.С 3.А 4.С 5.В 6.Д 7.А 8.А
ТЕМА 8 «Стійкість та коагуляція дисперсних систем». 1.Д 2.С 3.А 4.Д 5.Е 6.С 7.В 8.С
ТЕМА 9 «Фізико-хімія ВМР». 1.Е 2.С 3.А 4.В 5.В 6.Е 7.Д
5. ПРИКЛАД РОЗВ’ЯЗУВАННЯ СИТУАЦІЙНОГО ЗАВДАННЯ Тема1 «Хімічна термодінамика» Завдання 1. Розрахуйте тепловий ефект реакції
при 600 К, якщо стандартні теплоти утворення газоподібного етанолу, етилену та води дорівнюють відповідно: -234,80; -52,30; -241,81 кДж/моль, а молярні теплоємності описуються рівняннями:
Розв’язання Розраховуємо тепловий ефект реакції при стандартних умовах за наслідком із закона Гесса
Тепловий ефект при 600 К розраховуємо за рівнянням Кірхгофа
Враховуючи залежності
Підставляємо значення
Завдання 2. Гексаметилентетрамін (уротропін) отримують за реакцією
За відповідними значеннями стандартними ентальпії утворення та ентропій
Розрахуйте зміну енергії Гіббса в результаті реакції і визначте напрям реакції. Розв’язання Зміну ентальпії
Зміну енергії Гіббса реакції можна розрахувати за рівнянням Гіббса-Гельмгольца
Враховуючи, що
Тема 3 «Розчини» Завдання 1 Визначте осмотичний тиск 2 %-ного розчину глюкози при 0 0С. Густина розчину 1035 г/дм3. Розв’язання Осмотичний тиск визначають за законом Вант-Гоффа
де с – молярність розчину (моль/м3); R – газова стала ( T – абсолютна температура (за умовою T = 273 K). Знайдемо молярність розчину. Якщо розчин 2 %-ний, то в 100 г розчину міститься 2 г глюкози, тоді в 1035 г розчину (в 1 л) міститься х г глюкози. Маємо пропорцію
Звідки х = 20,7 г. Знайдемо, якій кількості речовини відповідає ця маса:
М – молекулярна маса глюкози. Таким чином, маємо розчин глюкози, в 1 л якого міститься 0,115 моля речовини. Тобто, концентрація розчину становить 0,115 моль/л = 115 моль/м3. Підставляючи відомі величин до виразу для обчислення осмотичного тиску, маємо
Розмірність Тобто, осмотичний тиск 2 %-ного розчину глюкози становить 261018 Па.
Завдання 2 Опишіть механізм дії та виведіть рН гідрокарбонатного буферного розчину, якій підтримує стале значення рН (крові людини).
Розв’язання Буферний розчин – це розчин, здатний підтримувати сталу концентрацію іонів водню (рН) при додаванні певної кількості сильної кислоти або лугу, при розведенні та концентрування. Розглянемо, чому буферні розчини протидіють додаванню сильних кислот, лугів, розведенню та концентруванню. Для системи Н2СО3/NaHCO3 можна записати
Якщо до цієї системи додати сильну кислоту, то іони Н+ будуть взаємодіяти з
Із рівняння випливає, що сильна кислота замінюється еквівалентною кількістю слабкої кислоти. Згідно з законом розведення Освальда, підвищення концентрації слабкого електроліту знижує ступінь її дисоціації, в наслідок чого концентрація іонів Н+ у розчині буде змінюватися незначно, тобто рН суттєво не змінюється. При додаванні до буферного розчину лугу:
Луг реагує з Н2СО3 та замінюється еквівалентною кількістю солі, іони Розрахунок рН.
Запишемо вираз для константи дисоціації Н2СО3
Із рівняння знайдемо рівноважну концентрацію іонів водню:
Прологарифмуємо та помножимо на (-1) обидві частини рівняння, маємо
Отримуємо формулу для розрахунку
В зв’язку з тим, що рН буферного розчину залежить від співвідношення концентрацій солі та кислоти, то і при розбавленні, і при концентруванні цього розчину рН змінюватися не буде.
Тема 4 «Електрохімія» Завдання 1. Визначте напрям хімічної реакції
використовуючи значення стандартних електродних потенціалів полуелементів:
Розв’язання Складемо гальванічний елемент для даної реакції. Відбувається окиснення атомів заліза
та відновлення іонів кадмію
В гальванічному елементі негативним буде залізний електрод, а позитивним – кадмієвий. Схема гальванічного елемента:
За значеннями стандартних електродних потенціалів розраховуємо ЕРС цього гальванічного елемента:
В зворотньому гальванічному елементі відбувається максимально корисна робота nFE, яка дорівнює зменшенню енергії Гіббса:
де n – число електронів, які беруть участь в ОВР; F – число Фарадея (9,65.104 Кл/моль); Е – ЕРС гальванічного елемента. Якщо початкові активності реагентів дорівнюють одиниці, то маємо
де Δ G0 – стандартна зміна енергія Гіббса, Е0 – стандартна ЕРС.
В зв’язку з тим, що
Колоїдна хімія Тема 5 «Фізико-хімія поверхневих та сорбційних явищ». Завдання 1. Розрахуйте питому адсорбцію оцтової кислоти на вугіллі (в г/г вугілля), якщо 25,00 см3 0,198 М розчину оцтової кислоти збовтували із 3 г вугілля і після встановлення адсорбційної рівноваги на його титрування пішло 11,00 см3 0,050 М розчину NaOH. Розв’язання Рівноважна концентрація кислоти в розчині після адсорбції дорівнює
Оскільки початкова кількість кислоти у розчині складала С0·V ммоль, а рівноважна кількість Ср·V ммоль, то різниця між цими величинами адсорбувалася на поверхні сорбенту масою m:
Тема 6 «Загальна характеристика дисперсних систем. Класифікація, отримання та очищення дисперсних систем». Завдання 1. Визначте питому поверхню порошку тетрацикліну (в м2/кг), якщо частинки його осідають в водному середовищі на відстані 0,235 м за 1500 с (частинки мають сферичну форму). Густина тетрацикліну – 1,57 г/см3; води – 1 г/см3; вязкість води 1·10-3 Па·с. Розв’язання Швидкість ламінарного руху сферичної частинки, яка вільно осідає під дією сили тяжіння:
де g – прискорення сили тяжіння, p і p0 – густина частинок дисперсної фази та дисперсійного середовища відповідно; r – радіус частинок; η – в’язкість дисперсійного середовища. Визначаємо радіус частинок за рівнянням:
де υ – швидкість руху частинок, яку знаходять зі співвідношення шляху h до часу t, за який цей шлях було пройдено.
Питому поверхню знаходять як співвідношення поверхні частинки до її об’єму або маси:
Питома поверхня дисперсної системи зі сферичним частинками може бути розрахована за рівнянням
де r – радіус частинки; р – густина дисперсної фази. Знаходимо питому поверхню
Тема 9 «Фізико-хімія ВМР». Завдання 1. Осмотичний тиск водяного розчину з масовою часткою гемоглобіну ω = 5% при 10 0С дорівнює 7315 Н/м2. Визначте молекулярну масу гемоглобіну (густина розчину – 1 г/мл). Розв’язання Молярну масу гемоглобіну розраховуємо за рівнянням Вант-Гоффа
де с – молярна концентрація, моль/м3.
Mr =1.61·104. 6. ДОДАТКОВА ЛІТЕРАТУРА: 1. Гомонай В.І. Фізична та колоїдна хімія. – Вінниця, - Нова книга, 2007., 496 с. 2. Мороз С.А. Фізична та колоїдна хімія. – Л. – Світ, 1994, 280 с. 3. Мушкамбаров Н.Н. Физическая и коллоидная химия.- М.- МИА, 2008,303с. ФІЗИЧНА ТА КОЛОЇДНА ХІМІЯ 1. ПОЯСНЮВАЛЬНА ЗАПИСКА Програма з дисципліни «Фізична та колоїдна хімія» для вищих медичних (фармацевтичних) закладів освіти України IV рівня акредитації складена для спеціальності «Фармація» 7.110201 напряму підготовки 1102 «Фармація» у відповідності з освітньо-кваліфікаційними характеристиками (ОКХ) і освітньо-професійними програмами (ОПП) підготовки фахівців, затвердженими МОН України, навчальним планом, розробленим на засадах Європейської кредитно-трансферної системи (ЕСТS) і затвердженим наказом МОЗ України № 930 від 07.12.2009 р. За навчальним планом спеціальності 7.110201 «Фармація» (освітньо-кваліфікаційний рівень - спеціаліст) вивчення фізичної та колоїдної хімії здійснюється впродовж V і VI семестрів 3-го року навчання. Програма структурована на розділи та теми відповідно до вимог «Рекомендацій щодо розроблення навчальних програм навчальних дисциплін» (наказ МОЗ України від 12.10.2004 р. № 492). Фізична та колоїдна хімія як навчальна дисципліна: Фізична та колоїдна хімія - одна із фундаментальних дисциплін у системі вищої фармацевтичної освіти, яка продовжує хімічну підготовку провізора. Знання теоретичних основ фізичної та колоїдної хімії необхідне для глибокого вивчення аналітичної, біологічної, фармацевтичної та токсикологічної хімії, фармакогнозії та технології ліків. Вивчення курсу фізичної та колоїдної хімії дозволить майбутньому фахівцю оволодіти певним мінімумом знань у галузі виготовлення, контролю якості та зберігання ліків, а також їх біотрансформації в організмі людини.
Програма дисципліни структурована на 2 розділи: Розділ 1. Фізична хімія 1. Хімічна термодінамика 2. Хімічна кінетика та рівновага. Каталіз 3. Розчини 4. Електрохімія Розділ 2. Колоїдна хімія 5. Фізико-хімія поверхневих та сорбційних явищ. 6. Дисперсні системи. Класифікація, методи одержання та очищення. 7. Молекулярно-кінетичні, оптичні та електричні властивості дисперсних систем. 8. Стійкість та коагуляція дисперсних систем. 9. Фізико-хімія ВМР (високомолекулярних речовин). Вивчення дисципліни «Фізична та колоїдна хімія» містить обзорні лекції, практичні заняття, лабораторні роботи і самостійну роботу студентів. Теми лекційного курсу розкривають проблемні питання відповідних розділів фізичної та колоїдної хімії. Практичні заняття за методикою їх організацій є лабораторно-практичними. Проте кількість годин, відведених для лекцій і практично-лабораторних занять, недостатня для успішного засвоєння матеріалу повного курсу, тому передбачена систематична самостійна, індивідуальна робота студентів над теоретичним матеріалом. Для цього наводиться зміст програми «Фізична та колоїдна хімія» з переліком основних питань, які студент повинен знати з кожної теми, тестових та ситуаційних завдань до відповідних тем, а також відповіді на тестові завдання та приклади розв’язування ситуаційних завдань. Контроль за самостійною роботою студентів при засвоєнні розділів «Фізична хімія» та «Колоїдна хімія» здійснюється двома вхідними контрольними роботами, які проводяться під час навчальної сесії у письмовій формі з використанням тестових і ситуаційних завдань на першому практичному або семінарському занятті та будуть слугувати передмовою допуску до заліку або іспиту.
2. МЕТА ВИВЧЕННЯ НАВЧАЛЬНОЇ ДИСЦИПЛІНИ Мета вивчення фізичної та колоїдної хімії - кінцеві цілі встановлюються на основі ОПП підготовки провізора за фахом і є основою для побудови змісту навчальної дисципліни. Кінцеві цілі дисципліни: ■ Інтерпретувати з точки зору хімічної термодинаміки та класифікувати основні хімічні та фазові рівноваги та хімічні процеси для формування цілісного підходу до вивчення хімічних та біологічних процесів ■ Трактувати загальні закономірності перебігу хімічних реакцій ■ Трактувати загальні закономірності процесів сорбції ■ Класифік
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 167; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.21.68 (0.012 с.) |
















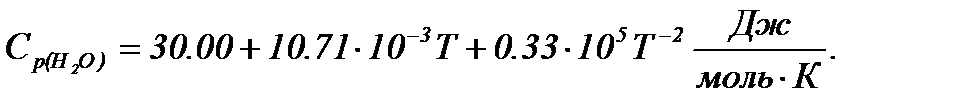



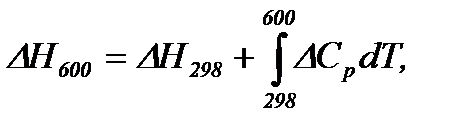

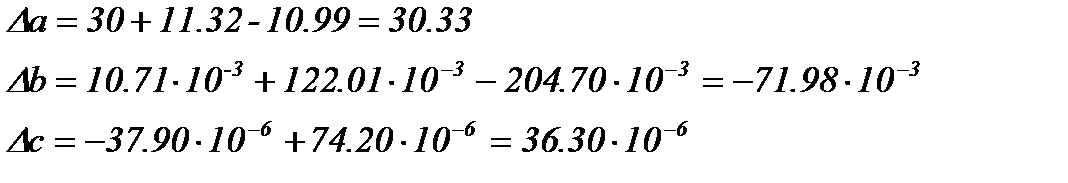


 .
. і
і  та інтегруємо рівняння Кірхгофа, маємо
та інтегруємо рівняння Кірхгофа, маємо



 і ентропії
і ентропії  при стандартних умовах можна розрахувати за наслідком із закону Гесса
при стандартних умовах можна розрахувати за наслідком із закону Гесса



 ,
,  – стандартна теплота і ентропія утворення вихідних речовин та продуктів реакції.
– стандартна теплота і ентропія утворення вихідних речовин та продуктів реакції.
 .
.



 < 0, то реакція протікає самодовільно в прямому напрямку.
< 0, то реакція протікає самодовільно в прямому напрямку.
 );
);

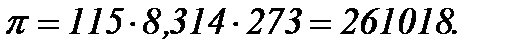



 -іонами солі, та утворювати слабодисоційовану кислоту
-іонами солі, та утворювати слабодисоційовану кислоту 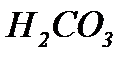 .
.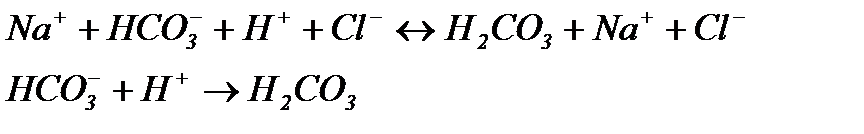
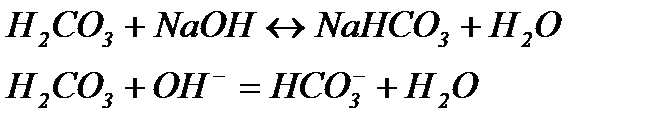
 зменшують дисоціацію Н2СО3, яка залишилася в розчині після добавлення невеликої кількість NaOH.
зменшують дисоціацію Н2СО3, яка залишилася в розчині після добавлення невеликої кількість NaOH.
 .
. .
. .
.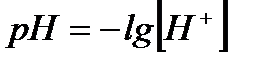 – водневий показник.
– водневий показник.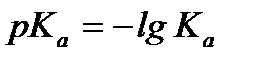 – кислотний показник.
– кислотний показник. .
.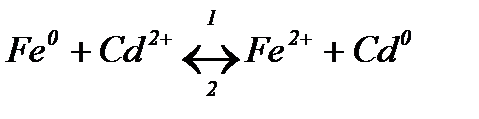 ,
, ,
, 



 .
.
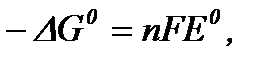

 <0, то реакція може перебігати в гальванічному елементі в прямому напрямку самодовільно. Максимальна робота при цьому дорівнює зменшенню свобідної енергії Гіббса (7720 кДж).
<0, то реакція може перебігати в гальванічному елементі в прямому напрямку самодовільно. Максимальна робота при цьому дорівнює зменшенню свобідної енергії Гіббса (7720 кДж).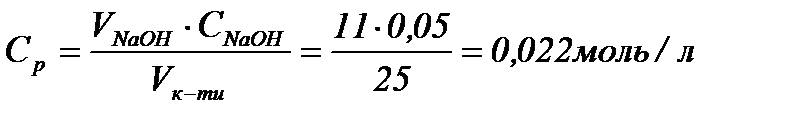




 або
або