Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дослідження нуклеїнових кислот. Методи ДНК-діагностикиСодержание книги
Поиск на нашем сайте
Методи дослідження нуклеїнових кислот. Методи виділення ДНК з рослинних і тваринних тканин і її очищення. Ферменти, використовувані для генно-інженерних досліджень. Рестріктази. ДНК-зонд. Електрофорез ДНК. Ідентифікація фрагментів ДНК і РНК методами гібридизації. Саузерн-, Норзерн-, Вестерн-блоттінг. Клонування фрагментів нуклеїнових кислот in vitro. Полімеразная ланцюгова реакція. Секвенірованіє ДНК. Методи ДНК-діагностики. Свідчення до ДНК-діагностики. Прямі і непрямі методи. ДНК-чіп. Молекулярно-генетичні методи дослідження в судовій медицині. Методи дослідження нуклеїнових кислот. Молекулярно-генетичні методи — велика і різноманітна група методів, кінець кінцем, призначених для виявлення варіацій в структурі досліджуваної ділянки ДНК (аллеля, гена, регіону хромосоми) аж до розшифровки первинної послідовності підстав. У основі цих методів лежать «маніпуляції» з ДНК і РНК. В результаті бурхливого розвитку молекулярної генетики людини в 70—80-х роках і подальшого успішного вивчення генома людини молекулярно-генетичні методи широко увійшли до медико-генетическую практики. Щоб познайомити з суттю і термінологією молекулярно-генетичних методів, нижче схемний описані їх основні етапи і варіанти. Освоєння цих методів, як і інших методів лабораторної діагностики, вимагає спеціальної підготовки у відповідних лабораторіях. Отримання зразків ДНК (або РНК) є початковим етапом всіх методів. Цей етап реалізується в двох варіантах: а) виділення всій ДНК (тотальною або геномом) з кліток; би) накопичення певних фрагментів, які передбачається аналізувати, за допомогою ПЦР (полимеразная ланцюгова реакція). Джерелом ДНК генома можуть бути будь-які ядросодержащие клітки. Виділена з кліток ДНК є всім геномом організму, тому такі зразки називають ДНК генома. На практиці частіше використовують периферичну кров (лейкоцити), хорион, амниотические клітки, культури фибробластов. Для одного аналізу необхідно мати (залежно від використовуваного методу) від декількох нанограмів до декількох микрограммов ДНК. Для цього потрібна дійсно невелика кількість біологічного матеріалу, наприклад 20—40 міліграм хориона, 1 мл крові, 5—10 міліграм культури кліток. Для здійснення деяких методів досить мати 1 краплю крові, соскоб епітелію з щоки або декілька волосяних цибулин. Можливість проведення молекулярно-генетичного аналізу з невеликою кількістю досяжного біологічного матеріалу є методичною перевагою методів названої групи. До цього ще можна додати, що виділена ДНК однаково придатна для проведення різних варіантів методів і може довго зберігатися в замороженому вигляді. Для виділення ДНК використовують різні методики залежно від поставлених завдань. Їх суть полягає в екстракції (витяганні) ДНК з біопрепарату і видаленні або нейтралізації сторонніх домішок для отримання препарату ДНК з чистотою, придатною для постановки ПЦР. Іноді буває досить прокип'ятити зразок протягом 5-10 мин., проте в більшості випадків потрібні складніші методи. Стандартною і такою, що стала вже класичною вважається методика отримання чистого препарату ДНК по Мармуру. Вона включає ферментативный протеолиз з подальшою депротеинизацией і переосаждением ДНК спиртом. Цей метод дозволяє отримати чистий препарат ДНК. Проте він досить трудомісткий і припускає роботу з такими агресивними і такими, що мають різкий запах речовинами, як фенол і хлороформ. Одним з популярних в даний час є метод виділення ДНК, запропонований Boom із співавторами. Цей метод заснований на використанні для лізису кліток сильного хаотропного агента - гуанидина тиоционата (GUSCN), і подальшій сорбції ДНК на носієві (скляні намиста, диатомовая земля, скляне «молоко» и.т.д.). Після відмивань в пробі залишається ДНК, сорбована на носієві, з якого вона легко знімається за допомогою элюирующего буфера. Метод зручний, технологічний і придатний для підготовки зразка до ампліфікації. Проте можливі втрати ДНК унаслідок необоротної сорбції на носієві, а також в процесі численних відмивань. Особливо велике значення це має при роботі з невеликими кількостями ДНК в зразку. Крім того, навіть кількості слідів GUSCN можуть інгібірувати ПЦР. Тому при використанні цього методу дуже важливий правильний вибір сорбенту і ретельне дотримання технологічних нюансів. Слід зазначити, що через велику кількість стадій додавання і видалення розчинів при роботі із зразком потрібна акуратність, оскільки можлива перехресна контамінація між пробами аэрозолью ДНК, що утворюється. Інша група методів пробоподготовки заснована на використанні іонообмінників типу Chilex, які, на відміну від скла, сорбували не ДНК, а навпаки, домішки, що заважають реакції. Як правило, ця технологія включає дві стадії: кип'ячення зразка і сорбція домішок на іонообміннику. Метод надзвичайно привабливий простотою виконання. В більшості випадків він придатний для роботи з клінічним матеріалом. На жаль, іноді зустрічаються зразки з такими домішками, які неможливо видалити за допомогою іонообмінників. Крім того, деякі мікроорганізми не піддаються руйнуванню простим кип'яченням. У цих випадках необхідне введення додаткових стадій обробки зразка. При масовому скринінгу, коли важливо отримати статистичні дані, можливе використання простих методів із застосуванням детергентов або обробки біологічного матеріалу лугами з подальшою їх нейтралізацією. В той же час, використання подібних методів пробоподготовки для клінічної діагностики може приводити до ложноотрицательным результатів, унаслідок використання в реакційній суміші неякісного препарату ДНК. Таким чином, до вибору методу пробоподготовки слід відноситися з розумінням цілей проведення передбачуваних аналізів. Зразки тканин, що отримуються при хірургічних операціях, зазвичай фіксують формаліном і заливають в парафін. Такі фіксовані препарати також можуть використовуватися для проведення ПЦР. Ферменти, використовувані для генно-інженерних досліджень. Рестріктази. Одним з найважливіших інструментів генної інженерії є эндонуклеазы — ферменти, що розщеплюють ДНК по специфічних послідовностях нуклеотидов усередині ланцюга. Ці ферменти отримали назву рестриктаз. Рестріктази розщеплюють ДНК на відносно невеликі фрагменти в ділянках строго певних послідовностей. Цим їх дія відрізняється від більшості інших ферментативных, хімічних або фізичних дій, що приводять до випадкових розривів ланцюгів ДНК. Рестріктази (вже відкрито більше 200 типів ферментів цього класу) є частиною захисної системи бактерій, що охороняють власний геном від чужорідної, головним чином вірусної ДНК. Рестріктази прийнято іменувати по назві бактерій, з яких їх виділяють. Так, назва ECORI свідчить про те, що цей фермент з Esherichia coli, Ватн1 — з Bacillus amilolquefacientsi. Кожен фермент дізнається певну 4-7-членную послідовність в двухцепочечной ДНК. Розрізання ДНК по цих сайтах приводить до утворення або «тупих» (наприклад, при дії рестриктаз Hpal), або «липких», тобто що перекриваються (наприклад, Ватн1), кінців. Для конструювання гібридних молекул особливо зручні липкі кінці. Будь-який фрагмент ДНК володіє характерним розташуванням сайтів пізнавання різних рестриктаз, що дозволяє будувати так звані рестриктазные карти. При розщеплюванні ДНК який-небудь одним рестриктазой отримують суміш фрагментів, кожен з яких має одні і ті ж кінцеві ділянки. Такі фрагменти можна розділити і ідентифікувати методом электрофореза в агарозном або полиакриламидном гелі. Частина ферментів, вживаних для дослідження ДНК, представлена в таблиці 10. ДНК-зонд. Інформація про все різноманіття організму поміщена в його генетичному матеріалі. Так патогенність бактерій визначається наявністю в них специфічного гена або набору генів, а спадкове генетичне захворювання виникає в результаті пошкодження певного гена. Сегмент ДНК детермінуюча дана біологічна ознака має строго певну послідовність і може служити діагностичним маркером. У основі багатьох швидких і надійних діагностичних методів лежить гібридизація нуклеїнових кислот - спаровування двох компліментарних сегментів різних молекул ДНК.
Табл.10. Основні ферменти, використовувані в генній інженерії
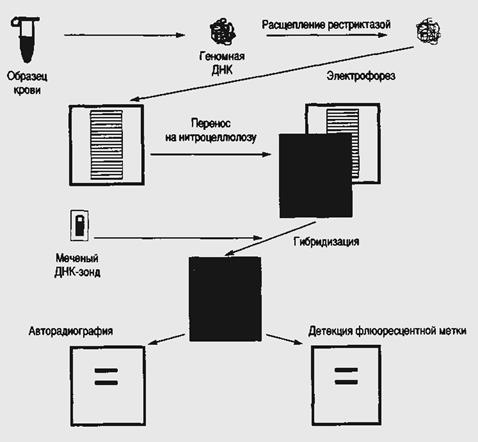
У діагностичних тестах, заснованих на гібридизації нуклеїнових кислот, ключовими є три компоненти: ДНК-зонд, ДНК-мішень і метод детекции гибридизационного сигналу. Система детекции повинна бути надзвичайно специфічною і високочутливою. Щоб забезпечити адекватність діагностичного тесту гибридизационные ДНК- і РНК-зонды повинні бути высокоспецифичнными. Іншими словами необхідно, щоб зонд гибридизовался тільки з шуканою нуклеотидной послідовністю. Якщо є вірогідність отримання ложноположительного (наявність гибридизационного сигналу у відсутності послідовності мішені) або ложноотрицательного (відсутність сигналу за наявності послідовності - мішені) результату, то доцільність застосування тесту значно знижує специфічність зондів, яка може виявлятися на різних рівнях: вони можуть «розрізняти» два і більш за вигляд, окремі штами в межах одного вигляду або різні гени. Залежно від ситуації зонди можуть бути представлені молекулами ДНК і РНК; вони можуть бути довгими (більше 100 нуклеотидов) або короткими (менше 50 нуклеотидов), є продукт хімічного синтезу, клоновані интактнные гени або їх фрагменти. Зонди отримують різними способами. Один з них полягає в наступному. ДНК патогенного мікроорганізму розщеплює за допомогою рестрицирующей эндонуклеазы і клонує в плазмидном векторі. Потім проводять скринінг рекомбинантных плазмид з використанням ДНК генома як патогенного, так і непатогенного штамів. Ті плазмиды, які містять послідовності, гибридизующиеся тільки з ДНК патогенного штаму, складають основу видоспецифических зондів. Після цього проводять ряд додаткової гібридизації з ДНК, виділеною з різних організмів, щоб упевнитися, що потенційні зонди не дають з ними перехресної гібридизації для визначення чутливості методу кожен із зондів перевіряють також на модельних зразках, у тому числі і на змішаних культурах. Вельми бажано, щоб ДНК-діагностові можна було проводити на початковому матеріалі, без додаткового його культивування або виділення нуклеїнових кислот, особливо в тих випадках, коли тестуються клінічні зразки. Дослідники з успіхом проводять гібридизацію з ДНК- мішенями, присутніми в зразках калу, сечі, крові, змивах із зіву і тканинах без попереднього їх очищення. Якщо концентрація послідовності мішені в досліджуваному зразку дуже мала, її можна амплифициравать за допомогою ПЦР. Як приклад використання ДНК-зонда для діагностики захворювань можна привести процедуру виявлення Plasmodium falciparum. Цей паразит викликає малярію, захворювання, яке загрожує приблизно третини всього населення Землі. Він інфікує еритроцити і руйнує їх, що приводить до розвитку лихоманки, а у важких випадках до ураження мозку, нирок і інших органів. Щоб виявити джерела інфекції, оцінити ефективність заходів по їх ліквідації і забезпечити ранню діагностику і лікування, необхідно достатньо чутливі, прості і недорогі методи. В даний час малярію діагностують за допомогою мікроскопічного дослідження мазків крові - ефективний, але трудомісткий і займаючий багато часу процесу. Імунологічні методи виявлення Plasmodium, такі як ELISA, достатньо швидкі і їх легко автоматизувати, але з їх допомогою не можна відрізнити поточну інфекцію від тієї, що пройшла, оскільки при цьому визначаються тільки наявність антитіл до Plasmodium в крові хворого. Для виборчої ДНК-діагностики поточної інфекції, тобто для виявлення ДНК-збудника, як основа використовують послідовності ДНК Plasmodium falciparum, що високоповторюються. Спочатку за допомогою ДНК-зонда проводять скринінг бібліотеки ДНК генома паразита. Потім відбираються клони що дають найбільш інтенсивний гибридизационный сигнал, оскільки саме вони імовірно містять послідовності, що високоповторюються. ДНК кожного з відібраних клонів перевіряють на здібність до гібридизації з ДНК видів Plasmodium, що не викликають малярію. Як специфічний зонд вибирається послідовність гибридизующейся ДНК з Plasmodium falciparum, але не з ДНК Plasmodium vivax, Plasmodium cynomolgi або з ДНК людини. З його допомогою можна виявити всього 10 пг очищеною ДНК Plasmodium falciparum або 1 нг тієї ж ДНК в крові хворого. Отримано і охарактеризовано більше 100 різної ДНК-зонда, У більшості лабораторій для гібридизації використовують зонди, що мітяться яким-небудь радіоактивним ізотопом, частіше всього 32Р. Такі зонди володіють високою питомою радіоактивністю і забезпечують хороші відношення сигнал / шум. Радіоактивний мічений зонд наносять на фільтр з фіксованою на нім ДНК-мішенню, проводять гібридизацію, відмивають ДНК-зонд, що не зв'язалася, і детектують мітку за допомогою радіоавтографа. Проте 32Р є короткоживучим ізотопом, що випускає високоенергетичне випромінювання; при роботі з ним необхідно використовувати спеціальне устаткування і забезпечити безпечну утилізацію відходів. Щоб обійти ці труднощі, були створені не радіоактивні системи детекции. Для посилення гибридизационного сигналу в цьому випадку використовується ферментативное перетворення хромогенного або хемилюминесцентного субстрата: перший з них під дією ферменту змінюють забарвлення, а другий - випускає світло. Один з недавно розроблених нерадіоактивних методів детекции заснований на використанні зонда - «молекулярного маяка». Такий зонд складається з 25 нуклеотидов. До 5' кінця приєднаний флуоресцентний хромофор, а до 3' кінця - не флуоресцентний хромофор, на який передається енергія збудження флуорофора. У розчині при кімнатній температурі маяк має таку конфігурацію, при якій флуорофор і тушитель знаходитися в тісному контакті і флуоресценція флуорофора гаситься. Коли 15 середніх нуклеотидов зонда гибридизуется з комплементарною послідовністю ДНК- і РНК-мишени, відбувається просторове розділення флуорофора і тушителя і зонд випускає світло. Необхідно також, щоб все 15 нуклеотидов зонда були комплементарними відповідній послідовності ДНК- і РНК-мишени. Електрофорез фрагментів ДНК забезпечує розділення цих фрагментів при їх розподілі на поверхні агарозного або полиакриламидного гелю. Фрагменти ДНК рухаються в гелі, поміщеному в постійне електричне поле, від негативного полюса до позитивного залежно від розмірів (чим більше відносна молекулярна маса фрагмента, тим повільніше він рухається в електричному полі). Після закінчення электрофореза кожен фрагмент ДНК займає певне положення у вигляді дискретної смуги в конкретному місці гелю. Довжину кожного фрагмента можна визначити шляхом порівняння пройденої фрагментом відстані з відстанню, пройденим стандартним зразком ДНК з відомими розмірами. Ідентифікація фрагментів ДНК і РНК методами гібридизації в гелі є або кінцевим етапом діагностики, або необхідним елементом подальшого аналізу. Для ідентифікації і виділення, що цікавлять дослідника клонів бактерій з химерною ДНК розроблений метод гібридизації в бактерійних колоніях. Для цього на численні колонії бактерії, вирощені на твердому середовищі, спочатку накладають фільтр нітроцелюлози. Частина бактерій прилипає до фільтру. Після лізису кліток, денатурація і фіксації ДНК фільтр інкубують в розчині з радіоактивно міченим зондом. Після закінчення гібридизації фільтр відмивають від надлишку зонда і виявляють мічений гібридний комплекс, що утворився, шляхом контакту з рентгенівською плівкою. Порівнюючи положення плями на радіоавтографі з положенням колоній на чашці, вибирають ту з них, яка дала позитивний сигнал. Всі різновиди методів гібридизації базуються на комплементарних взаємодіях азотистих підстав різних ланцюгів нуклеїнових кислот. Точна відповідність послідовностей гибридизующихся фрагментів приводить до швидкого утворення міцного стійкого комплексу. В цілому методи гибридизационного аналізу можна розділити на два типи: · методи гибридизационного аналізу, що проводяться в розчині (гомологичные); · методи гибридизационного аналізу, що проводяться на твердому носієві (гетерогенні). Метод гібридизації в розчині. При гібридизації в розчині шукана нуклеїнова кислота і зонд вільно взаємодіють у водній реакційній суміші, що підвищує швидкість процесу гібридизації. Детекцию результатів гібридизації в розчині здійснюють шляхом нуклеазного гідролізу одноцепочечных ДНК і виділення двухцепочечных гібридів, що залишилися, містять мічений зонд. Для успішного проведення реакції гібридизації в розчині необхідно застосовувати одноцепочечные зонди, нездібні до самогибридизации. Метод хороший ще і тим, що вимагає мінімальних об'ємів і кількостей біологічного і клінічного зразків, тому може бути використаний в діагностичних цілях. В той же час цей метод має один істотний недолік — на його основі можна створити діагностичні тест-системи для виявлення специфічних фрагментів невеликих ділянок ДНК за умови достатньої високої концентрації шуканих фрагментів або ділянок в досліджуваному зразку. Це знижує поріг чутливості до рівня иммуноферментного аналізу і навіть нижче. Метод гібридизації на твердому носієві. Принцип методу заснований на гібридизації зонда на твердій поверхні. Як тверда поверхня найчастіше використовують полімерний мембранний фільтр, наприклад, нейлонову мембрану. В більшості випадків процедуру проведення аналізу можна розділити на наступні стадії: підготовка зразка (зокрема екстракція і виділення ДНК), фіксація проби на носієві, передгібридизація, власне гібридизація, відмивання продуктів, що не зв'язалися, детекция. Для підготовки проби, можливо, необхідне попереднє «підрощування» досліджуваного матеріалу для ідентифікації окремих колоній бактерій або збільшення концентрації вірусів в клітинній культурі. Проводиться і безпосередній аналіз зразків кліток, сечі, уретральных соскобов, формених елементів крові або цілісної крові на присутність інфекційних агентів. Для звільнення нуклеїнових кислот з складу клітинних структур проводять лізис кліток, а в деяких випадках очищають препарат ДНК за допомогою фенолу. Денатурація ДНК, тобто перехід в одноцепочечную форму, відбувається при обробці лугом. Потім зразок нуклеїнової кислоти фіксують на носієві — мембрані нітроцелюлози або нейлонової, зазвичай шляхом інкубації від 10 мін до 4 ч при 80°С у вакуумі. Далі в процесі передгібридизації досягається инактивация вільних місць скріплення для зменшення неспецифічної взаємодії зонда з мембраною. Після чого шукані фрагменти ДНК (РНК) комплементарно зв'язуються із специфічним зондом, і тоді даний метод називають ДНК-ЗОНДОВОЇ діагностикою. Далі здійснюють детекцию одним з можливих методів (авторадіографічним, ферментативно-гибридизационным і так далі). Метод «сэндвич»- гібридизації. Метод є одному з різновидів зондської технології (DNA-probe). При його використанні застосовуються два зонди, гомологичные різним ділянкам шуканої нуклеїнової кислоти. Один зонд фіксують на мембрані для того, щоб зв'язати шукану нуклеїнову кислоту, присутню в досліджуваному зразку. Після здійснення гібридизації мембрану відмивають від досліджуваного матеріалу і додають розчин, що містить другий зонд, який має певну мітку. Процес гібридизації проводять повторно, і при цьому зонд з міткою взаємодіє з шуканою ділянкою ДНК (РНК). Методи блот-гибридизации. Ідентифікація конкретних фрагментів в гелі серед ДНК генома є складнішим завданням. Із-за великих розмірів генома людини після рестрикції утворюється настільки велике число рестриктных фрагментів, що агарозный гель після электрофореза і забарвлення этидия бромідом при ультрафіолетовому опромінюванні виглядає як більш менш рівномірно забарвлена поверхня. Завдання генетика — виявити специфічні фрагменти ДНК. ДНК, розділену гель-электрофорезом, можна перенести з гелю на фільтр нітроцелюлози. Для цього її денатурують в гелі лугом, нейтралізують гель, і потім прикладають до нього фільтр нітроцелюлози, забезпечуючи повільний струм буфера через гель і фільтр. Денатурована ДНК диффундирует і затримується на фільтрі, після нагрівання, якого у вакуумі вона «запікається» і иммобилизуется, тобто обездвиживается на фільтрі. Її розподіл на площині фільтру таке саме, як і на площині гелю. Проте на відміну від гелю фільтр з ДНК можна використовувати для подальшої гібридизації з міченою пробою, тобто з міченою ДНК і РНК. Для цього інкубують фільтр з розчином, що містить мічену пробу, при підвищеній температурі, потім ретельно відмивають його і, нарешті, піддають авторадіографії, тобто витримують з рентгенівською фотоплівкою. При прояві останніми на ній виявляються смуги, відповідні смугам ДНК на фільтрі, сгибридизовавшимся з радіоактивною пробою. Процедура перенесення ДНК з гелю на фільтр позначається англійським терміном blotting (намокання). Тому для таких фільтрів з ДНК використовується термін «блот» (blot). По імені автора Е. Саузерна ці блоты називаються «Блотамі Саузерна» (Southern blots). Замість ДНК можна перенести на фільтри з гелю РНК. Такі фільтри називають Норзерн-фильтрами [гра слів: прізвище Саузерн означає «південний»; фільтри з ДНК по Саузерну — південні блоты; фільтри з РНК жартівливо позначили як північні блоты (Northern); фільтри з белками— як західні (Western)]. Щоб проводити гібридизацію з Саузерн- і Норзерн- фільтрами, що містять вельми малі кількості індивідуальної ДНК і РНК, були потрібні дуже високомічені проби. Їх навчилися робити шляхом энзиматического введення влучні у виділені препарати нуклеїнових кислот. Найбільш поширений метод — це так звана ник-трансляция (nick-translation). ДНК інкубують з двома ферментами, ДНК-полимеразой I і Днказой I (остання береться в нікчемних кількостях разом з високоміченими попередниками ДНК, дезоксирибонуклеозидтрифосфатами). Днказа вносить до двухцепочечную ДНК одноцепочечные розриви. На ці місця сідає ДНК-полимераза і руйнує один з ланцюгів ДНК, одночасно наново її забудовувавши, але використовуючи при цьому мічені попередники. Таким чином, велика частина ДНК заміщається радіоактивною, зберігаючи при цьому свою нуклеотидную послідовність. Є і інші методи включення влучні в ДНК і РНК. Розглянемо блот-гибридизацию по Саузерну (1975). Ця методика складається з декількох етапів етапів (рис.49). Після закінчення электрофореза гель поміщають в розчин підстави (луги), в якій двухцепочечные фрагменти ДНК втрачають зв'язки і стають одноцепочечными. Перенесення ДНК з гелю на фільтр нітроцелюлози або нейлонового проводиться в буферному розчині. Безпосередньо на поверхню гелю кладуть фільтр і стопку фільтрувального паперу. Із-за капілярного ефекту створюється струм буфера, перпендикулярний площині гелю. ДНК, що вимивається з гелю, затримується фільтром і практично повністю виявляється на його поверхні. Після перенесення одноцепочечные нитки фіксують на фільтрі. Розташування фрагментів на фільтрі точно відповідає їх розташуванню в гелі. Для того, щоб візуально виявити потрібні фрагменти (фіксована на фільтрі ДНК не видно), проводять гібридизацію із специфічним по нуклеотидной послідовності міченим радіонуклідом або флюоресцентною
Ріс.49. Блот-гибридизация по Саузерну
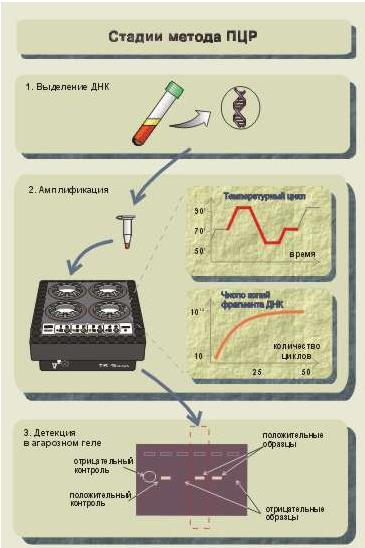
міткою олигонуклеотидным синтетичним зондом (16—30 пар нуклеотидов) або клонованим фрагментом ДНК. Нуклеотідная послідовність зонда повинна бути повністю або частково комплементарна ділянці ДНК генома, що вивчається. При інкубації фільтру з розчином, що містить мічений зонд, відбувається гібридизація комплементарних ланцюгів ДНК-зонда і фрагмента на фільтрі. Неспецифічно зв'язані молекули зонда відмиваються за допомогою спеціальної процедури. Радіоактивно мічені ділянки виявляють шляхом експонування фільтру з рентгенівською плівкою (авторадіографія). Після прояву на плівці видно смуги міченої зондом ДНК. Нерадіоактивні мітки візуалізують за допомогою флюоресценції або опосередковано за допомогою антитіл. Блот-гибірідізация — високочутливий, але дорогий і трудомісткий метод виявлення специфічних послідовностей ДНК. Метод норзерн-блот-гибридизации — Northern-blot. Метод використовується для визначення рівня експресії гена шляхом кількісної оцінки иРНК. Метод складний і тривалий по виконанню (5—7 діб). Труднощі пов'язані з необхідністю блокувати при виділенні РНК так звані Рнкази, які надзвичайно стабільні і стійкі по відношенню до багатьом хімічним процедурам, вживаним при екстракції РНК. Процедури блот-гибридизации по Е. Саузерну і нозерн-блот-гибридизации не знайшли застосування в клінічній мікробіології, оскільки вони трудомісткі. Точками додатку даних методів з'явилися завдання, пов'язані з проведенням наукових досліджень і завдань по вивченню структури генома ДНК (РНК), а також для виявлення точкових мутацій. Метод гібридизації in situ (ISH - in situ hybridization). Метод заснований на проведенні процесів гібридизації безпосередньо на зрізі або в мазанні з використанням будь-яких зондів. Приватна методика гібридизації in situ — FISH (fluorescent in situ hybridization), дозволяє встановити наявність патогена в препаратах, фіксованих у формаліні, і залитих парафіном зрізах і пунктатах тканині, що особливо важливе при патоморфологічному аналізі. Метод гібридизації in situ базується на основних принципах гібридизації твердофазной і гібридизація в розчині. Чутливість методу гібридизації in situ обмежена можливістю проникнення зондів всередину кліток для пов'язання з шуканою мішенню. Процес гібридизації проходить в тканинах, при цьому зонд забезпечений флуоресцентною міткою. Після промивки матеріалу і видалення молекул, що не зв'язалися, здійснюється детекция, для чого мазок або зріз проглядають у флуоресцентному мікроскопі. Метод ISH складний для здійснення і в порівнянні з іншими молекулярними методами малочутливий. Метод найбільш зручний для визначення мішеней, наприклад, вірусів в інфікованих клітках, які представлені великим числом копій. Метод розгалуженої ДНК (branch-DNA). Шукана нуклеїнова кислота зв'язується з уловлюючим зондом, один кінець якої комплементарен мішені, а інший — певному кінцю підсилюючого зонда. При цьому підсилюючий зонд може бути комплементарен наступному зонду і так далі Кількість зондів може бути велике, і всі вони пов'язані з декількома (від одного до декількох десятків) люмінофорами, які у міру збільшення кількості зв'язаних зондів підсилюють (хеми-, флуоро-) люмінесценцію. Перевагою даного методу є можливість використання в одній реакції декількох уловлюючих зондів, що зв'язуються з мішенню, що забезпечує виявлення агентів, що характеризуються значною гетерогенністю генома, наприклад, вірус імунодефіциту людини. Останнім часом в практиці знайшов застосування метод гібридизації в розчині із зондами, міченими акридином. Результати гібридизації реєструють по випусканню міткою світла певної довжини хвилі після обробки лугом. В даний час ведуться інтенсивні розробки по вдосконаленню методів гібридизації в наступних напрямах: · Спрощення процедури генного зондування до однієї — двох стадій процесу. · Відмова від сорбції на мембрані. · Підвищення чутливості гибридизационных методів за рахунок використання процедури ампліфікації сигналу із зонда. Активні розробки по третьому напряму стали можливими лише з моменту появи і впровадження в практику методів ампліфікації нуклеїнових кислот. Клонування фрагментів нуклеїнових кислот in vitro. Полімеразная ланцюгова реакція (ПЦР). В більшості випадків для успішної діагностики хвороби або гетерозиготного стану досить досліджувати лише невеликий фрагмент генома, тому для проведення аналізу необхідно отримати достатню кількість таких фрагментів, тобто амплифицировать (помножити) їх. Раніше це завдання вирішувалося за допомогою трудомісткого підходу: створення рекомбинантной плазмиды - введення плазмиды в бактерійну клітку - розмноження бактерійних кліток - виділення заданих фрагментів ДНК. Тепер це завдання - накопичення потрібних фрагментів ДНК - вирішується за допомогою ПЦР. Відкриття даної реакції зробило справжню революцію у вивченні генома людини і в молекулярно-генетичній діагностиці спадкових хвороб. Полімеразная ланцюгова реакція (ПЦР) — метод ампліфікації ДНК in vitro. Протягом декількох годинників можна розмножити певну послідовність ДНК в кількості, що перевищує початкове в мільйон разів і більш. Отже, початково потрібна дуже незначна кількість матеріалу. Необхідною умовою для проведення ПЦР є знання нуклеотидной послідовності амплифицируемого фрагмента або, принаймні, цього фрагмента (рис.50). Відповідно до нуклеотидной послідовності кінців досліджуваної ділянки синтезується два олигонуклеотидных праймера (приманки). Довжина праймеров складає 20—30 пар нуклеотидов. Процес ампліфікації полягає в здійсненні циклів, що повторюються. Кожен цикл включає 3 стадії: температурна денатурація ДНК (розділення двухцепочечной ДНК на одноцепочечные молекули) - приєднання праймеров до комплементарних послідовностей одноцепочечных молекул (відпал) - синтез полинуклеотидных ланцюгів на одноцепочечных молекулах у межах приєднаних праймеров за допомогою полимеразы. Вперше склад інгредієнтів, що входять в реакційну суміш для постановки полимеразной ланцюгової реакції, і основні принципи використання праймеров для отримання копій ДНК були описані Kleppe з соавт. у 1971 році. Проте тоді ще не була продемонстрована основна межа ПЦР - експоненціальне збільшення кількості копій фрагмента початкової ДНК як результат реакції. Це було здійснено в 1985 р. Подальше використання в ПЦР термостабільної ДНК-полимеразы істотно розширило можливості її застосування, як в наукових цілях, так і в клініці. Метод став настільки популярний, що сьогодні вже важко представити роботу в області молекулярної біології без його використання. Особливо бурхливий розвиток метод полимеразной ланцюгової реакції отримав завдяки міжнародній програмі «Геном людини». Були створені сучасні лазерні технології сиквенирования (розшифровки нуклеотидных послідовностей ДНК). Якщо в недавньому минулому для розшифровки послідовності ДНК розміром в 250 пар нуклеотидов (п.н.) був потрібний тиждень, то сучасні лазерні секвенаторы дозволяють визначати
Ріс.50. Три етапи ПЦР-анализа
до 5000 п.н. у день. Це у свою чергу сприяє значному зростанню інформаційних баз даних, що містять послідовності ДНК. В даний час запропоновані всілякі модифікації ПЦР, показана можливість створення тест-систем для виявлення мікроорганізмів, виявлення точкових мутацій, описані десятки різних застосувань методу. В даний час ПЦР використовується при діагностиці: генетичних, інфекційних і онкологічних захворювань; патогенов в їжі; ідентифікації особи; у судовій медицині, криміналістиці; при трансплантації органів і тканин; визначенні батьківства. На відміну від иммуноферментного аналізу, який широко використовується для діагностики інфекційних захворювань, ДНК-діагностика дозволяє визначати безпосередньо збудника захворювання. За допомогою вдосконалених схем постановки ПЦР можна виявляти патогенні мікроорганізми в дуже низькій концентрації. ДНК-діагностика раки обмежується невеликою, але активно зростаючою кількістю відомостей про гени, що асоціюються з раком. В рамках проекту «Геном людини» учені продовжують пошуки мутацій, що асоціюються з цим типом захворювань. Полімеразная ланцюгова реакція - це здійснювана in vitro специфічна ампліфікація нуклеїнових кислот, що ініціюється синтетичними олигонуклеотидными праймерами; її основні етапи представлені на мал. ПЦР-цикл складається з теплової денатурації ДНК, її відпалу з праймером і подовженнями ланцюга (элонгации); зміна цих етапів відбувається в результаті простої зміни температури. Праймери при цьому орієнтуються на матриці так, що число раундів реплікації росте експоненціально, відповідно збільшується і число копій специфічної нуклеотидной послідовності. Застосування молекулярних методів для цілей клінічної діагностики обмежується їх невисокою чутливістю і тривалістю аналізу. Так, для виявлення нуклеїнової кислоти-мішені методом гібридизації in situ з присутня в препараті в декількох тисячах копій. Нерідко число аномальних послідовностей в клінічному препараті диагностически- значущо, але менше цієї величини і гібридизація може дати ложноотрицательный результат. На відміну від цього ПЦР дозволяє виявити унікальну нуклеотидную послідовність. Для цього в реакційну суміш додають у великому надлишку специфічні для даної послідовності олигонуклеотидные праймеры («амплимеры»), які утворюють з нею комплекс, і проводять реплікацію ДНК in vitro. Оскільки амплимеры гибридизуются з обома ланцюгами ДНК, то і нативная послідовність, і ПЦР-продукты, що синтезуються, можуть служити матрицями в подальших раундах реплікації, внаслідок чого число копій унікальної послідовності експоненціально збільшується. Завдяки цьому послідовності, присутні в клінічному препараті у мінімальній кількості (одна або декілька копій) і що не виявляються ніякими іншими методами, легко виявляються за допомогою ПЦР. ПЦР дозволяє знайти всього одну аномальну послідовність на 100000-1000000 нормальних кліток. Експоненціальне збільшення числа копій молекули-мішені не тільки забезпечує високу чутливість методу, але і полегшує їх виявлення. Кожен раунд ПЦР займає від 2 до 5 мін, і зазвичай для досягнення необхідної чутливості достатні 25-50 раундів, тобто 2-4 ч (рис.51). Крім того, оскільки зміст ПЦР-продуктов достатньо великий, можна використовувати неізотопні методи детекции. Ампліфікація РНК. Можливість використання РНК як мішень для ПЦР істотно розширює спектр застосування цього методу. Наприклад, геноми багатьох вірусів (гепатиту З, вірус інфлуенци, пикорнавирусы і так далі) представлені саме РНК. При цьому в їх життєвих циклах відсутня проміжна фаза перетворення в ДНК. Для детекции РНК необхідно в першу чергу перевести її у форму ДНК. Для цього використовують зворотну транскриптазу, яку виділяють з двох різних вірусів: avian myeloblastosis virus і Moloney murine leukemia virus. Використання цих ферментів пов'язане з деякими труднощами. Перш за все, вони термолабильны і тому можуть бути використані при температурі не вище
|
|||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-13; просмотров: 1118; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.96 (0.015 с.) |