Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Макромолекули як обьекты вивчення молекулярної біологіїСодержание книги
Поиск на нашем сайте
Білки, їх роль в забезпеченні біологічної специфічності. Амінокислоти, їх властивості. Формування полипептидной ланцюга. Первинна, вторинна, третинна і чверткова структури білка. Конформація – основа властивостей білка. Фолдінг. Поняття про прионных захворювання. Класифікація білків згідно їх біологічним функціям. Білки-переносники, сигнальні, захисні, структурні, рецепторні, регуляторні, ферменти. Поняття про протеомике.
Макромолекули клітки. З простих органічних молекул синтезуються крупніші макромолекули. Макромолекула — це крупна молекула, побудована з багатьох одиниць, що повторюються. Вона є полімером, що складається з мономерів. Існує 3 типи макромолекул: білки, нуклеїнові кислоти і полісахариди. Деякі ліпіди умовно можна вважати макромолекулами. Макромолекули складають до 90 % сухої маси кліток.
Білки. Клітки в значній мірі складаються з білків, яких припадає на частку більше половини від сухої речовини. Білки визначають структуру і форму клітки; крім того, вони служать інструментами молекулярного пізнавання і каталізу. Білки безпосередньо беруть участь в процесах обміну речовин, метаболізмі і підтримці всіх функцій клітки. Білки – це полімерні біоорганічні з'єднання, мономерами яких є залишки амінокислот, сполучених кислото – амидными (пептидними) зв'язками (-NH-C(O) -). Амінокислоти. Амінокислотами називаються з'єднання, що містять одночасно амино- і карбоксильну групу:
По числу аминных і карбоксильних груп, а також залежно від радикала R амінокислоти підрозділяються на моноаминокарбоновые (глицин, аланин, валин, лейцин, изолейцин, серин, треонин, метіонін, цистеин, цистин), диаминокарбоновые (лізин, аргінін), аминодикарбоновые (аспарагиновая і глутаминовая кислоти), ароматичні (фенилаланин, тирозин) і гетероциклічні (пролин, оксипролин, гистидин, триптофан). Якщо взяти до уваги полярність і заряд радикала R, то можна розділити амінокислоти на чотири класи: –амінокислоти з неполярними (гидрофобными) R-группами (аланин, валин, лейцин, изолейцин, метіонін, пролин, триптофан, фенилаланин); –амінокислоти з полярними (гідрофільними) незарядженими R-группами (глицин, серин, треонин, цистеин, тирозин, аспарагин, глутамин); –амінокислоти з негативно зарядженими R-группами (кислі амінокислоти – аспарагиновая і глутаминовая кислоти); –амінокислоти з позитивно зарядженими R-группами (основні амінокислоти – лізин, аргінін, гистидин). Відмічені 20 амінокислот входять до складу природних білків і пептидів і називаються протеиногенными. Вони мають такі властивості: 1) кислотний – основні, тобто, будучи амфотерными електролітами, можуть диссоциировать з утворенням аніонів або катіонів; 2) полярність – можуть бути гідрофільними або гидрофобными; 3) оптичность – Ь-атом вуглецю представляє центр молекули всіх (окрім глицина) амінокислот і вони тому є оптично активними з'єднаннями; 4) здібність до освіти кислотний – амидных (пептидних) зв'язків; 5) хімічні реакції (нингидриновая, флуорескаминовая, ксантопротеиновая, Мілона, Сакагучи, Ерліха, Фоля), які використовуються в аналітичній і клінічній біохімії для ідентифікації і кількісного визначення окремих амінокислот(у плазмі крові, сечі і ін.). По своїй абсолютній конфігурації протеиногенные амінокислоти є стереоизомерами L- ряду (L- амінокислотами).D- амінокислоти до складу природних білків не входять. Вони є в деяких антибіотиках – грамицидине і актиномицине D. З 20 протеиногенных амінокислот 10 є для людини незамінними, тобто що не синтезуються в організмі - аргінін, лізин, валин, гистидин, лейцин, изолейцин, треонин, триптофан, метіонін, фенилаланин. Виключення якої-небудь незамінної амінокислоти з їжі приводить до розвитку негативного азотистого балансу, виснаження, зупинки зростання. Дефіцит в їжі окремих незамінних амінокислот викликає порушення синтезу білка з подальшими клінічними симптомами. Наприклад, дефіцит триптофана викликає розвиток катаракти, випадання волосся, поразка зубів, зниження маси тіла. Тріптофан є попередником в біосинтезі таких фізіологічно активних з'єднань, гормонального і медиаторного дії, як серотонін і нікотинова кислота. Дефіцит лізину викликає підвищену сприйнятливість до шуму, нудоту, запаморочення. Відсутність лейцина у молодих людей супроводжується головними болями, втратою апетиту, швидкою стомлюваністю, психічною пригніченістю. При порушенні метаболізму лейцина, изолейцина і валина розвивається хвороба «кленового сиропу» (уповільнення зростання, порушення живлення, сонливість, неврологічні стани). Важливим учасником внутріклітинного метаболізму і донором метильной (-CH3) групи в численних реакціях метилирования є метіонін. Аргінін бере участь в утворенні сечовини – кінцевого продукту аминобмена. Крім того, встановлена роль аргініну як попередника в генерації оксиду азоту (NO) – модулятора таких фізіологічних функцій: регуляції тонусу гладких м'язів, імунних процесів і нейротрансмиссии. Фенілаланін і тирозин забезпечують утворення головних катехоламинов організму (дофамина, норадреналіну, адреналіну), тиреоїдних гормонів і меланінів. Порушення обміну цих амінокислот приводить до ряду захворювань: фенілкетонурії, алкаптонурии, альбінізму, тирозинемии. Амінокислота гистидин шляхом декарбоксилирования перетворюється на гістамін – найважливіший медіатор алергії, а також фізіологічний регулятор діяльності різних кліток і систем, включаючи иммунокомпетентную систему. Амінокислоти, що поступають в організм з їжею, утворюються при катаболізмі білків і в результаті синтезу, формують амінокислотний пул організму — джерело амінокислот для утворення різних речовин (рис.1).
Ріс.1. Шляхи перетворення амінокислот
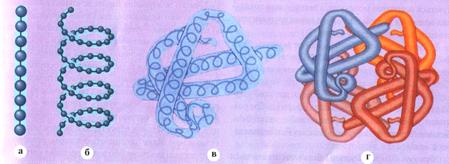
Обмін амінокислот в тканинах можна умовно розділити на загальні і специфічні шляхи перетворення. До загальних шляхів обміну амінокислот відносяться: дезаминирование; трансаминирование; декарбоксилирование. Дезамінірованіє - процес відщеплювання аміногрупи у вигляді аміаку з утворенням а-кетокислоты. Трансамінірованіє — процес перенесення аміногрупи амінокислоти на кетокислоту без проміжного утворення аміаку. Процес трансаминирования має велике значення для синтезу замінимих амінокислот в організмі тварин і людини. Через а-кетоглутарат аміак використовується для синтезу замінимих амінокислот, цим же шляхом аміногрупа переноситься на аміноцукри, порфирины, креатин. Порушення процесів трансаминирования може бути наслідком зміни співвідношення продуктів реакції (надлишок амінокислот в організмі), порушень в процесах окислення в циклі трикарбоновых кислот або синтезу трансаминаз. Окрім приведених 20 амінокислот (пролин – иминокислота), що беруть участь в побудові молекул білків, в тканинах живих організмів є і інші амінокислоти, важливі проміжні продукти обміну речовин (орнітин, цистатионин і ін.). Білки. Якщо від двох молекул амінокислот відняти одну молекулу води, то утворюються неповні ангидриды, які називаються дипептидами. Вони мають пептидний зв'язок -NH-C(O) -. Діпептід володіє здатністю взаємодіяти з новою молекулою амінокислоти з утворенням нового неповного ангідриду – трипептида. Таким же способом можуть бути отримані тетрапептиды, пентапептиды і так далі, що носять загальну назву поліпептидів. Останні грають дуже важливу роль в побудові молекул білків. У макромолекулу білка входить одна або декілька пептидних ланцюгів, зв'язаних один з одним поперечними хімічними зв'язками, найчастіше через сірку (дисульфидные містки, що утворюються залишками цистеина). Хімічну структуру пептидних ланцюгів прийнято називати первинною структурою білка або секвенцією. Для побудови просторової структури білка пептидні ланцюги повинні прийняти визначену, властиву даному білку конфігурацію, яка закріплюється водневими зв'язками, що виникають між пептидними угрупуваннями окремих ділянок молекулярного ланцюга. У міру утворення водневих зв'язків пептидні ланцюги закручуються в спіралі (б-спираль), прагнучи до утворення максимального числа водневих зв'язків і відповідно до енергетично найбільш вигідної конфігурації. Залежно від утворення певної просторової структури (конформації) розрізняють вторинну, третинну, чверткову і доменну організацію білків (рис.2). Вторинна структура білків – це ряд конформацій, що утворюються водневими зв'язками. Розрізняють два основні типи впорядкованої вторинної структури білкових молекул: правозакрученная б-спираль і в- структура. Остання є шаруватою молекулою, що складається із зигзагоподібних розгорнених полипептидных ланцюгів, розташованих поряд і сполучених водневими зв'язками. Багато білок мають обидва типи вторинної структури. Третинна структура білків утворюється шляхом укладання в тривимірному просторі полипептидной ланцюга з певною вторинною структурою. У освіті і стабілізації третинної структури беруть участь водневі, іонні і гидрофобные зв'язки. Залежно від форми і особливостей тривимірної просторової структури, всі білки діляться на два класи: глобулярні і фибриллярные. Глобулярні білки (ферменти, антитіла, деякі гормони і ін.) мають округлу форму, а фибриллярные (колаген, эластин, б-кератин і ін.) – витягнуту. Чверткова структура білків (гемоглобін і ін.) – результат об'єднання (агрегації) декілька полипептидных ланцюгів або протомеров, кожен з яких має свою типову конформацію. Окремі протомеры (субъединицы) в таких білках з'єднуються нековалентными зв'язками, що приводить до їх дисоціації і втрати біологічної активності при зміні умов середовища.
Ріс.2. Рівні структурної організації білків: а) - первинна структура - лінійна послідовність амінокислот (утворення поліпептидів); би) — вторинна структура - утворення спіралі з полипептидной ланцюга або в-структуры; у) - третинна структура - утворення глобулы з полипептидной спіралі і в-структуры; г) - чверткова структура - утворення білкового комплексу, що складається з декількох полипептидных глобул
Доменна організація білків (р-53, фосфоглицераткиназа і ін.) є глобулярними ділянками (100 – 150 амінокислотних залишків), розташованими в середині молекулами з третинною структурою. Окремі домени – це відносно функціональні автономні утворення у складі білкових молекул, зв'язані між собою пептидними фрагментами («шарнірними» ділянками), які можна розщепнути тільки за допомогою протеолітичних ферментів. Процес згортання пептидного ланцюга в просторову структуру і досягнення білком правильної конфігурації називається фолдингом. Для невеликих білків характерне мимовільне утворення третинної структури, а для фолдинга крупних білків необхідні спеціальні допоміжні білки – шапероны і ферменти - фолдазы. Фолдінг за участю фолдаз і шаперонов зазвичай приводить полипептидную ланцюг до «правильної», найбільш оптимальної в енергетичних і функціональних відносинах, структурі. Проте бувають випадки «неправильного» фолдинга. Існує група важких неврологічних хвороб, які обумовлені таким, що закономірно повторюється «неправильним» фолдингом одного, цілком певного білка. Даний білок, якщо він знаходиться в нормальній конформації, називається прион - протеїном. Він кодується геном, розташованим у людини в 20-ій хромосомі. Білок входить до складу зовнішніх клітинних мембран і бере участь в эндоцитозе і катаболізмі кліток. Його можуть синтезувати багато кліток організму, але найвищий рівень концентрації цього білка виявлений в нейронах. Роль нормального прион-протеина у здорових індивідуумів ще до кінця не встановлена, але відомо, що він підтримує «циркадианные» ритми, тобто околосуточные ритми активності і спокою в клітках, тканинах органах і в організмі в цілому. До теперішнього часу встановлено 18 різних мутацій людського гена прион – протеїну, які пов'язані з різними прионовыми хворобами. В результаті мутацій цього гена утворюється білок з іншою конформацією. Він має ділянки з в-структурой, майже відсутні в нативной формі, і підвищену схильність до агрегації. У даній формі він, мабуть, не здатний виконувати свої звичайні функції і викликає захворювання – прионовые енцефалопатії. Пріоновиє хвороби унікальні з генетичної і інфекційної точки зору, тобто вони є одночасно і спадковими (аутосомно-домінантний тип спадкоємства), і інфекційними (трансмісія інфекційного агента аліментарним або ятрогенным шляхом). При попаданні інфекційного прионного білка в здоровий організм, його молекули з'єднуються з молекулами клітинного (нормального) прион-протеина, в якому відбуваються конформаційні зміни: дві з чотирьох спіральних завитих структур витягуються, і молекула такого білка стає інфекційною, тобто відбувається як би фолдинг навпаки. Більш того, процес є автокаталітичним: порції «зіпсованого» білка, що знов утворилися, починають «псувати» чергові порції нативного білка до тих пір, поки весь білок не виявляється «зіпсований». Таким чином, на відміну від всіх відомих інфекційних агентів, інфекційний прионный білок не синтезується наново, а накопичується виключно за рахунок перетворення нормального клітинного білка на інфекційний. Процес відбувається відносно поволі – хвороба розвивається протягом декількох років, але невідворотно приводить до загибелі тварини або людини. У корів інфекційні прионы викликають губчасту енцефалопатію або коров'ячий сказ. Вживання людиною м'яса таких корів викликає новий варіант хвороби Крейцфельда-якоба (інкубаційний період більше 10 років). При розвитку клінічних проявів (порушення психіки, чутливої і рухової сфери) немає ні ознак запалення, ні біологічних аномалій в крові, ні тестів неінвазивних, ні прямих, ні непрямих, таких, що дозволяють упевнено поставити діагноз. Це захворювання небезпечне тим, що воно може передатися від хворої матери дитині, викликавши сплеск передчасних смертей в наступному поколінні людей. Починаючи з 1995 року, протягом 5 років від цієї хвороби померло 86 чоловік. До прионовым хвороб відносяться також куру, яка вражає тубільців Нової Гвінеї, і скріпляй (почесуха) овець. Таким чином, як видимий, фолдинг – дуже важливий етап у формуванні білків. Функції білків. Білки є найбільш поширеними зі всіх класів біомолекул; вони входять до складу всіх клітинних компонентів мікроорганізмів, рослин, тваринних (ядра, біомембран, цитоплазми) і міжклітинних структур. Білковий склад живих клітин ускладнюється пропорційно ступені складності генома і етапів еволюційного розвитку організму. Білкові молекули - найважливіші нутрієнти. Доросла людина повинна отримувати щодоби 100-120 г білка (при енерговитратах 12 000 кДж). Потреба в білці зростає при фізичному навантаженні, вагітності, лактації. При вагітності (2 і 1 триместри) додатково потрібний 6 г білка в добу, під час лактації прийом білка повинен збільшуватися на 15 р. При збалансованому харчуванні не менше 5% енергетичних витрат повинно покриватися за рахунок білків (оптимальним рівнем вважається 18%). Одним з шляхів перетворення компонентів амінокислотного пулу організму є синтез білків плазми крові, що беруть участь в підтримці рН крові, визначенні в'язкості, колоїдно-осмотичного тиску, в транспорті гормонів, ліпідів, жирних кислот, пігментів, жиророзчинних вітамінів, підтримці рівня катіонів крові, в згортанні крові, імунних і інших процесах. Плазма містить понад 300 білків, але тільки незначне їх число визначається в повсякденній клінічній практиці. Більшість білків плазми — гликопротеины, кількість вуглеводів в їх складі варіює від 1% до 40%. Дослідження білків плазми, окрім специфічної нозологічної інформації, дають певне уявлення про стан білкового обміну в цілому. Основна маса білків плазми синтезується в печінці. Гепатоцити беруть участь в синтезі 95% Альбуміну, в синтезі фибриногена, a- і b-глобулинов. компонентів згортаючої системи. Велика частина b- і у-глобулинов синтезується в клітках імунної системи. Одне з центральних місць в діагностиці патологічних станів організму людини займають дослідження білкового спектру, активності ферментів крові і інших біологічних рідин. Відповідно до біологічних функцій можна виділити білки – переносники, сигнальні, захисні, структурні, рецепторні, регуляторні, ферменти і ін. Ферментатівная (каталітична) функція. Всі ферменти (біокаталізатори) по своїй хімічній природі є білками або комплексами білків з низькомолекулярними небілковими з'єднаннями (коферментами, кофакторами). Ферменти (Ф) — протеїни, хиральные, що містять, ділянки, що розпізнають, для специфічних субстратів, і, через це, що є високоефективними біокаталізаторами, прискорюючими хімічні реакції в 10ю—1016 разів. Слово «фермент» — похідне від латинського fermentum, тобто «закваска», а синонім, що часто вживається, «ензим» відбувся від грецького «Ен зюме», що означає «в дріжджах». Ензими можуть бути однокомпонентными (прості білки), двокомпонентними і багатокомпонентними; більшість з них - глобулярні білки. У складі Ф є активний центр — особлива ділянка в молекулі білка, з яким зв'язується субстрат з освітою фермент, - субстратного комплексу (Ф—С). У полипептидной послідовності амінокислотні залишки, складові активний центр, можуть знаходитися далеко один від одного, проте завдяки специфічній для кожної білкової молекули упаковці, ці фрагменти просторово зближують. Формування комплексу Ф-С здійснюється, як правило, без ковалентного скріплення, за рахунок водневих зв'язків, ион-дипольного, диполь-дипольного або ван-дер-ваальсового взаємодії. У багатьох випадках в безпосередній близькості до активного центру Ф знаходиться небілковий компонент. Останній отримав назву кофермента (коензиму) або кофактора, а білкова часть—апо-фермента (ароЕ). Як коферментов можуть виступати як органічні молекули (головним чином вітаміни або їх похідні), так і іони Са2+, Zn2+, Mn2+, Se2+, Cu2f, Fe2+ і ін. У ряді випадків кофакторы утворюють з Ф міцні зв'язки. При цьому небілкову частину Ф прийнято називати простетической групою. В даний час зареєстровано близько 106 Ф, у ссавців їх приблизно 2400. Ф класифікуються не як індивідуальні хімічні сполуки, а за типом реакцій, що каталізують ними. Виділяють шість класів Ф, кожен з яких підрозділяється на підкласи і дрібніші групи. Оксидоредуктази - окислительно-восстановительные Ф. Іх систематична назва складається з назви відновника (электронодонора), окислювача (электроно-акцептора) і назви класу. Наприклад, Ф, що каталізує окислення етанолу до ацетальдегіду за участю NAD+, носить назву — алкоголь: NАD+-оксидоредуктаза або алкогольдегидрогеназа. Відомо більше 200 біохімічних реакцій окислення спиртних груп до карбонільних і декількох десятків перетворень карбонільних груп в карбоксильних, що протікають за участю никотинамидных коферментов. Більшість з цих процесів обратимы. Проте, як правило, біологічно значущим є тільки одне напрям. Надзвичайно важлива роль в захисті організму на молекулярному і клітинному рівнях від ушкоджувальної дії сильного окислювача — радикала Н02- належить супероксиддисмутазе. Цей Ф є металлопротеидом і може містити як кофактора іони Zn2+, Mn2+, Cu2+, Fe2+. Трансферази. Каталізують перенесення різних груп з однієї молекули на іншу. Такого роду перетворення грають надзвичайно важливу роль в синтезі пиримидиновых і пуриновых підстав. Як коферментов, що переносять одноуглеродные фрагменти, в цих реакціях виступають тетрагидрофолат і S-аденозилметионин. Останній є головним метилирующим агентом в клітках і бере участь в десятках реакцій, метилтрансферазами, що каталізують. Ензими, що каталізують перенесення альдегідних і кетогрупп представлені транскетолазой і трансальдолазой, що беруть участь в синтезі моно- і полісахаридів. Ацетілтрансферази каталізують такі важливі біохімічні процеси як перенесення ацильных залишків. Глікозілтрансферази каталізують перенесення гликозильных залишків. Ці Ф грають провідну роль в синтезі і першому етапі деструкції полісахаридів. Дуже важливою групою Ф є аминотрансферазы. Вони каталізують реакції освіти і деградації амінокислот. Гидролази. Каталізують процеси гидролитического розщеплювання різних зв'язків. Ф, що гідролізують внутрішні пептидні зв'язки в білках, називають протеазами, а що каталізують відщеплювання N-концевой амінокислоти — аминопептидазами, відщеплювання С-концевой амінокислоти — карбоксипептидазами, гідроліз нуклеїнових кислот — нуклеазами. Значна частина гидролаз представлена травними ферментами (амілази, ліпази, фосфолипазы, пепсин і т. п.), за допомогою яких полісахариди, що поступають з їжею, жири і протеїни розщеплюються відповідно до моносахаридів, гліцерину і жирних кислот, пептидів і амінокислот. Подальша реутилизация мономерів, що утворилися, в ході процесів анаболізму, що протікають згідно спадковим програмам, приводить до побудови нових біополімерів, властивих даному організму. Окрім ролі, що утилізувала, слід підкреслити і таку функцію протеаз, як процесинг білків і РНК. Процесингом називають утворення «зрілих» молекул білків з їх синтетичних попередників. Багато протеїнів, які реалізують свою активність поза межами клітки (деякі Ф, гормони, імуноглобуліни), що синтезує їх, секретируются цими клітками у вигляді пробелков. Попередники Ф носять назву зимогенов. Останні мають на N-конце первинного полипептидной ланцюга спеціальну сигнальну послідовність, що складається з 15—20 амінокислотних залишків. Після відщеплювання цієї сигнальної послідовності за допомогою мембранних протеаз білок активується не відразу, а після досягнення ним певній мішені. Системи протеаз забезпечують перебіг таких важливих фізіологічних процесів, як згортання крові, регуляція ПЕКЛО, розщеплювання чужорідних антигенів після їх пов'язання з антитілом і ін. Порушення нормального функціонування якого-небудь з перерахованих процесів спричиняє за собою розвиток серйозних патологічних станів. В зв'язку з цим багато протеазы є мішенями для біологічно активних речовин. Ліази. Вони каталізують процеси негидролитического розщеплювання субстрата з утворенням кратного зв'язку (рідше за цикл), або приєднання по такому зв'язку. Декарбоксилази каталізують відщеплювання С02 від карбонових кислот. Наприклад, що утворюється при спиртному бродінні глюкози піровиноградна кислота декарбоксилируется під дією пируват декарбоксилазы з утворенням оцетового альдегіду. Ферментатівним шляхом відбувається декарбоксилирование ряду амінокислот з утворенням важливих нейромедиаторов. Так, L-глутаминовая кислота під дією глутамат декарбоксилазы перетворюється на ГАМК. Інший Ф цієї ж групи — декарбоксилаза ароматичних амінокислот — каталізує декарбоксилирование l-(3,4-диоксифенил) - аланина (L-ДОФА), перетворюючи останній на норадреналін. Ізомерази. Каталізують процеси ізомеризації, за допомогою яких відбувається звернення конфігурації при асиметричному атомі вуглецю. Ензим каталізує звернення конфігурації в обох напрямах, що приводить до утворення рацемической суміші. Такі Ф отримали назву рацемаз. За наявності в молекулі декілька хиральных центрів звернення конфігурації при одному з них приводить до утворення диастереомерной пари. Ф, що каталізують такі процеси, називають эпимеразами. Вони грають важливу роль у взаємоперетвореннях вуглеводів. Слід зазначити, що не всі біохімічні процеси, що завершуються ізомеризацією якого-небудь субстрата, каталізують Ф цього класу. Наприклад, перетворення лимонної кислоти в изолимонную здійснюється за участю лиазы. Лігази (синтетазы). Каталізують реакції конденсації або приєднання, зв'язані з пиролизом одному з пирофосфатных зв'язків в молекулі АТФ або ГТФ. Ряд лиаз каталізують реакцію конденсації амінокислоти з ОН-ГРУППОЙ З'-концевого аденозина в транспортній РНК (тРНК). В результаті таких реакцій, що відбуваються з кожною з тих, що входять до складу білків 20 амінокислот, останні виявляються розподіленими в строгій відповідності з тРНК. Це має вирішальне значення при збірці білкових молекул на рибосомах, де розпізнавання здійснюється не по амінокислотних залишках, а по пов'язаних з ними тРНК. Принципи дії ферментів. Як модель Ф-С взаємодії більше 60 років проіснувала аналогія «замокнув — ключ», запропонована в кінці XIX ст. Fisher. Суть її в тому, що до Ф (замку) підходить лише свій субстрат (ключ). У 1959 р. Koshland була висловлена гіпотеза «індукованої відповідності». Згідно цієї загальновизнаної в даний час моделі пов'язання Ф з відповідним йому субстратом індукує в білці невеликі конформаційні зміни. В результаті каталітичні групи Ф орієнтуються таким чином, що стає можливим перетворення субстрата на продукт. Модель індукованої відповідності допускає також деяку конформаційну перебудову в молекулі субстрата, яка отримала назву напруги. Гіпотеза про виникнення конформаційних змін у Ф і субстраті при їх скріпленні дозволяє пояснити той факт, що молекули, дуже близькі по будові до дійсного субстрата, можуть зв'язуватися з Ф, але при цьому не перетворюються на продукт, тобто діють як інгібітори. Швидкість (1010–1016) ферментативной реакції залежить від природи реагуючих речовин (субстрата і Ф), їх концентрацій, температури (збільшується до певної межі, поки не починається денатурація білка), концентрації коферментов, рН, а також від концентрації активаторів і інгібіторів ферментів. Структурна функція. Білки входять в структуру біомембран, є основою цитоскелета (микротрабекулярная сітка, микрофилламенты), міжклітинного матриксу (колаген, эластин) і певних спеціалізованих тканин (кератини). Колаген, найбільш поширений білок ссавців, утворює основу сухожиль, кісток, шкіри, зубів і хрящів. Структурною одиницею колагенового волокна є тропоколлагеновая молекула, що складається з трьох полипептидных ланцюгів, кожна з яких містить близько 1000 амінокислотних залишків. Залежно від функції колагену його полипептидные ланцюги або ідентичні, або мають досить близькі послідовності. Амінокислотний склад колагену незвичайний. По-перше, приблизно одну третину всіх залишків складають залишки глицина, і, по-друге, є велике число залишків пролина. Крім того, в колагені зустрічаються залишки двох амінокислот, що зазвичай не виявляються в білках, - гидроксипролина і гидроксилизина. Бічні ланцюги цих амінокислот містять гідроксильну (ВІН) групу, приєднану до одного з вуглецевих атомів замість атома водню. Гидроксилірованіє здійснюється специфічними ферментами після включення пролина або лізину в полипептидную ланцюг колагену. Кератин - важливий білковий компонент волосся, шерсті, нігтів, кігтів і пір'я. У одній з форм, званою ос-кератином, в основі структури полипептидной ланцюга лежить права а-спираль. У кератині дві, а можливо і три ланцюги закручуються одна навколо іншої, утворюючи якусь виту (coiled-coil) структуру, звану протофибриллой. 11 протофибрилл формують мікроволокнину, а пучок мікроволокнини - кератиновое волокно. а-Кератины легкорастяжимы, оскільки при витягуванні розриваються водневі зв'язки і полипептидные ланцюги набувають в-структурную конформації. При цьому утворюються межцепочечные водневі зв'язки і формуються в-слои. Кератини з такою структурою називаються в-кератинами. Регуляторні білки. У всіх клітках експресія генів контролюється регуляторними білками, які зв'язуються з певною ділянкою ДНК і таким чином стимулюють або пригнічують транскрипцію гена. Дія регуляторних білків оборотно і, як правило, вимагає присутності лиганда. Постійно відкривають все нові і нові регуляторні білки, в даний час відома, ймовірно, тільки мала їх частина. Регуляторний білок, який впливає на транскрипцію генів, називають чинником транскрипції. Білок, що пригнічує транскрипцію, називають репрессором, а стимулюючий — індуктором освіти. Регуляторні білки, частіше звані гормонами, беруть участь в різних фізіологічних процесах. Наприклад, гормон інсулін складається з двох а-цепей, сполучених дисульфидными містками. Інсулін регулює обмінні процеси за участю глюкози, його відсутність веде до діабету. У гіпофізі мозку синтезується гормон, регулююче зростання організму. Існують регуляторні білки, контролюючі біосинтез різних ферментів в організмі. Білкову і пептидну природу мають численні біорегулятори – гормони, медіатори і модулятори, які виробляються в ендокринній системі, нейронах головного мозку, імунній системі: прості білки (інсулін, глюкагон і т. д.), гликопротеины (гормони тропів гіпофіза і ін.), низькомолекулярні пептиди (окситоцин, вазопрессин, опиоидные пептиди мозку, пептиди тимоцитов і т. д.). Біорегулятори - природні регулятори життєво важливих функцій людського організму. Ця обширна група біологічно активних речовин, яка контролює серцеву діяльність, дихання, тонус м'язів і судин, травлення, імунітет, а також вищу психічну діяльність - емоції, мислення, пам'ять. Біорегулятори ще часто називають «гормональною» або «біохімічною» зброєю. Чіткого визначення терміну «біорегулятор», як і класифікації, на сьогоднішній день не існує. Дуже численна і різноманітна ця група речовин. До біорегуляторів відносять гормони, цитокинины, простагландины, лейкотриены, медіатори, ферменти і багато інших речовин. Найбільш загальною ознакою для всіх цих з'єднань є висока біологічна активність в надмалих дозах -1x10-15 і навіть 1x10-18 мілі. Рецепторна функція. Білкову природу мають мембранні рецептори для фізіологічно активних з'єднань, які приймають хімічний сигнал від гормонів, нейромедиаторов (адренорецептори, холинорецепторы, рецептори гістаміну і ін.), біологічно активних речовин (БАВ) і ін. Для лікаря і фармацевта дуже важливо знати принцип взаємодії ЛІКИ-РЕЦЕПТОРИ. Клітки, як правило, містять велику кількість різних мембранних, цитоплазми і ядерних рецепторів БАВ: іонні канали, ферменти, нейромедиаторы, транспортні системи і гени. Вони необхідні організму для нормального функціонування і адекватного реагування на зміни зовнішнього і внутрішнього середовища і, кінець кінцем, для підтримки гомеостазу. Наявність у живих істот органів, що сприймають зовнішні сигнали, було відмічено вченими ще в глибокій старовині. Проте розуміння ролі рецепторів як внутрішньої системи «органів чуття», що дозволяє організмам адаптуватися до навколишнього середовища, почало складатися тільки в середині XIX ст. Основоположником рецепторної теорії дії ліків слід визнати P. Ehrlich (1907 р.). Він же вперше ввів термін «рецептор» і сформулював основний постулат: «corpora non agun nisi fixata» — «речовини не діють, якщо не фіксуються». Це узагальнення стало теоретичною базою хіміотерапії. P. Ehrlich припускав, що клітки містять так звані бічні гілки, або рецептори, в результаті селективної взаємодії з якими ЛВ індукують свій ефект. Згідно цієї теорії, ліки має два структурні фрагменти, один з яких, з'єднуючись з рецептором, дозволяє тим самим іншому фрагменту здійснювати біологічну відповідь. Численні дослідження підтвердили правильність теорії P. Ehrlich про рецептори як ділянки тканин, селективно зв'язуючих ЛВ і опосредующих реалізацію їх фармакологічних ефектів. У узагальненому вигляді поняття «рецептор» можна сформулювати таким чином: рецептором може бути будь-яка високомолекулярна конформаційно рухома біоструктура, що специфічно зв'язує хімічну сполуку (лиганд, ліки) на поверхні або усередині клітки і що трансформує отриману інформацію в біологічну відповідь. До таких макромолекул відносяться білки і нуклеїнові кислоти. Специфічна взаємодія лиганда з рецептором слід відрізняти від неспецифічного скріплення ендогенних або екзогенних БАВ з білками плазми крові або мукополисахаридами сполучної тканини. Білкові структури такого типу отримали назву «мовчать» рецепторів. В результаті пов'язання з ними не реалізуються ніякі ефекти. Плазмові білки кількісно, а не якісно впливають на прояв ефектів ЛВ. На початок 90-х рр. було виявлено більше 30 груп різних рецепторів. У останнє десятиліття, завдяки розшифровці генома людини, цей список значно розширився і продовжує поповнюватися. У всьому різноманітті рецепторів виділяють 4 наступних типу: · рецептори, що здійснюють контроль за функцією іонних каналів (н-холинорецепторы, GАВАА-рецепторы, глутаматные рецептори); · рецептори, зв'язані з эффектором через систему G-протеины — вторинні посередники або G-протеины — іонні канали (рецептори деяких білкових гормонів і пептидів — ангіотензину, брадикинина, эндотелина і др.; біогенних амінів — адреналіну, дофамина, гістаміну, серотоніна; ліпідів — канабиноидов, простагландинов, лейкотриенов, тромбоксанов; нуклеозидов і нуклеотидов — аденозина, АТФ, АДФ і ін., а також іонів Са2+); · рецептори, що здійснюють прямий контроль за функцією эффекторного ферменту (вони безпосередньо пов'язані з тирозинкиназой і регулюють фосфорилування білків — рецептори інсуліну і гормонів зростання); · рецептори, контролюючі транскрипцію ДНК — розчинні цитозольные або ядерні білки (рецептори стероїдних і тиреоїдних гормонів). Перші три типи рецепторів належать до мембранних, а останній — до ядерних. Більшістю рецепторів є білки, точніше липо- або гликопротеины, які розташовуються на мембрані цитоплазми або мембранах органелл клітки. Вони можуть пронизувати всю товщу мембрани або знаходитися з її внутрішнього боку. Якщо лиганды рецептора є гідрофільні молекули, наприклад, нейромедиаторы, то зв'язуючі ділянки рецептора повинні обов'язково знаходитися із зовнішнього боку клітки. Рецептори гидрофобных молекул слабо пов'язані з мембранами, і комплекси, що утворюються, з лигандами можуть виходити з мембрани в цитоплазму. В процесі еволюції утворилися також рецептори, локалізовані усередині кліток. Їх лиганды, наприклад, стероїдні або тиреоїдні гормони, володіють здатністю за рахунок своїх гидрофобных властивостей проникати через мембрани шляхом пасивної дифузії або активного транспорту. Структура і функції внутрішніх рецепторів менш вивчені, чим мембранних, оскільки перші важче виділити, не змінивши при цьому їх первинної структури. Відома присутність рецепторів різних лигандов па рибосомах (до антибіотиків), в ядрі (до стероїдних і тиреоїдних гормонів, тиазолидиндионам, жирним эссенциальным кислотам, фибратам), в комплексі Гольджі (до гормонів), в мікросомах (до гормонів). Біологічний сенс такої внутріклітинної рецепції полягає в глибшій і тривалішій зміні функцій клітки у відповідь на отримання зовнішнього сигналу. Білкові ланцюги і домени, створюючі рецептор, мають певну організацію. Встановлено, що в механізмі, що забезпечує закриття іонного каналу, що веде роль належить н-ацетилхолинорецептору, що складається з п'яти білкових субъединиц, кожна з яких має чотири трансмембранных домени. Останні утворені пронизливими всю мембрану гидрофобными а-спиралями. Один з доменів — М2, що вистилає канал з внутрішньої сторони, гидрофилен. У нім переважають орієнтовані особливим чином анионсодержащие фрагменти амінокислот, що забезпечує розпізнавання катіонів. При взаємодії лиганда з таким рецептором, за рахунок змін в трансмембранном домені М2, відбувається конформаційна перебудова білків, створюючих стінки каналу, і закриття його просвіту. Уявлення про будову рецепторів, передача сигналів від яких здійснюється за участю G-протеинов, можна скласти по (рис.3) з якого видно, що єдиний полипептидная ланцюг має сім трансмембранных а-спиралей, а ланцюг, що знаходиться поза мембраною, з термінальною NН2-группой, гликозилирована. Петлі, клітки, що виходять в цитоплазму, розрізняються по кількості амінокислотних залишків. Перша складається з 10—20 амінокислот, друга містить до 20 і третя — до 50 амінокислотних залишків. На третій петлі розташовані ділянки пов'язання з G-протеинами. Закінчується G-сопряженны
|
||||
|
Последнее изменение этой страницы: 2016-09-13; просмотров: 621; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.153.232 (0.015 с.) |