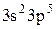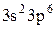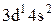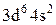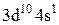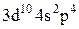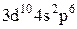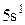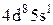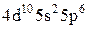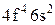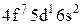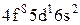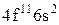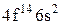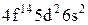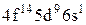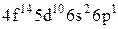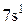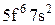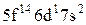Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Періодична система хімічних елементівСодержание книги
Поиск на нашем сайте
На підставі викладених міркувань щодо квантових стаціонарних станів багато електронних атомів удалося теоретично обґрунтувати періодичний закон Менделєєва та дати пояснення будови періодичної системи хімічних елементів · порядковий номер хімічного елемента дорівнює загальному числу електронів у його атомі; · стан електронів в атомі визначається набором чотирьох квантових чисел n,l,m,ms; · електрони в оболонках та підоболонках атомів послідовно розміщуються на енергетичних рівнях у відповідності з принципом Паулі так, щоб потенціальна енергія атома була мінімальною; · періодичність у хімічних властивостях елементів пояснюється повторюваністю в структурі зовнішніх оболонок в атомах споріднених елементів. Енергетичні рівні оболонок та підоболонок позначаються так, як це показано в наведеній вище таблиці. Наприклад, атом натрію Na має таку електронну конфігурацію 1s22s22p63s, а в атомі криптону Kr 1s22s22p63s23p63d104s24p6. Повторюваність у структурі зовнішніх оболонок в атомах споріднених елементів полягає в тому, що, наприклад, в атомах інертних газів (He,Ne,Ar,Kr,Xe) однакові зовнішні оболонки з 8 електронів (повністю заповнені s- та р-стани), в зовнішніх оболонках лужних металів (Lі,Na,K,Rb,Cs,Fr) є лише один s-електрон, в лужноземельних елементів (Be,Mg,Ca,Sr,Ba,Ra) два s-електрона, а в галоїдів (F,Cl,Br,І,At) невистачає одного електрона до оболонки інертних газів. Таблиця. Розподіл електронів по енергетичних рівнях
Характеристики періодичної системи елементів (ПСЕ). Номер періоду (горизонтальний рядок) дорівнює головному квантовому числу n оболонки, яка почала забудовуватися. В першому періоді забудовується перша оболонка Н(1s1) і He (1s2). У другому періоді йде забудова другої оболонки, що містить вісім елементів: від Lі (1s22s1) до Ne(1s22s22p6). Третій період подібний другому. Іде забудова 3-ої оболонки восьми елементів: від Na(1s22s22p63s1) до Ar(1s22s22p63s13p6). Починаючи з четвертого, періоди розміщуються у двох рядках. У першому рядку елементи (неперехідні) у клітинці таблиці пишуться ліворуч, а в другому (перехідні елементи) ¾ праворуч. В першому рядку четвертого періоду забудовується спочатку підоболонка 4s у K і Ca (енергія таких станів менша ніж енергія при послідовній забудові підоболонки 3d), а далі забудовується 3d підоболонка (10 елементів) від Sc до Zn. З цих десяти елементів у міді Cu(1s22s22p63s13p63d104s1) підоболонка 4s містить лише один електрон (як у Sc). Другий рядок четвертого періоду (перехідні елементи) починається з міді Cu і закінчується криптоном Kr. П’ятий період будується аналогічно четвертому. В шостому періоді аналогія послідовності забудови четвертого та п’ятого періодів порушується. Після лантану La виділяється окрема група із 14 елементів із заповненою підоболонкою 6s, в котрих послідовно заповнюється підоболонка 4f. У двох елементів гадолінію Gd та лютецію Lu по одному електрону розміщується в підоболонці 5d. Елементи цієї групи називаються лантаноїдами або рідкоземельними, а їх властивості дуже схожі. У сьомому періоді у франція Fr і радія Ra заповнюється підоболонка 7s, потім в актинія Ас та торія Th починає заповнюватися підоболонка 6d (два електрони) і, починаючи з проактинія, забудовується підоболонка 5f. Починаючи з торію Th і, закінчуючи лоуренсієм (14 елементів), утворюється група подібних за властивостями елементів, які називаються актиноїдами. Стовпці таблиці Менделєєва називають групами, неперехідні елементи утворюють головну підгрупу, а перехідні ¾ побічну. Елементи підгруп одної групи схожі за своїми хімічними властивостями.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-25; просмотров: 258; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.183.235 (0.007 с.) |






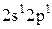


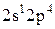


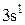 —3s1
—3s1