
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Рентгенівські спектри. Закон МозліСодержание книги
Поиск на нашем сайте Розподіл електронів на оболонках атомів знайшов підтвердження при дослідженні спектрів рентгенівського випромінювання атомів (відкрите Рентгеном у 1895 р.). Прискорюючись електричним полем із високою напругою U, електрони бомбардують анод (вольфрамовий чи з інших важких металів) рентгенівської трубки. Під час бомбардування електрони сповільнюються й випромінюють електромагнітні хвилі, які мають неперервний спектр (гальмівне рентгенівське випромінювання) і на його фоні вузький характеристичний лінійчатий спектр із достатньо малими ширинами ліній Dn (див.Мал.203). Гальмівний спектр має граничну максимальну частоту nmax, яка визначається енергією електрона і не залежить від матеріалу анода. Ця частота відповідає тому випадку, коли електрон не збуджує електронні рівні атомів анода і вся його енергія переходить у квант випромінювання Еmax=eU=hnmax. Виявляється, що характеристичні спектри різних елементів однотипні і містять декілька серій (див.Мал.204). Вони визначаються матеріалом анода і виникають при збудженні глибинних електронних оболонок K,L,M,N,O. При вириванні одного електрона з цих оболонок, на вакансію можуть перейти електрони з більш високих енергетичних рівнів. При цьому виникають серії Ka(LÞK), Kb(MÞK), Kg(NÞK); 2) La(MÞL), Lb(NÞL)
де R ¾ стала Рідбергерадля визначення частоти
s¾стала екранування, що визначає послаблення взаємодії електронів із ядром при збільшенні номера серії. Так для K-серії (n=1) s=1. Для визначення довжин хвиль формула Мозлі буде мати вид
де
Стала Рідбергера для визначення довжин хвиль. Молекулярні спектри
Молекула являє собою найменшу частинку речовини і складається з багатьох однакових чи різних атомів. Хімічні властивості молекул визначаються взаємодією зовнішніх електронів атомів, які називаються валентними електронами. Найпростішими молекулами є двоатомні з гомеополярним зв'язком: де І ¾ момент інерції молекули, М ¾ момент імпульсу, J ¾ квантове число момента імпульсу і
Запишемо тепер повну енергію Е у вигляді
· DL=±1 для електронних рівнів (L ¾ орбітальне квантове число), · · DJ=±1 для обертових рівнів.
Люмінесценція
Випромінювання, надмірне над тепловим, тривалість якого · при бомбардуванні тіл швидкими електронами та іншими, розігнаними до певних енергій, частинками, · пропусканні електричного струму ¾ ударна фотолюмінісценція, · дії достатньої величини напруженості електричного поля (електричний розряд) ¾ електролюмінісценція, · опроміненні іншим випромінюванням ¾фотолюмінісценція · при протіканні деяких хімічних реакцій ¾ хемілюмінесценція з частинним випадком біологічних перетворень (наприклад, гниття дерева) ¾ біолюмінесценція. При всіх названих джерелах виникнення люмінесценції, відбувається перехід атомів або іонів речовини у збуджений стан із наступним переходом їх в основний. При цьому може виникати люмінесцентне випромінювання електромагнітних хвиль. Поряд із цим можуть відбуватися і безвипромінювальні переходи. В залежності від тривалості люмінесцентного випромінювання t, люмінесценцію розділяють на · флуоресценцію (t ~ 10-8c ¸ 10-9c) ¾ фотолюмінісценція рідин та газів, та · фосфоресценцію, коли атоми тіла мають метастабільні збуджені рівні (10-4c >t> 10-8c). Для фотолюмінісценції встановлено правило: при фотолюмінісценції під дією видимого та рентгенівського випромінювання тіло випромінює світло на частотах ns менших частоти збуджуючого випромінювання nо ¾ стоксове випромінювання й випромінювання малої інтенсивності на частоті nаs більшій ніж частота збуджуючого випромінювання ¾ антистоксове випромінювання. Це правило віддзеркалює той факт, що при утворенні фотона з ns, частина енергії W кванта hno йде на неоптичні процеси, а в другому випадку до енергії джерела hno долучається енергія теплового руху атомів, величина якої пропорційна kT. Сфери застосування · створення економічних джерел освітлення (натрієві ¾ жовта лінія, ртутні ¾ жовта, зелена, синя та фіолетова лінії); · люмінесцентний аналіз для виявлення речовин із відносною масовою концентрацією до 10-11. · Комбінаційне розсіювання
Комбінаційне розсіювання(КР) ¾ модульоване розсіювання падаючого випромінювання молекулами речовини. В елементарному акті комбінаційного розсіювання відбувається поглинання молекулою падаючого кванта
де k – коефіцієнт, що визначає глибину модуляції (
З рівняння (2) видно, що на виході з речовини може бути додаткове електромагнітне випромінювання на частотах комбінаційного розсіювання
|
||
|
Последнее изменение этой страницы: 2016-04-25; просмотров: 399; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.44.22 (0.006 с.) |

 випромінювання
випромінювання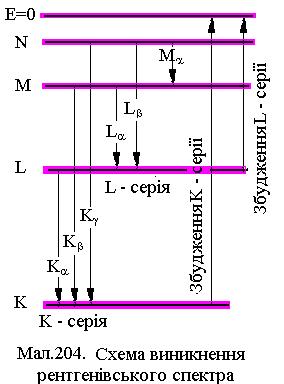 і т.п. В ряду a, b, g... частоти ліній збільшуються, а інтенсивність, що визначається ймовірністю переходів із більш високих рівнів, зменшується. У 1913 році Г.Мозлі(1887-1915) установив закон, що визначає частоту характеристичного випромінювання в залежності від серії n (n=1ÞK, n=2ÞL,...) та номера лінії у серії m (m=n+1, n+2,...)
і т.п. В ряду a, b, g... частоти ліній збільшуються, а інтенсивність, що визначається ймовірністю переходів із більш високих рівнів, зменшується. У 1913 році Г.Мозлі(1887-1915) установив закон, що визначає частоту характеристичного випромінювання в залежності від серії n (n=1ÞK, n=2ÞL,...) та номера лінії у серії m (m=n+1, n+2,...)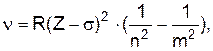 (1)
(1)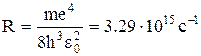 , (2)
, (2) (3)
(3)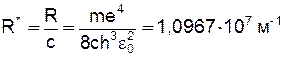 (4)
(4) а також молекули з гетерополярним зв¢язком:
а також молекули з гетерополярним зв¢язком:  . У 1927 році Гайтлер та Лондон розв'язали рівняння Шредінгера для двоатомної молекули водню. У результаті було виявлено, що енергія молекули залежить від відстані r між молекулами та напрямками їх спінів. Для
. У 1927 році Гайтлер та Лондон розв'язали рівняння Шредінгера для двоатомної молекули водню. У результаті було виявлено, що енергія молекули залежить від відстані r між молекулами та напрямками їх спінів. Для 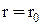 молекула має мінімум енергії, а в околиці
молекула має мінімум енергії, а в околиці 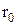 вона здійснює гармонічні коливання (див.Мал.205). На
вона здійснює гармонічні коливання (див.Мал.205). На 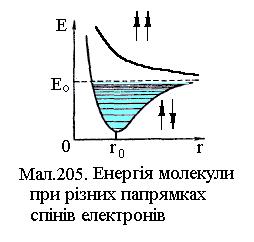 малюнку представлена залежність енергії молекули водню від відстані між атомами в основному стані для випадку паралельних та антипаралельних спінів електронів. У першому випадку молекула є стійким утворенням, а у другому випадку енергія не має мінімуму й молекула не може бути утворена взагалі. При електронному збудженні енергія молекули змінює криву залежності електронної енергії від відстані між атомами r, як це показано на малюнку. При заданій електронній конфігурації молекула може здійснювати коливальний та обертовий рух, які визначаються відповідними енергіями. Будова молекул та їх властивості виявляються з молекулярних спектрів, які утворюються електронними, коливальними та обертовими збудженнями атомів. Крім названих складових також розрізнюють електронно-коливальні (не змінюється коливальне квантове число v) та коливально-обертові (не змінюється обертове квантове число, яким є квантове число імпульсу J). Типові молекулярні спектри¾ смугасті, що представляються сукупністю вузьких смуг в інфрачервоній, видимій та ультрафіолетовій областях. Чим більше атомів у молекулі, тим складніший її спектр випромінювання. Розглянемо докладніше енергетичні стани молекул. Повна енергія молекули Е є сумою енергії Ее електронної конфігурації, енергій коливального ¾ Еv та енергії обертового руху ¾ Еr, причому
малюнку представлена залежність енергії молекули водню від відстані між атомами в основному стані для випадку паралельних та антипаралельних спінів електронів. У першому випадку молекула є стійким утворенням, а у другому випадку енергія не має мінімуму й молекула не може бути утворена взагалі. При електронному збудженні енергія молекули змінює криву залежності електронної енергії від відстані між атомами r, як це показано на малюнку. При заданій електронній конфігурації молекула може здійснювати коливальний та обертовий рух, які визначаються відповідними енергіями. Будова молекул та їх властивості виявляються з молекулярних спектрів, які утворюються електронними, коливальними та обертовими збудженнями атомів. Крім названих складових також розрізнюють електронно-коливальні (не змінюється коливальне квантове число v) та коливально-обертові (не змінюється обертове квантове число, яким є квантове число імпульсу J). Типові молекулярні спектри¾ смугасті, що представляються сукупністю вузьких смуг в інфрачервоній, видимій та ультрафіолетовій областях. Чим більше атомів у молекулі, тим складніший її спектр випромінювання. Розглянемо докладніше енергетичні стани молекул. Повна енергія молекули Е є сумою енергії Ее електронної конфігурації, енергій коливального ¾ Еv та енергії обертового руху ¾ Еr, причому 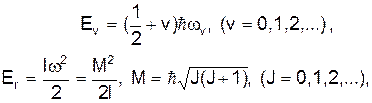 (1)
(1) . (2)
. (2)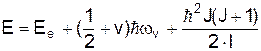 . (3)
. (3) Принципова схема енергетичних рівнів молекули показана на Мал.206.
Принципова схема енергетичних рівнів молекули показана на Мал.206. Закономірність переходу між енергетичними рівнями (3) молекули задається правилами відбору
Закономірність переходу між енергетичними рівнями (3) молекули задається правилами відбору для коливальних рівнів (v ¾ коливальне квантове число),
для коливальних рівнів (v ¾ коливальне квантове число), На відміну від лінійчатих спектрів випромінювання атомів молекулярні спектри складаються зі смуг, кожна з яких складається з тісно розташованих ліній, структура яких показана на Мал.207. смуги молекулярного спектра азоту. З цієї причини молекулярні спектри мають назву смугастих. Розрізнюють три види смуг: обертові, коливально-обертові та електронно-коливальні. Останні мають різко виражений кант з одного боку, як згусток близько розташованих ліній, а з другого кінця край спектра є розмитим.
На відміну від лінійчатих спектрів випромінювання атомів молекулярні спектри складаються зі смуг, кожна з яких складається з тісно розташованих ліній, структура яких показана на Мал.207. смуги молекулярного спектра азоту. З цієї причини молекулярні спектри мають назву смугастих. Розрізнюють три види смуг: обертові, коливально-обертові та електронно-коливальні. Останні мають різко виражений кант з одного боку, як згусток близько розташованих ліній, а з другого кінця край спектра є розмитим. називається люмінесценцією. Таке випромінювання може народжуватися
називається люмінесценцією. Таке випромінювання може народжуватися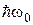 і наступного випромінювання кванта
і наступного випромінювання кванта  , де wкол ¾ одна з частот коливального спектра молекули. Квант
, де wкол ¾ одна з частот коливального спектра молекули. Квант 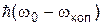 відповідає стоксовій лінії
відповідає стоксовій лінії  , а
, а  ¾ антистоксова лінія. Комбінаційне розсіювання є потужним методом для визначення частот коливального спектра молекул та якісного й кількісного аналізу складу речовини за характеристичними спектрами коливальних зв’язків між атомами в молекулах при достатньо малих концентраціях речовин. На Мал.208 показано спектр комбінаційного розсіювання кисню. Молекула кисню збуджувалась лінією ртуті на частоті
¾ антистоксова лінія. Комбінаційне розсіювання є потужним методом для визначення частот коливального спектра молекул та якісного й кількісного аналізу складу речовини за характеристичними спектрами коливальних зв’язків між атомами в молекулах при достатньо малих концентраціях речовин. На Мал.208 показано спектр комбінаційного розсіювання кисню. Молекула кисню збуджувалась лінією ртуті на частоті 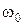 , яка відповідає довжині хвилі
, яка відповідає довжині хвилі 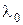 =253.7 нм. Симетрично частоті збудження розташовані стоксові та антистоксові лініїчастот
=253.7 нм. Симетрично частоті збудження розташовані стоксові та антистоксові лініїчастот  . 3
. 3 З класичної точки зору КР є результатом модуляції амплітуди зовнішнього електромагнітного випромінювання
З класичної точки зору КР є результатом модуляції амплітуди зовнішнього електромагнітного випромінювання 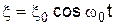 внутрішніми коливаннями атома
внутрішніми коливаннями атома 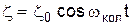 , тобто на виході з речовини електромагнітні коливання будуть описуватися рівнянням
, тобто на виході з речовини електромагнітні коливання будуть описуватися рівнянням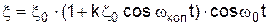 , (1)
, (1) ). Рівняння (1) може бути розкрите у вигляді
). Рівняння (1) може бути розкрите у вигляді . (2)
. (2) .
.


