
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Борівська теорія атома воднюта її обмеженістьСодержание книги
Поиск на нашем сайте
Результати дослідів по розсіюванню Перша спроба побудови не класичної моделі атома, відповідно до планетарної моделі Резерфорда, була зроблена Н.Бором відносно водне подібних атомів в 1913 році. Основними положеннями якої є наступне. 1. Постулат стаціонарних станів: існують стаціонарні стани атома, знаходячись на яких, електрон не випромінює і не поглинає енергію. 2. Правило квантування орбіти: у стаціонарному стані електрон рухається по круговій орбіті з дискретним значенням величини моменту імпульсу
В (1) m ¾ маса електрона, 3. Правило частот: перехід атома з одного стаціонарного стану з енергією
Атом поглинає електромагнітні хвилі лише коли їх частота
Експеримент показує, що перехід електрона з одного стаціонарного стану на інший триває коло Розрахунок орбіт та енергій воднеподібних атомів. За постулатами Бора можна розрахувати спектр енергії та радіуси стаціонарних орбіт воднеподібних атомів (атомів з одним електроном на зовнішній орбіті). З правила квантування орбіт (1) знайдемо
Підставляючи (4) у (5) одержимо вираз для радіуса n-ної орбіти
Електрон має повну енергію, що складається з кінетичної енергії
З (5) можна одержати
а (7) та (8) дають
Підставляючи (6) у (9) одержимо вираз для енергії електрона на n-ій орбіті
Вираз (7) можна представити так
а вираз (10) у виді
Значення величини енергії основного стану атома водню
Швидкість електрона можна визначити у таким чином
де
швидкість електрона на першій стаціонарній орбіті атома водню. Використовуючи правило частот, можна записати
Вираз для оберненої довжини хвилі
або
де стала Рідбергера R записується так
Дослід Франка-Герца. У результаті дослідів Франком і Герцом (1914) було установлено, що енергія атомів змінюється дискретно у відповідності з постулатами Бора. Схема установки Франка — Герца показана на Мал.193. В електронній трьохелектродній лампі К ¾ розжарений катод, С ¾ сітка й А ¾ анод. Для того щоб на відстані вільного пробігу l, електрони могли достатньо прискоритися, лампа заповнювалася парами досліджуваних речовин (ртуті, гелію й ін.) під невеликим тиском (~ 133 Па). Термоелектрони, що вилітають із катода, прискорюються різницею потенціалів катод-сітка Подальше прискорення електронів знову викликає зростання анодного струму. При досягненні електронами енергій порядку 2
Таким чином, досліди Франка-Герца довелили, що енергія атомів дискретна, на що указують постулати Бора. Обмеженість теорії Бора. Модель атома за Бором знайшла своє підтвердження в дослідах Франка-Герца при дослідженні збудження парів ртуті. Ця модель пояснила природу спектральних ліній атома водню, дозволила розрахувати його енергетичні рівні. Зоммерфельд додатково ввів поряд із сферичними еліптичні орбіти електронів. Однак теорія Бора-Зоммерфельда не змогла пояснити інтенсивність ліній спектра та явища поляризації, дисперсії та поглинання світла. Повною невдачею скінчилась спроба створити теорію атома гелію.
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-25; просмотров: 320; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.107.243 (0.008 с.) |

 частинок на атомах дали можливість Резерфорду створити їх планетарну модель, згідно якої у центрі атома знаходиться позитивно заряджене ядро розміром ~10-15 м, а навколо нього у сфері діаметром ~10-10 м по замкнених орбітах рухаються електрони (див.Мал.192). З точки зору класичної теорії обертовий рух електрона є прискореним рухом і, як заряджена частинка, він повинен випромінювати електромагнітні хвилі суцільного спектра. При цьому повинна зменшуватися його енергія і, зрештою, він повинен упасти на ядро. Проте, усупереч цьому, атоми є стійкими утвореннями, їх спектр випромінювання є лінійним, а не суцільним.
частинок на атомах дали можливість Резерфорду створити їх планетарну модель, згідно якої у центрі атома знаходиться позитивно заряджене ядро розміром ~10-15 м, а навколо нього у сфері діаметром ~10-10 м по замкнених орбітах рухаються електрони (див.Мал.192). З точки зору класичної теорії обертовий рух електрона є прискореним рухом і, як заряджена частинка, він повинен випромінювати електромагнітні хвилі суцільного спектра. При цьому повинна зменшуватися його енергія і, зрештою, він повинен упасти на ядро. Проте, усупереч цьому, атоми є стійкими утвореннями, їх спектр випромінювання є лінійним, а не суцільним.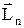 , який складається з цілого числа величин
, який складається з цілого числа величин 
 . (1)
. (1) ¾
¾  швидкість електрона на n-ій орбіті з радіусом
швидкість електрона на n-ій орбіті з радіусом  ,
,  у збуджений стан з більшою енергією
у збуджений стан з більшою енергією  , cупроводжується поглинанням енергії
, cупроводжується поглинанням енергії 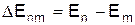 . Перехід атома із збудженого стану в основний супроводжується випромінюванням електромагнітної хвилі з частотою, яка визначається рівнянням
. Перехід атома із збудженого стану в основний супроводжується випромінюванням електромагнітної хвилі з частотою, яка визначається рівнянням . (2)
. (2) задовольняє умові
задовольняє умові . (3)
. (3)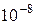 с.
с. . (4)
. (4) Бор вважав, що електрон у воднеподібній системі рухається по колу під дією кулонівської сили взаємодії електрона з ядром
Бор вважав, що електрон у воднеподібній системі рухається по колу під дією кулонівської сили взаємодії електрона з ядром 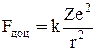 , яке має заряд Ze (див.Мал.192). Ця сила є доцентровою і створює доцентрове прискорення
, яке має заряд Ze (див.Мал.192). Ця сила є доцентровою і створює доцентрове прискорення  . Рівняння другого закону Ньютона для електрона
. Рівняння другого закону Ньютона для електрона  буде мати вигляд
буде мати вигляд . (5)
. (5) . (6)
. (6) та потенціальної енергії (
та потенціальної енергії (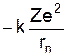 ), тобто повна енергія
), тобто повна енергія . (7)
. (7) , (8)
, (8) . (9)
. (9) . (10)
. (10) , (11)
, (11) . (12)
. (12)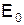 і борівського радіуса орбіти основного стану
і борівського радіуса орбіти основного стану  наведені у таблиці
наведені у таблиці Дж
Дж
 м
м
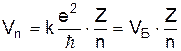 , (13)
, (13) (14)
(14)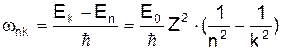 . (15)
. (15)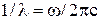 випромінювання має вид
випромінювання має вид
 ,
, , (16)
, (16) . (17)
. (17) , величина якої регулюється потенціометром
, величина якої регулюється потенціометром  . Потенціометром
. Потенціометром  установлюється різниця потенціалів Uа анод-сітка, що створює затримуюче поле для термоелектронів у просторі сітка-анод. Анодний струм I, що тече через гальванометр G виникає лише тоді, коли термоелектрони, що пройшли через сітку, мають енергію достатню, для подолання гальмівного поля. У просторі катод-сітка прискорені електрони співударяються з атомами газу. При невеликих енергіях, пружні співударяння електронів із газом змінюють лише їх імпульс і електрони, долаючи електричне поле анод-сітка, створюють анодний струм. Якщо енергія електронів досягає величини енергії збудження атомів газу
установлюється різниця потенціалів Uа анод-сітка, що створює затримуюче поле для термоелектронів у просторі сітка-анод. Анодний струм I, що тече через гальванометр G виникає лише тоді, коли термоелектрони, що пройшли через сітку, мають енергію достатню, для подолання гальмівного поля. У просторі катод-сітка прискорені електрони співударяються з атомами газу. При невеликих енергіях, пружні співударяння електронів із газом змінюють лише їх імпульс і електрони, долаючи електричне поле анод-сітка, створюють анодний струм. Якщо енергія електронів досягає величини енергії збудження атомів газу  , то співударяння носять не пружний характер, а залишкової енергії
, то співударяння носять не пружний характер, а залишкової енергії 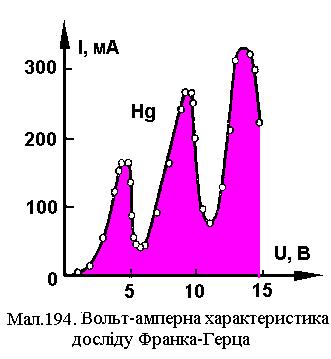 термоелектронів недостатньо для подолання гальмівного поля сітка-анод. У цей момент анодний струм різко падає, досягаючи мінімуму.
термоелектронів недостатньо для подолання гальмівного поля сітка-анод. У цей момент анодний струм різко падає, досягаючи мінімуму.


