
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Розчини електролітів. Електролітична дисоціація сильних і слабких електролітів. Закон розбавляння. Водневий показникСодержание книги
Поиск на нашем сайте
Короткі теоретичні відомості За станом (поведінкою) у розчинах речовини поділяються на неелектроліти й електроліти. Неелектроліти – речовини, які існують у розчині тільки у вигляді молекул. Електроліти – речовини, які дисоціюють (розпадаються) у розчині на іони. Кількісною мірою дисоціації електроліту є ступінь дисоціації, a: a = До сильних електролітів, що дисоціюють повністю (a @ 1) відносяться луги, тобто розчинні у воді основи лужних і лужноземельних металів, сильні кислоти (HCl, HBr, HI, H2SO4, HNO3 та деякі інші), а також розчинні у воді солі (див. додаток, табл. 5). У рівняннях процесів електролітичної дисоціації сильних електролітів прийнято писати знак рівності, слабких – знак оборотності (Û, або NaOH = Na+ + OH-; HNO3 = H+ + NO32-; NH4OH Û NH4+ + OH+; H2S Û H+ + HS- - перший ступінь, HS- Û H+ + S2- - другий ступінь. Як було сказано раніше, будь-який оборотний процес (також і процес дисоціації) у стані рівноваги характеризується константою рівноваги, а в даному випадку – константоюелектролітичної дисоціації, K Д, наприклад: K Д(NH4OH) = K Д1(H2S) = K Д2(H2S) = Чим слабший електроліт, тим менше значення його K Д. Для слабких одноосновних кислот і однокислотних основ маємо: С дис.(кисл.) = [H+] і С дис.(осн.) = [OH-], тому a = При розв’язанні задач цього розділу потрібно пам’ятати закон розбавлення, згідно з яким чим більше розбавлений розчин, тим більший ступінь його дисоціації: K Д» С a2. Кислотність розчинів вимірюють концентрацією іонів Гідрогену [H+] або значенням водневого показника рН: pН = - lg[H+]. Якщо [H+] = 1×10-7 моль/л, рН = 7, то маємо нейтральне середовище, [H+] > 1×10-7 моль/л, pH < 7 - кисле, [H+] < 1×10-7 моль/л, pH > 7 - лужне. Для розбавлених розчинів: рН + рОН = 14. Приклад. Розрахувати рН і рОН розчину слабкої одноосновної кислоти та константу її дисоціації, якщо концентрація розчину дорівнює 0,005 моль/л, а ступінь її дисоціації в цьому розчині a = 20%. Розв’язання. Для слабкої одноосновної кислоти [H+] = a С (кисл.) = 0,2 × 0,005 = 0,01 моль/л). Отже, pН = - lg[H+] = - lg(1×10-2) = 2, тоді рОН = 14 –2 = 12. Константа дисоціації дорівнює: K Д» С a2 = 0,005 × 0,22 = 2 × 10-4. Задачі 1. Які з наведених нижче речовин відносяться до сильних, а які – до слабких електролітів: KCl, CH3COOH, HNO3, NaOH, HF, NH3×H2O, CuSO4, H2CO3, Ca(OH)2, Fe(NO3)3, H2S, H2SO4, KMnO4, H2SO3, H3PO4, K2SO3? Напишіть рівняння електролітичної дисоціації для будь-яких двох з цих речовин, одна з яких є сильним, а інша – слабким електролітом. Там, де це можливо, наведіть рівняння константи електролітичної дисоціації. 2. У скільки разів концентрація іонів Гідрогену у розчині HCl з концентрацією 0,01 моль/л більша за концентрацію іонів Гідрогену у розчині оцтової кислоти тої ж самої концентрації (α = 0,045)? Чому дорівнюють рН і рОН цих розчинів? 3. Розрахуйте концентрацію іонів Гідрогену, рН і значення константи дисоціації карбонатної кислоти, якщо ступінь її дисоціації за першим ступенем у розчині, що містить 0,0043 моль/л кислоти, дорівнює 1%? 4. Розташуйте кислоти – ортофосфатну (K Д1 = 7,6 × 10-3), оцтову (K Д = 1,8 × 10-5), валеріанову (K Д = 1,5 × 10-5), нітритну (K Д = 4,6 × 10-4) у порядку зростання їх сили. Для ортофосфатної кислоти наведіть рівняння ступінчастої електролітичної дисоціації та відповідні вирази для констант дисоціації. 5. Напишіть рівняння електролітичної дисоціації таких речовин: HCl, Mg(NO3)2, H2CO3, H2SO4, K2HPO4. У тих випадках, де це потрібно, наведіть вирази для констант дисоціації. 6. Розрахуйте ступінь електролітичної дисоціації, концентрацію іонів Гідрогену, рН розчину масляної кислоти НС4Н7О2 з концентрацією 0,04 моль/л (K Д = 1,5 × 10-5). 7. До 1 л чистої води додали 1 краплю (в 1 мл – 50 крапель) концентрованої нітратної кислоти (63%; d = 1,39 г /см3). Визначте рН одержаного розчину, припускаючи, що кислота повністю дисоційована (рН = 3,56). 8. Напишіть рівняння електролітичної дисоціації таких речовин: NaOH, NH4ОH, Ca(OH)2, Fe(ОН)SO4, Be(OH)2. У тих випадках, де це потрібно, наведіть вирази для констант дисоціації. 9. Розташуйте наведені дані про розчини у порядку зростання їх кислотності: С Н+(моль/л) – 1 × 10-4, 1 × 10-7, 8 × 10-7, 4 × 10-9, 2 × 10-5. Вкажіть нейтральні, кислі та лужні розчини. 10. Розташуйте наведені дані про розчини у порядку зростання їх кислотності: С Н+ = 1 × 10-6 моль/л; С ОН- = 1 × 10-6 моль/л; рН = 4,5; С Н+ = 4,7 моль/л; рОН = 12. Вкажіть нейтральні, кислі та лужні розчини. 11. Які з наведених нижче речовин відносяться до сильних, а які – до слабких електролітів: KОН, HNO3, K3PO4, Al(OH)3, NiSO4, KAl(SO4)2, HNO2, HgS, HCN, KBr, H2SO3, AgNO3, NH4ОH, Ca(HSO4)2, Fe(ОН)2Cl? Напишіть рівняння електролітичної дисоціації для будь-яких двох з цих речовин, одна з яких є сильним, а інша – слабким електролітом. Там, де це потрібно, наведіть рівняння константи електролітичної дисоціації. 12. Напишіть рівняння електролітичної дисоціації таких речовин: Н2S, NaHSO3, H2SO4, CH3COOH, HNO3. У тих випадках, де це потрібно, наведіть вирази для констант дисоціації. 13. Розрахуйте концентрації іонів Гідрогену та гідроксильних іонів, ступінь дисоціації та молярну концентрацію розчину мурашиної кислоти з рН = 3 (K Д = 1,8 × 10-4). 14. Концентрація розчину одноосновної органічної кислоти дорівнює 6,67 × 10-3 моль/л; рН = 5. Розрахуйте рОН, ступінь і константу електролітичної дисоціації кислоти. 15. Скільки грамів їдкого натру міститься у 5 л розчину з рН = 11? Дисоціацію NaOH у розчині вважати повною. 16. Змішали рівні об’єми розчинів сильної кислоти з рН = 1 та рН = 2. Визначте рН одержаного розчину, концентрації іонів Гідрогену та гідроксильних груп у ньому. 17. Напишіть рівняння електролітичної дисоціації таких речовин: Н2Se, Na3PO4, H2SO4, Zn(OH)2, HClO2. У тих випадках, де це потрібно, наведіть вирази для констант дисоціації. 18. Напишіть рівняння ступінчастої дисоціації слабкої щавлевої кислоти Н2С2О4 і наведіть вирази констант дисоціації за першим і другим ступенями. Вважаючи, що кислота дисоціює переважно за першим ступенем (K Д1 = 3,8 × 10-2), розрахуйте концентрацію іонів Гідрогену та рН розчину, якщо концентрація розчину дорівнює 0,1 моль/л. 19. Розташуйте кислоти – сульфітну H2SO3 (K Д1 = 1,6 × 10-2), сульфідну H2S (K Д1 = 1,0 × 10-7), селенідну H2Sе (K Д1 = 1,9 × 10-4), карбонатну H2CO3 (K Д1 = 4,4 × 10-7) у порядку зростання їх сили. Для карбонатної кислоти наведіть рівняння ступінчастої електролітичної дисоціації та відповідні вирази констант дисоціації. 20. Розташуйте наведені дані про розчини у порядку зростання їх кислотності: С ОН-(моль/л) – 1 × 10-3, 1 × 10-11, 2 × 10-2, 2 × 10-11, 1 × 10-7. Вкажіть нейтральні, кислі та лужні розчини. 21. Як зміниться рН, якщо розчин оцтової кислоти з концентрацією 0,2 моль/л розвести вдвічі (K Д = 1,8 × 10-5)? Чому дорівнює концентрація гідроксильних іонів у одержаному розчині? 22. Напишіть рівняння електролітичної дисоціації таких речовин: NaHCO3, Na2SO4, NaHSO4, Mg(OH)2, H2CO3. У тих випадках, де це потрібно, наведіть вирази для констант дисоціації. 23. Які з наведених нижче речовин відносяться до сильних, а які – до слабких електролітів: NaCl, Mg(NO3)2, Al(OH)2Cl, Al2(SO4)3, HNO3, HgCl2, HCN, KOH, HClO, NH4OH, CuSO4, KClO4, H3AsO4, NaHSO4, Cu(ОН)2, CH3COONa? Напишіть рівняння електролітичної дисоціації для будь-яких двох з цих речовин, одна з яких є сильним, а інша – слабким електролітом. Там, де це потрібно, наведіть рівняння константи електролітичної дисоціації. 24. рН деякого розчину мурашиної кислоти дорівнює 2,3 (K Д = 1,8 × 10-4). Чому дорівнюють концентрації іонів Гідрогену, гідроксильних іонів і ступінь електролітичної дисоціації кислоти в цьому розчині? 25. Скільки грамів чистої мурашиної кислоти (K Д = 1,8 × 10-4) необхідно додати до 2 л її розчину з рН = 3,5, щоб знизити рН до трьох? Збільшення об’єму розчину внаслідок додавання кислоти не враховувати. Чому дорівнює ступінь електролітичної дисоціації кислоти у цих розчинах?
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 269; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.91.59 (0.006 с.) |

 ; 0< a
; 0< a  1, або 0 < a
1, або 0 < a  ). Перший знак означає, що відповідна речовина у розчині існує повністю у вигляді іонів (молекули майже відсутні); другий знак означає, що встановлюється рівновага, яка характеризується сталими концентраціями як молекул (їх більшість), так і іонів. Наприклад:
). Перший знак означає, що відповідна речовина у розчині існує повністю у вигляді іонів (молекули майже відсутні); другий знак означає, що встановлюється рівновага, яка характеризується сталими концентраціями як молекул (їх більшість), так і іонів. Наприклад: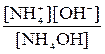 << 1;
<< 1; ,
, ; K Д2 << K Д1.
; K Д2 << K Д1.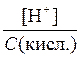 і a =
і a =  .
.


