
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Розчини. Способи вираження концентрацій. Фізичні властивості розведених розчинів неелектролітівСодержание книги
Поиск на нашем сайте
Короткі теоретичні відомості Після вивчення цієї теми треба вміти розраховувати значення різних типів концентрації розчиненої речовини, знати їх взаємозв’язок. Найбільш поширеними є такі типи (тобто способи вираження) концентрацій розчинів: 1. Масова частка, w(х) - відношення маси розчиненої речовини (Х) до маси розчину: w(Х)= де m (Х) і m (Y) – маси розчиненої речовини та розчинника відповідно, d - густина розчину, г /л. 2. Молярна частка, χ(Х) - відношення кількості (у молях) розчиненої речовини до загальної кількості всіх компонентів розчину: χ (x) = Обидві величини при помноженні на 100 дають ці ж самі характеристики у відсотках. 3. Молярна концентрація, С (Х) - відношення кількості розчиненої речовини до об’єму розчину: C (Х) = 4. Масова концентрація, ρ (Х) - відношення маси розчиненої речовини до об’єму розчину: ρ (Х) = 5. Моляльність розчину, Сm (X) - відношення кількості розчиненої речовини до маси розчинника в к г: Сm (X) = У цю формулу m (Y) підставляється у грамах. 6. Густина розчину (пов’язана з концентрацією):
З усіх добре відомих законів про загальні властивості розчинів насамперед потрібно знати другий закон Рауля, згідно з яким підвищення температури кипіння та зниження температури замерзання пропорційні моляльності розчину:
де Е – ебуліоскопічна, K – кріоскопічна сталі розчинника. Приклад 1. Розрахуйте: а) молярну частку гідроксиду калію в розчині; б) молярну концентрацію розчину, якщо 500 мл розчину містять 308 г KОН (густина розчину дорівнює 1,50 г /мл). Розв’язання: а) б) C (KOH) = Приклад 2. Температура кипіння чистого сірковуглецю дорівнює 46,3 °С. Розрахуйте температуру кипіння розчину 1,22 г бензойної кислоти (С6Н5СООН) у 100 г сірковуглецю, якщо Е (СS2) = 2,30 К × к г /моль. Розв’язання. Згідно з другим законом Рауля
Температура кипіння розчину буде більшою, ніж у чистого розчинника: t Задачі 1. Який об’єм води знадобиться для розчинення калію нітрату масою 8 г, якщо у приготовленому розчині масова частка солі повинна складати 1%? Яка молярна концентрація одержаного розчину? Зміною об’єму води при утворенні розчину знехтувати. 2. Чому дорівнює масова частка калію сульфату в розчині, приготовленому з 10 г цієї солі у 80 мл води? Чому дорівнює молярна концентрація розчину, якщо об’єм розчину вважати практично однаковим з об’ємом взятої води? 3. Газоподібний хловодень, одержаний дією надлишку сульфатної кислоти на натрію хлорид масою 117 г, розчинили у 300 мл води. Визначте масову частку хлороводню в одержаному розчині. Приймаючи, що об’єм розчину практично не змінився порівняно з вихідним об’ємом, розрахуйте молярну концентрацію розчину. 4. Визначте температуру кипіння розчину 18 г цукру С12Н22О11 у 200 г води. Ебуліоскопічна стала води дорівнює 0,52 кг·К/моль. 5. Дано водні розчини глюкози С6Н12О6 та карбаміду СО(NН2)2 з однаковою масовою концентрацією. Як співвідносяться значення знижень температур замерзання цих розчинів? 6. Розрахуйте молекулярну масу неелектроліту, якщо розчин 8 г його у 142 мл бензолу (густина бензолу 0,88 г /см3) закипає при температурі, вищій на 1,285 К температури кипіння чистого бензолу. Ебуліоскопічна стала бензолу дорівнює 2,57 кг·К/моль. 7. При розчиненні 25 г KCl у 1 л води температура знизилася на 1,5°С. Питома теплоємність одержаного розчину дорівнює 4,18 Дж/(г × К). Розрахуйте молярну концентрацію розчину та ентальпію розчинення KCl (і = 1,57). 8. Який об’єм розчину сульфатної кислоти з масовою часткою 96 % (d=1,835 г /см3) треба взяти для приготування 5 л розчину з концентрацією 0,5 моль/л? 9. Розрахуйте масову частку НNО3 в розчині та моляльність розчину з молярною концентрацією НNО3 8 моль/л і густиною d = 1,246 г /см3. 10. З 5 мл розчину калію гідроксиду з масовою часткою KОН 50 % і густиною 1,538 г /см3 необхідно приготувати розчин з масовою часткою KОН 18 %. Який об’єм води для цього знадобиться? Чому дорівнює молярна концентрація одержаного та вихідного розчинів? 11. Розчин, що містить фосфор і бензол, маси яких відповідно дорівнюють 0,1155 і 19,03 г, замерзає при 5,15 °С. Чистий бензол замерзає при 5,4 °С. Кріоскопічна стала бензолу дорівнює 5,1 кг·К/моль. Визначте, із скількох атомів складається молекула фосфору. 12. Антифризами називають розчини зі зниженою температурою замерзання, які використовують в системі охолодження автомобілів. Поширене використання знаходять розчини етиленгліколю С2Н4(ОН)2. При якій температурі буде замерзати антифриз, якщо в ньому об’ємні частки етиленгліколю і води відповідно дорівнюють 0,4 і 0,6. Густина етиленгліколю d = 1,116 г /см3. 13. При якій приблизно температурі замерзає антифриз, одержаний змішанням етиленгліколю та води, взятих у рівних об’ємах? Густина етиленгліколю d = 1,116 г /см3. 14. В яких об’ємних співвідношеннях необхідно взяти воду та етиленгліколь, щоб приготовлений з них антифриз замерзав приблизно при -20°С? Густина етиленгліколю d = 1,116 г /см3 15. Яка маса безводного купруму сульфату знадобиться для приготування розчину густиною 1,084 г /см3 і об’ємом 1 л, для якого w(CuSO4) = 8 %? Чому дорівнюють масова та молярна концентрації одержаного розчину? 16. Визначте масову і молярну концентрації розчину магнію хлориду, якщо відомо, що в розчині об’ємом 250 мл міститься 4,75 г MgCl2. 17. В якому об’ємі розчину Pb(NO3)2, молярна концентрація якого 0,1 моль/л, міститься 4,96 г цієї солі? Чому дорівнює масова концентрація цього розчину? 18. У воді об’ємом 1 л розчинили амоніак об’ємом 500 л (н. у.). Визначте масові частки амоніаку та амонію гідроксиду в одержаному розчині. Чому дорівнює молярна концентрація амонію гідроксиду в розчині? 19. Розрахуйте масу етиленгліколю С2Н4(ОН)2, яку необхідно взяти на кожний міліграм води для приготування антифризу з температурою замерзання t = -15 °С. Чому дорівнює масова частка етиленгліколю в одержаному розчині? 20. Температура кипіння розчину 12,8 г сірки в 250 г бензолу на 0,514 °С вища за температуру кипіння чистого розчинника. Вивести молекулярну формулу сірки у розчиненому стані. Скільки атомів сірки складають одну молекулу цієї речовини? Ебуліоскопічна стала бензолу дорівнює 2,57 кг·К/моль. 21. Розчин, що складається з 4,6 г гліцерину С3Н5(ОН)3 і 200 г ацетону (СН3)2СО, кипить при 56,73 °С. Чистий ацетон кипить при 56,3 °С. Розрахуйте ебуліоскопічну сталу ацетону. 22. Дано розчини сульфатної кислоти з концентраціями: а) 2,5% (d= 1,015 г /см3); б) 0,5 М (моль/л); в) 0,5-моляльний (d= 1,015 г /см3). Розташуйте розчини у напрямку збільшення їх масових концентрацій (г /л). 23. Визначте масову частку (%) і молярну концентрацію розчину сульфатної кислоти, одержаного змішанням 10 л 50 % розчину (d= 1,398 г /см3) і 5 л 20 % розчину (d= 1,141 г /см3). 24. Розташуйте у напрямку зростання величини зниження температури замерзання таких розчинів: а) 100 г гліцерину (С3Н8О3) в 1000 г води; б) 100 г етилового спирту (С2Н6О) в 2000 г води; в) 100 г метилового спирту (СН4О) в 3000 г води. 25. Які об’єми водню (d (Н2) = 0,09 г /л) і карбону (IV) оксиду (d (СО2) = 1,98 г /л) треба взяти для одержання суміші газів густиною 1 г /л (тиск у системі не змінюється). Чому дорівнюють молярні та масові частки цих газів у суміші?
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 241; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.60.175 (0.006 с.) |

 ,
,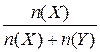 .
.
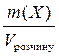 ; г/л або г/мл.
; г/л або г/мл.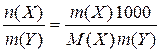 ; моль/к г.
; моль/к г.  ; г/л або г/мл.
; г/л або г/мл.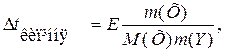
 ,
, або 41%;
або 41%;

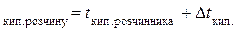 = 46,3 + 0,23 = 46,53 (°С).
= 46,3 + 0,23 = 46,53 (°С).


