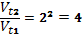Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тест-контроль до теми «Хімічна кінетика та рівновага»Содержание книги
Поиск на нашем сайте
Проаналізуйте кінетику наведеної у Вашому варіанті оборотної хімічної реакції згідно з завданням тест-контролю: 1. У скільки разів зміниться швидкість прямої реакції при зміні концентрації вихідних речовин? 2. У скільки разів зміниться швидкість прямої реакції при зміні об’єму системи згідно з даними Вашого варіанту? 3. У скільки разів зміниться швидкість прямої реакції при зміні тиску в системі згідно з даними Вашого варіанту? 4. У скільки разів зміниться швидкість прямої реакції при зміні температури системи згідно з даними Вашого варіанту? 5. На скільки градусів треба змінити температуру, щоб швидкість прямої реакції залишалася сталою, якщо тиск в системі змінився, як це наведено у Вашому варіанті? 6. Як зміниться стан рівноваги в системі, якщо змінити концентрацію вихідних речовин, як це зазначено у Вашому варіанті? 7. Як змінити стан рівноваги, якщо в системі змінити тиск, як це зазначено у Вашому варіанті? 8. Як зміниться стан рівноваги в системі, якщо змінити об’єм системи, як це зазначено у Вашому варіанті? 9. Як зміниться стан рівноваги, якщо в системі змінити температуру, як це передбачено у Вашому варіанті? 10. Як змінити температуру і тиск, щоб максимально підвищити вихід продуктів реакції? Приклад виконання тест-контролю «Хімічна кінетика та рівновага»
Розвязок: 1. V = K [H2] [J2] V1 = K 8 [H2] 8[J2] = 64 K [H2] [J2], Згідно до закону дії мас швидкості прямої реакції збільшиться у 64 рази при збільшенні концентрації вихідних речовин у 8 разів. 2. V2 = K 4[H2] 4[J2] = 16K [H2] [J2], Швидкість прямої реакції збільшиться у 16 разів, при зменшенні об’єму системи у 4 рази. 3. V3 = K 2[H2]2 [J2] = 4K [H2] [J2] Швидкість прямої реакції збільшиться у 4 разів, при зменшенні об’єму системи у 2 рази. 4. Згідно з правилом Вант – Гора Vt2= Vt1 γ Vt2/Vt1 = 24 = 16 Швидкість прямої реакції зменшилася у 16 разів, при зменшенні температури на 40∘ С. 5. При збільшенні тисків системі у 2 рази швидкість прямої реакції збільшиться у 4 рази. Щоб швидкість прямої реакції залишалася сталою, необхідно температуру зменшити на 200С.
6. Згідно з принципом Ле-Шательє, при збільшенні концентрації вихідних речовин рівновага в системі зміститься вправо, тобто в бік продуктів реакції. 7. Якщо в системі збільшиться тиск, то рівновага зміститься в бік меншого об’єму. У нашому випадку об’єми рівні, то рівновага не зміститься. 8. Якщо в системі зменшити об`эм, то збільшиться концентрація вихідних речовин і рівновага в системі зміститься вправо. 9. При зменшенні температури рівновага зміститься в бік екзотермічних реакцій, до <+>, тобто вправо. 10. Щоб максимально підвищити вихід продуктів реакції, тобто рівновагу в системі змістити вправо, необхідно зменшити температур. Зміна тиску на рівновагу не вплине. Завдання для самоконтролю: Варіант 1 В яких системах для зміщення рівноваги вправо слід знизити температуру: а) 2H2 + O2 = 2H2O + Q, б)CaCO3 = CaO + CO2 - Q, в) SO3 + H2O = H2SO4 + Q, г)N2 + O2 = 2NO - Q? Варіант 2 Впливом яких факторів можна змістити рівновагу вправо в системі: CaCO3 = Ca + CO2 - Q а) збільшення тиску, б) зниження температури, в) підвищення температури, г) зниження тиску?
Рекомендована література: 1. В.П.Басов.Хімія:Навчальний посібник:К.:Каравела,Львів,2003 р.- ст.48-51. 2. Г.П. Хомченко.Посібник з хімії.-К.:Видавництво АСК.,2003р.-ст. 115-126. 3.В.В.Сухан.Хімія:Посібник для вступників до вузів.-К.Либідь,1993.-ст.113-118. 4.І.А.Гройсман.Хімія.Закони, схеми, формули, рівняння.Київ: «Логос»,1998р.- 21-23. 5. Матеріали з Інтернету.
Самостійне вивчення. Тема: Основні принципи зміщення хімічної рівноваги. Принцип Ле Шательє. План: 1. Основні принципи зміщення хімічної рівноваги. 2. Фізичний зміст константи рівноваги. 3. Принцип Ле Шательє. Завдання для самоконтролю: 1. Рівноважні хімічні процеси. 2. Константа хімічної рівноваги. 3. Основні принципи зміщення хімічної рівноваги. 4. Принцип Ле Шательє (принцип рухомої рівноваги). 5. Як і чому впливає температура на швидкість хімічної реакції? 6. Як пояснити вплив каталізатора на швидкість реакції? 7. Як треба змінити температуру, щоб швидкість реакції, температурний коефіцієнт якої дорівнює 3, зменшився у 81 раз?
Задача 1 Для реакції Н2 + І2 = 2 НІ, ΔН0= 18,8 кДж/моль вивести вираз константи рівноваги і встановити, як вплине на стан рівноваги: а) збільшення концентрації Гідрогену; б) зменшення температури; в) введення каталізатора? Як максимально підвищити вихід продукту прямої реакції – йодоводню? Розвязування Н2 + І2 = 2 НІ, ΔН0= 18,8 кДж/моль а) якщо збільшити концентрацію Н2,у відповідності з принципом Ле Шательє зростає швидкість прямої реакції, яка сприяє звязуванню Гідрогену; рівновага при цьому зміститься в бік утворення НІ; б) з підвищенням температури збільшується швидкість і константа швидкості як прямої, так і зворотної реакції, але не в однаковій мірі, що зумовлено різними температурними коефіцієнтами цих реакцій. Підвищення температури сприяє переважному перебігу ендотермічного процесу, який поглинає тепло, що підводять до системи. В даному прикладі ендотермічною є пряма реакція і зниження температури сприяє розкладу НІ та зміщенню рівноваги в бік утворення вихідних речовин; в) введення каталізатора в однаковій мірі впливає на швидкість як прямої, так і зворотної реакції. Тому на положення рівноваги в системі каталізатор не впливає, він прискорює момент настння рівноваги. Збільшенню виходу НІ сприяє підвищення концентрації вихідних речовин, зв’язування(зменшення концентрації) НІ і нагрівання. Задача 2 Як впливатиме підвищення тиску на хімічну рівновагу в оборотній системі Fe3O4(т) + СО(г) = 3FeO(т) + СО2(г)? Задача 3 У системі А + В = С, ΔН0 ‹ 0, де А, В, і С – гази, встановилася рівновага. Як впливатимуть на рівноважну концентрацію речовини С: а) підвищення тиску; б) збільшення концентрації речовини А; в) підвищення температури? Рекомендована література: 1. В.П.Басов.Хімія:Навчальний посібник:К.:Каравела,Львів,2003 р.- ст.48-51. 2. Г.П. Хомченко.Посібник з хімії.-К.:Видавництво АСК.,2003р.-ст.126-129. 3.В.В.Сухан.Хімія:Посібник для вступників до вузів.-К.Либідь,1993.-ст.115-117. 4.І.А.Гройсман.Хімія.Закони, схеми, формули, рівняння.Київ: «Логос»,1998р.- 23-24. 5. Матеріали з Інтернету.
Самостійне вивчення.
|
|||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-06; просмотров: 732; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.126.33 (0.006 с.) |