
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення відносної густини газівСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
За законом Авогадро, однакові об'єми газів містять однакову кількість молекул. Звідси виходить, що маси однакових об'ємів газів мають відноситися одна до одної, як їхні молекулярні маси або як чисельно такі самі молярні маси: Відношення маси певного газу до маси такого самого об'єму іншого газу, взятих за однакових температури й тиску, називають відносною густиною першого газу за другим (позначається О). D= Найчастіше відносну густину різних газів визначають відносно водню як найлегшого з усіх газів. Молекулярна маса водню дорівнює 2, тому густина будь-якого газу за воднем обчислюється за формулою D( Аналогічно, якщо густина певного газу визначають за повітрям, то D(повітря) = Приклад 1. Обчисліть, у скільки разів вуглекислий газ важчий за повітря.
1. D(повітря)= 2. Визначаємо молярну масу вуглекислого газу: M (C 3. D(повітря) =
Розв’язок 1. D 2. D Відповідь: відносна густина метану за Гідрогеном – 8. Обчислення відносної молекулярної маси речовини 1. Обчислюємо відносну молекулярну масу за формулою: Mr(речовини) = Σ Ar (елементів) · n, де n — число атомів (індекс); Σ — знак суми. 2. Визначаємо відносну атомну масу елементів Ar, що входить до складу речовини за періодичною системою Д.І. Менделєєва (значення приблизне). 3. Знаючи, що індекс вказує на кількість атомів у молекулі (n), під час обчислення Mr перемножуємо відносну атомну масу елемента на його індекс (n· Ar). 4. Сумуємо відносні атомні маси елементів Приклад 1. Визначити відносну молекулярну масу амоніаку, хімічна формула якого NH3.
Відповідь:відносна молекулярна маса амоніаку дорівнює 17. У значній частині формул хімічних речовин індекс ставиться за дужками, вказуючи на кількість однакових груп атомів, що входять до складу молекули даної речовини. Тому під час обчислення Mr речовин за їх формулою потрібно помножити суму відносних атомних мас (Ar), групи атомів на їх індекс. Приклад 2. Визначити відносну молекулярну масу гашеного вапна, формула якого Ca(OH)2. Відповідь: Відносна молекулярна маса гашеного вапна — 74. Обчислення за термохімічними рівняннями Хімічні рівняння, в яких зазначено тепловий ефект реакції, називаються термохімічними рівняннями. Обчислення за термохімічними рівняннями аналогічні до розрахунків за хімічними рівняннями. Однією із шуканих або даних за умовою задачі величин у таких обчисленнях є кількість виділеної чи поглинутої під час хімічної реакції теплоти. Кількість теплоти, яка виділяється або поглинається в процесі хімічних реакцій, є тепловим ефектом реакції, позначається ΔН і виражається у кДж або Дж. Тепловий ефект для екзотермічних реакцій (коли теплота виділяється) буде негативний. С+O2 = CO2; ΔH = -393 кДж Тепловий ефект для ендотермічних реакцій (коли теплота поглинається) буде позитивний: Cu2(OH)2CO3 (малахіт) = 2CuO + CO2 + H2O; ΔH = +47 кДж Приклад: Яка маса Феруму перетвориться на залізну окалину, якщо при цьому виділилося 112 кДж теплоти, а тепловий ефект цієї екзотермічної реакції — 1118 кДж?
2. Записуємо співвідношення між кількістю речовини Феруму та кількістю виділеної теплоти:
4.Обчислюємо масу заліза: m (Fe) = ν(Fe) · M (Fe); M (Fe) = 56 г/моль; m (Fe) = 0,3 моль ·56 г/моль= 16,8 г. Відповідь: на залізну окалину перетвориться 16,8 г Феруму.
Обчислення кількості речовини за відомою масою речовини Приклад: Обчисліть, якій кількості речовини відповідає 459 г Барій оксиду (BaO) 2. Знаходимо молярну масу Барій оксиду: M (BaO) = 137 +16 = 163 г/моль 3. Підставляємо значення у початкову формулу: ν= m (BaO) / M (BaO). Відповідь: 459 г Барій оксиду відповідає 3 моль речовини.
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-06; просмотров: 1004; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.12.133 (0.01 с.) |



 або D=
або D= 
 ) =
) = 
 , де 29 – середня молекулярна маса повітря.
, де 29 – середня молекулярна маса повітря.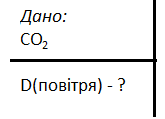 Розв’язок
Розв’язок .
. ) = 12 + 216 = 44 г/моль.
) = 12 + 216 = 44 г/моль. = 1.5
= 1.5 Відповідь: Вуглекислий газ у 1,5 раза важчий за повітря.
Відповідь: Вуглекислий газ у 1,5 раза важчий за повітря. .
. =
= 
 =
=  =8
=8


