Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Розчинність газів в рідинах у присутності електролітів знижується; відбувається висолювання газів.Содержание книги
Поиск на нашем сайте
Математичний вираз закону Сєченова має наступний вигляд:
с(Х)=сo(Х)е-Kc се (2.2) де с (X) - розчинність газу X у присутності електроліту; сo(Х) - розчинність газу X в чистому розчиннику; се - концентрація електроліту; е - основа натурального логарифму; Кс - константа Сєченова, залежна від природи газу, електроліту і температури. Одною з причин, що приводить до зменшення розчинності газів, у присутності електролітів, є гідратація (сольватація) іонів електролітів молекулами розчинника. В результаті цього процесу зменшується число вільних молекул розчинника, а отже, знижується його розчинювальна здатність. Біологічне значення законів Генрі – Дальтона і Сєченова. Закони Генрі – Дальтона і Сєченова мають велике практичне значення як в хімії, так і в медицині. Зміна розчинності газів в крові при зміні тиску можуть викликати важкі захворювання.
Останнім часом при лікуванні газової гангрени і ряду інших захворювань, при яких накопичуються мікроби в тканинах, що омертвіли, застосовують гіпербаричну оксигенацію, тобто поміщають хворих в барокамери з підвищеним тиском кисню в повітрі: При цьому поліпшується постачання тканин киснем і у багатьох випадках такий спосіб лікування дає добрі результати. Проявом закону Генрі – Дальтона і моделлю емболії є утворення рясної піни при відкупорюванні пляшки шампанського або газованої води. Тут має місце пониження розчинності і виділення вуглецю діоксиду СО2 при пониженні його парціального тиску. Відповідно до закону Сєченова не тільки електроліти, але і білки, ліпіди і інші речовини, вміст яких в крові може мінятися у відомих межах роблять істотний вплив на розчинність кисню і вуглецю діоксиду в крові.
2.3 Розчинність рідин та твердих речовин у рідинах. Залежність розчинності від температури, природи розчинної речовини та розчинника. Розподіл речовини між двома рідинами, що не змішуються. Закон розподілу Нернста та його значення в явищі проникності біологічних мембран. Розчинність твердих і рідких речовин в рідинах. При розчиненні твердих і рідких речовин у воді об'єм системи зазвичай змінюється трохи, тому тиск практично не впливає на розчинність таких речовин. Тільки при дуже високому тиску цей вплив стає помітним. Так, наприклад, розчинність NН4 NO3 у воді знижується майже удвічі при підвищенні тиску до 106 кПа. Залежність розчинності твердих речовин від температури визначається знаком і числовим значенням теплоти розчинення ΔH розчин.. Якщо до рівноважної системи «тверда речовина + розчинник» (насичений розчин) застосувати принцип Ле - Шателье, то можна прийти до висновку: у тих випадках, коли процес розчинення є ендотермічним (ΔН > 0), підвищення температури приводить до збільшення розчинності. Коли розчинення - процес екзотермічний (ΔН <0), із зростанням температури розчинність знижується. Зручно залежність між розчинністю і температурою зображати графічно у вигляді кривих розчинності. При змішенні двох рідин можливі три варіанти: 1) необмежена розчинність; 2) обмежена розчинність; 3) практично повна нерозчинність. Наприклад, спирт і вода необмежено розчинні один в одному, інакше кажучи, утворюють гомогенну (однофазну) систему при змішенні в будь-яких пропорціях. Обмежена розчинність рідин спостерігається, наприклад, при змішенні води і аніліну, води і фенолу, аніліну і гексану. Так, якщо змішати анілін і гексан при кімнатній температурі, то утворюються два шара: верхній є насиченим розчином аніліну в гексані, і нижній - насичений розчин гексану в аніліні. З підвищенням температури розчинність аніліну в гексані і гексану в аніліні збільшується до тих пір, поки буде досягнута температура, вище за яку утворюються гомогенні анілін-гексанові розчини. Зростання взаємної розчинності обумовлюється ендотермічністю (ΔН розчин.> 0) процесу розчинення. Склад суміші гексану і аніліну зручно виразити в молярних долях компонентів х(Х1), що змінюються від 0 до 1. Тоді для всіх сумішей виконується співвідношення:
х(С6Н14) + х(С6Н5NН2) = 1 или х(С6Н14) = 1 - х(С6Н5NН2)
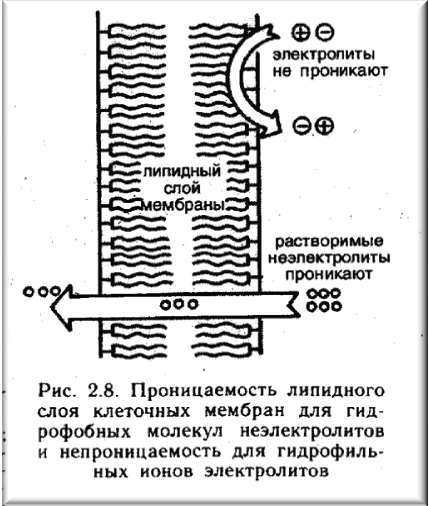
Діаграма залежності взаємної розчинності цих рідин від температури набуває компактного вигляду. Температуру, вище за яку взаємна розчинність рідин стає необмеженою при будь-яких їх співвідношеннях, називають верхньою критичною температурою розчинення Ткр. Так, вище Ткр = 333 К анілін і гексан стають необмежено розчинними один в одному при будь-яких співвідношеннях. Прикладом практично повністю нерозчинних один в одному рідин є бензол і вода. Біологічна роль розчинності речовин перш за все пов'язана із здатністю їх проходити через біологічні мембрани. При транспорті чужорідних для живих організмів сполук - лікарських препаратів і їх метаболітів за допомогою простої дифузії тільки жиророзчинні неіонізовані молекули легко проходять через мембрани (мал. 2.8). Внаслідок цього неелектроліти транспортуються відповідно до їх розчинності в ліпідах (відносяться до головних компонентів мембран), а електроліти - відповідно до ступеня їх дисоціації і розчинності в ліпідах недиссоційованих молекул.
У посудині з двома рідинами, що не змішуються, відбувається розподіл доданої в посудину речовини між рідинами пропорційно його розчинності в кожній з них. Розподіл речовин між двома рідинами, що не змішуються, підкоряється закону Нернста - Шилова:
при постійній температурі відношення рівноважних концентрацій розчиненої речовини, що розподілилася між двома рідинами (фазами), що не змішувалися, є величиною постійною, не залежною від загальної кількості компонентів:
Сα(Х) Кн(Х) = --------- Сβ(Х)
де Кн (X) - коефіцієнт розподілу речовини X, не залежний від концентрації; Сα (Х), Сβ (Х) - молярні концентрації розчиненої речовини X у фазах α та β відповідно. Закон застосовний у такому вигляді, коли розчинена речовина дисоціює і не асоціює ні в одній з фаз. У подібних випадках обмеження може бути усунене урахуванням впливу цих реакцій на концентрацію розчиненої речовини. Проте на практиці зручніше користуватися загальним коефіцієнтом розподілу:
[загальна концентрація усіх форм X] α Кон(Х) = ---------------------------------------------------- [загальна концентрація усіх форм X] β
Де К°н (X) - загальний коефіцієнт розподілу, α та β - фази. Для речовин-неелектролітів, які не дисоціюють жодною з фаз, Кн (X) = К°н (X) і К°н (X) не залежить від кислотності середовища (рН). Для речовин-електролітів К°н (X) залежить кислотності середовища. Якщо, наприклад, до двофазної системи вода (α) - тетрахлорид вуглецю (β) додати деяку кількість йоду, збовтати і дати рідини відстоятися, то після встановлення рівноваги при кімнатній температурі концентрація йоду в ССl (малиновий шар) опиниться в 85 разів більше, ніж у воді (жовтий шар) (мал. 2.20), тобто коефіцієнт розподілу йоду
Сβ(I2) В системі СС14—Н2О Кн (I2) = ------= 85. Сα(I2)
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 866; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.189.236 (0.008 с.) |

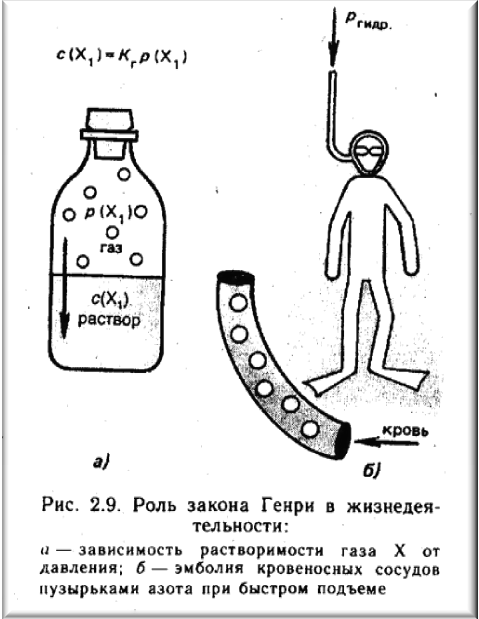 Кесонна хвороба, від якої зазвичай страждають водолази, - прояв закону Генрі. На глибині, наприклад, 40 м нижче за рівень морить загальний тиск підвищується приблизно в 4 рази і складає близько 400 кПа. Розчинність азоту в плазмі крові при такому тиску відповідно до закону Генрі в 4 рази більше, ніж на поверхні моря. Якщо піднімати водолаза дуже швидко на поверхню, то тиск в легенях різко знижується і, отже, значно знижується розчинність газів в плазмі крові. Внаслідок цього частина газів виділяється з крові у вигляді бульбашок. Ці бульбашки газів закупорюють дрібні судини в різних органах і тканинах (емболія), може привести до важкого ураження тканин і навіть загибелі людини. Аналогічна картина може виникнути і в результаті різкого зменшення тиску при розгерметизації скафандрів льотчиків-висотників, кабін літаків і апаратів, що спускаються (мал. 2.9, б).
Кесонна хвороба, від якої зазвичай страждають водолази, - прояв закону Генрі. На глибині, наприклад, 40 м нижче за рівень морить загальний тиск підвищується приблизно в 4 рази і складає близько 400 кПа. Розчинність азоту в плазмі крові при такому тиску відповідно до закону Генрі в 4 рази більше, ніж на поверхні моря. Якщо піднімати водолаза дуже швидко на поверхню, то тиск в легенях різко знижується і, отже, значно знижується розчинність газів в плазмі крові. Внаслідок цього частина газів виділяється з крові у вигляді бульбашок. Ці бульбашки газів закупорюють дрібні судини в різних органах і тканинах (емболія), може привести до важкого ураження тканин і навіть загибелі людини. Аналогічна картина може виникнути і в результаті різкого зменшення тиску при розгерметизації скафандрів льотчиків-висотників, кабін літаків і апаратів, що спускаються (мал. 2.9, б).