Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Задача 1. Розрахуйте рН буферного розчину. Три розчини містять оцтову кислотуСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
(Ка=1,80.10-5 моль.дм-3) концентрації 0,10 моль.дм-3 та ацетат натрію концентрацією 0,10(а), 0,20(б) та 0,50(в) моль.дм-3. Розрахуйте значення рН цих розчинів. [сіль] рН = рКа + lg ------------ рівняння Гендерсона - Гассельбаха [кислота] а. рН = 4,75+ lg(0,10/0,10) = 4,75 + lg 1,0 = 4,75 б. рН = 4,75+ lg(0,20/0,10) = 4,75 + lg 2,0 = 5,05 в. рН = 4,75+ lg(0,50/0,10) = 4,75 + lg 5,0 = 5,45
L Біонеоганічна хімія Лекція № 6. Комплексні сполуки
6.1 Реакції комплексоутворення. Координаційна теорія А. Вернера. 6.2 Поняття про комплексоутворювач (центральний йон). Поняття про ліганди. 6.3 Координаційна ємність (дентатність) лігандів. Внутрішня та зовнішня сфери комплексів. Природа хімічного зв'язку в комплексних сполуках. 6.4 Застосування комплексних сполук у медицині.
Самостійна робота: Ізомерія комплексних сполук. Будова та номенклатура. 6.1. Реакції комплексоутворення. Координаційна теорія А.Вернера. У визначенні поняття "комплексна сполука" ("координаційна сполука") у хіміків немає єдності. Засновник координаційної теорії комплексних сполук А. Вернер поділяв всі хімічні речовини на сполуки першого порядку (прості, або атомні типу СоС13, NН3, Н2О) і сполуки вищого порядку (або молекулярні), які є адуктами з'єднання сполук першого порядку (наприклад, СоС13 . NНз)- Вернер називав комплексними найбільш стійкі сполуки вищого порядку, які у водних розчинах або взагалі не розпадаються на свої складові частини, або розпадаються в дуже незначних кількостях. Пізніше різниця між термінами "комплексна сполука" і "сполука вищого порядку" стерлася і вони стали ідентичними. Труднощі, що виникають при спробі розмежування комплексних сполук і сполук першого порядку в значній мірі обумовлені тим, що в залежності від умов одну і ту ж саму речовину можна розглядати як просту і як комплексну сполуку. Так, багато речовин (зокрема, галогеніди лужних і лужноземельних металів), які асоційовані у твердому стані, у газоподібному стані існують у вигляді окремих молекул, а в розчині дисоціюють на складаючі їх іони. Оскільки у лабораторній практиці звичайно мають справу з комплексними сполуками в твердому або розчиненому станах, важливо узагальнити їх здатність до існування саме в цих умовах. Комплексною сполукою називається речовина, у вузлах кристалічної ґратки якої знаходяться комплексні іони, здатні до існування у розчині.
Комплексним іоном називається складний іон, який містить атом металу (іноді неметалу) у певному валентному стані, зв'язаний з одним або декількома здатними до самостійного існування молекулами або іонами. Комплексні сполуки можуть містити комплексний аніон, комплексний катіон, або взагалі не дисоціювати на іони (сполуки типу неелек-тролітів). В іноземній літературі (особливо в англійській або американській) комплексний іон, незалежно від його заряду, називають "комплекс". Цей термін одержав достатньо широке поширення й у вітчизняній літературі. Наприкінці XIX ст. був накопичений великий експериментальний матеріал, який показував, що багато молекул з реалізованими хімічними зв'язками здатні вступати в подальшу взаємодію з утворенням більш складних молекул другого порядку. А.Вернер (1893) був, очевидно, першим з хіміків, хто зрозумів, що для пояснення будови і властивостей цих незвичайних сполук необхідно відмовитися від уявлень про сталість валентності. Ним була створена так звана координаційна теорія, в основу якої покладене наступне: 1. Крім головних валентностей, у атомів існують також побічні валентності, які виявляють себе при деяких реакціях. 2. Насичення головних валентностей лежить в основі утворення сполук першого порядку, наприклад найпростіших бінарних сполук, типу НС1, Н2О, NН3, СuС12 і т.д. 3. Насичення побічних валентностей лежить в основі утворення сполук вищого порядку, що є продуктами сполучення сполук першого порядку, наприклад NH4СІ, Fе(СN)2 . 4КСN, А1С13 . 6Н2О і т.д. Теорія Вернера носила чисто формальний характер і не торкалася питання про природу сил, що обумовлюють координаційний зв'язок, і про механізм утворення комплексних сполук. Ці питання були уперше висунуті основоположником вітчизняної школи дослідників комплексних сполук Л.А.Чугаєвим і потім розроблялися в працях В.Косселя, В.Магнуса, Н.В.Сиджвіка, І.І.Черняєва, В.В.Лебединського, А.А.Грінберга, К.Б.ЯІШ-мирського, Б.В.Некрасова й ін. Відповідно до сучасних поглядів у структурі молекул комплексних сполук (названих також координаційними сполуками) варто розрізняти:
1) внутрішню координаційну сферу - центральний атом (комплексоутворювач), навколо якого знаходяться тісно зв'язані з ним ліганди (аденди) - молекули або іони (Н2О, NН3, СN-, F-, I-, Сl- і інші); 2) зовнішню координаційну сферу - сукупність всіх іонів, безпосередньо не зв'язаних з центральним атомом і внутрішньою координаційною сферою, що знаходяться за межами координаційної сфери.
Центральний іон – комплексоутворювач
K+[Fe(CN)6]4- [Co3+(NH3)6]3+Cl3-
Зовнішня внутрішня внутрішня зовнішня Коорденаційна коорденаційна коорденаційна коорденаційна Сфера сфера сфера сфера
Комплексне угруповання, що несе надлишковий позитивний або негативний заряд (указується праворуч від квадратної дужки), називається комплексним іоном. Наприклад: [Fе(СN)6]4- - комплексний аніон, а [Со(NН3)6]3+ - комплексний катіон. Відомі комплексні сполуки, що складаються тільки з центрального атома-комплексоутворювача і навколишніх його лігандів і не мають зовнішньої координаційної сфери. Такі, наприклад, карбоніли Ніколу [Ni(СО)4] і Феруму [Fе(СО)5], дихлордіамінплатина [Рt(NН3)2С12] та ін. Подібні їм сполуки не є електролітами. А.А.Грінбергом, а потім К.Б.Яцимирським було встановлено, що найбільшу здатність до комплексоутворювання мають атоми елементів трьох побічних груп VIII групи, а також атоми лантаноїдів і актиноїдів. Комплексоутворювачами можуть бути також неметали в позитивному ступені окиснення (В3+, Sі4+, Р5+, S6+, І7+ та ін.), рідше - у негативному ступені окиснення (I-, S2- та ін.). В якості лігандів у комплексних сполуках найчастіше фігурують гідроксильна група ОН- і оксогруппа О2-, аніони кислот, полярні молекули і молекули, що легко поляризуються, найрізноманітніших неорганічних і органічних сполук (Н2О, NH3, СО, NO, С3Н5N та ін.). Заряд комплексного іона (або нейтрального комплексу) є алгебраїчна сума заряду центрального атома (його ступеня окиснення) і зарядів лігандів. Іони зовнішньої сфери більш рухливі і легше вступають в обмінні реакції, ніж іони внутрішньої сфери. Слід, однак, мати на увазі, що хоча іони-ліганди, що утворюють внутрішню координаційну сферу, зв'язані з центральним атомом-комплексоутворювачем набагато більш міцними зв'язками, ніж іони зовнішньої сфери, усе-таки міцність цих зв'язків обмежена. Може відбутися так, що підібраний реагент буде утворювати з іонами-лігандами настільки міцну сполуку (важко розчинний осад, слабкий електроліт, ще більш міцний новий комплекс), що для його утворення буде достатньо навіть тої невеликої рівноважної концентрації іонів-лігандів, що створюються в розчині даним комплексним іоном при його частковому розпаді. У цьому випадку буде відбуватися руйнування комплексного іона.
Координаційна теорія А. Вернера та сучасні уявлення про будову комплексних сполук. Властивості комплексних сполук визначаються їхньою геометричною конфігурацією і характером зв'язку в молекулі (міцністю, ступенем іоно-генності або ковалентності зв'язку). Координаційна теорія, висунута А.Вернером у 1891, лише загалом указувала на розходження в характері зв'язку окремих атомів у молекулах комплексних сполук. Відповідно до цієї теорії, молекула комплексної сполуки має центричну будову (мається на увазі розміщення окремих замісників біля іона металу - комішексоутворювача), у більшості випадків октаедричну, тетраедричну або плоску. Атом комплексоутворювача називається центральнім атомом або центральним іоном. Щоб підкреслити різницю між центральним іоном комплексної сполуки й іоном того ж металу у вільному стані, центральний іон позначають символом елемента, поруч з яким у дужках римськими цифрами ставиться його валентність. Молекули й іони, безпосередньо зв'язані з центральним іоном, називають координованими групами (СІ - хлорогрупа, NНз — аміногрупа, H2О — аквогрупа), або внутрішньосферними замісниками (інакше адендами, або лігандами). Центральний іон у сукупності з координованими групами утворює внутрішню сферу комплексної сполуки. При написанні формул комплексної сполуки центральний іон разом із внутрішньосферними заступниками беруть у квадратні дужки, наприклад
[ Со(NН3)6]С13.
Якщо заряд центрального іона не дорівнює по величині сумі зарядів усіх іонів, що входять у внутрішню сферу, то комплексна сполука містить іони, що утворюють його зовнішню сферу і компенсують його заряд. Заряд комплексу може нейтралізуватися або простими, або комплексними іонами: [Рt(NН3)4]С12; К2[РtС14]; [Рt(NН3)4][РtС14]. Комплексні сполуки, що містять зовнішньосферні іони, дисоціюють у розчині наступним чином (на комплексний іон та іони зовнішньої сфери):
[Рt(NН3)4]С12 ↔ [Рt(NН3)4] 2+ + 2С1-
К2[РtС14] ↔ 2К+ + [РtС14]2-
[Рt(NН3)4][РtС14] ↔ [Рt(NН3)4] 2+ + [РtС14]2-
У комплексній сполуці центральний іон виявляє так звану головну і побічну валентності. Головною валентністю Вернер назвав сили, аналогічні тим, що виявляються при утворенні простих сполук першого порядку. За рахунок сил побічної валентності відбувається сполучення молекул першого порядку у сполуки вищого порядку. Часто при написанні структурних формул комплексних сполук головні валентності позначають суцільними лініями, а побічні - пунктиром. Так, у сполуці
NH3 Cl-
Pt
NH3 Cl-
дві хлорогрупи приєднані до Рt (II) за рахунок головної валентності, а дві молекули NHз - за рахунок побічної. Ґрунтуючись на таких фактах, як відсутність ізомерії у К2РtС14 та інших сполуках, Вернер не проводив принципового розходження між замісникaми, приєднаними за рахунок головної і другорядної валентності. Надалі це припущення було підтверджено рентгеноструктурним аналізом, вивченням ізотопного обміну і т.п. Прояв побічної валентності часто приводить до зміцнення зв'язків, утворених за рахунок головної валентності. Частіше зустрічаються випадки стабілізації вищого валентного стану центрального атома, хоча іноді має місце зміцнення і його нижчого валентного стану. Наприклад, у сполуці [Со(NНз)6]Сl стан Со(ІІІ) більш стійкий, ніж тривалентний стан Кобальту у СоС13, СоВг3. Двовалентний стан для Аргентуму нехарактерний, але комплексна сполука Аg(II) з α,α'-дипіридином (dр) цілком стійка. Солі Феруму (II) досить легко піддаються окисненню, але [Fеdp3]С13 піддається окисненню дещо важко. З іншого боку, характер насичення головної валентності істотно впливає на міцність зв'язку за рахунок побічної валентності. Наприклад, у ряді випадків термічна стійкість комплексних сполук (температура видалення груп із внутрішніх сфер) істотно залежить від характеру аніона зовнішньої сфери. Так, [Nі(NНз)6]С1з відщеплює аміак при 437 К, тоді як [Nі(NН3)6]І2 стійкий до 494 К.
Кількість атомів або груп атомів, зв'язаних з центральним атомом, називається його координаційним числом (скорочено к. ч.). Координаційне число є характеристикою елемента у визначеному валентному стані. Двовалентна Рt - виявляє к. ч. 4, чотиривалентна - к. ч. 6. Координаційне число може бути рівним валентності (наприклад, у Карбону у багаточисельних органічних сполуках), більшим від валентності (найбільш частий випадок), і тільки дуже рідко буває менше валентності. Останнє найчастіше виявляється у сполуках, які містять координовані багатовалентні іони О2-, наприклад у сполуках К2СО3, КСlO4 і т.п. (к. ч. Карбону в іоні СО32- дорівнює трьом, а його валентність - чотирьом; к. ч. Хлору в іоні С1O4- дорівнює 4, а його валентність - 7. Деякі іони металів мають стале координаційне число, а деякі - змінне. До перших відносяться: РІt(II) (к. ч. 4), Рt (IV) (к. ч. 6), Со (III) (к. ч. 6), Rh (III) (к. ч. 6), Іг (III) (к. ч. 6), Іг (IV) (к. ч. 6), Рd (II) (к. ч. 4), Аu (III) (к. ч. 4). До другого типу відносяться: Ni (II) (к. ч. 4; 6), Сu (II) (к. ч. 6; 4; 3) і більшість інших елементів. Координаційне число, яке проявляється даним іоном, залежить від природи внутрішньосферних і зовнішньосферних груп і від температури, а у випадку розчинів комплексних сполук, крім того, і від концентрації аденду і центрального іона, а також від природи розчинника. Зниження температури сприяє прояву більш високого координаційного числа. Так, при нагріванні [(Со(NН3)6]С12 у рівновазі знаходяться такі сполуки:
T = 423 K T = 473 K
[(Со(NН3)6]С13 ↔ [(Со(NН3)2Cl2] + 4NH3 ↔ CoCl2 + 6NH3
К.ч. Со(ІІ) = 6 К.ч. Со(ІІ) = 4
Найчастіше зустрічаються комплекси, що містять центральний іон з к. ч. 4 і 6, рідше з к. ч. З і 2. Припускають існування комплексних сполук з к. ч. 5 і 7. Нарешті, до сполук з координаційним числом, більшим за 6, відносяться Ме4[Мо(СN)8] і Ме4[W(СN)8], де Ме - однозарядний катіон.
6.2 Поняття про комплексоутворювач (центральний йон). Поняття про ліганди. Комплексні сполуки(координаційні сполуки) - складні хімічні речовини, у складі яких є комплексні іони, утворені центральним атомом і пов'язаними з ним лігандами. Згідно теорії А. Вернера, в центрі комплексного з'єднання знаходиться центральний іон-комплексоутворювач. Іонамі-комплексоутворювачами є катіони металів. Найбільшу схильність до комплексоутворення проявляють іони d-елементів.
Навколо центрального іона-комплексоутворювача знаходяться протилежно заряджені іони або нейтральні молекули, які називають лігандами, або адeндами. Іон-комплексоутворювач і ліганди складають внутрішню сферу комплексної сполуки, яку позначають квадратними дужками. Число лігандів (адендів), які координуються навколо центрального іона-комплексоутворювача, називається координаційним числом. Заряд комплексного іона рівний алгебраїчній суммі зарядів іона-комплексоутворювача і лігандів. Наприклад:
+2 0 2+ 1- [ (Сu(NН3)4 ] С12 центр. лиганд ион Внутрішня зовнішня Сфера сфера Комплексні сполуки не завжди побудовані з іонів; заряди атомів і молекул, що входять до складу комплексу зазвичай невеликі. Тому правильніше користуватися терміном «центральний атом», а не «центральний іон». Центральний атом • Найчастіше центральними атомами є іони металів, d-елементів: Сu, Аg, Pt, Сг, Fе, Zn і т.д. Але до складу деяких комплексних сполук можуть входити і іони лужних і лужно-земельних металів (Nа, Са, Мg). • Заряд центрального іона є основним чинником, що впливає на координаційне число)
+ 1 → 2 заряд + 2 → 4, 6 Координаційні числа центрального + 3 → 6, 4 (видєлені найбільш іона + 4 → 8, 6 характерні) Координаційне число не є незмінною величиною. Навіть для одних і тих же комплексоутворювачів і лігандів координаційне число залежить від агрегатного стану речовини, від концентрації, температури.
Ліганди (lig) внутрішньої сфери можуть заміщатися на інші молекули або іони, при цьому змінюється заряд комплексного іона, наприклад:
NO2- NO2- NO2- [(Со3+(NН30)6]3+С13 → [(Со3+(NН30)5NO2]2 +С12 → [(Со3+(NН30)4(NO2)2]1 +С1 → NO2- NO2- [(Со3+(NН30)3(NO2)3]o → K [(Со3+(NН30)2(NO2)4]- → K 2 [(Со3+NН30(NO2)5]2- →
NO2- → K 3 [(Со3+(NO2)6]3-
В даний час прийнято класифікувати комплекси відповідно до типу утворюючих їх лігандів. 1. Комплекси, що містять молекулярні монодентатні ліганди. Найважливішими представниками цього класу комплексних сполук є: а) гідрати, у яких лігандами служать тільки молекули води (аквакомплекси), наприклад [Са(Н2О)6]2+СІ2, [Са(Н2О)4]2+(NO3-)2 і ін.; кристалічні речовини, що включають такого роду комплекси, називають кристалогідратами;
б) аміакати, у яких лігандами є тільки молекули аміаку, наприклад, [Аg(NНз)2]+Сl-, [Сu(NН3)4]2+SO42-,[Сг(NН3)6]3+Сl3- та ін.;
в) карбоніли металів - ліганди молекули монооксида карбону, при цьому комплекс не має електричного заряду, наприклад
Комплекси, що містять іонні ліганди або ацидокомплекси, у яких лігандами є кислотні залишки, причому увесь комплекс несе негативний заряд і може розглядатися як аніон якої-небудь кислоти; відповідно назві ліганда ці комплекси називають гідроксокомплексами - [А1(ОН)6]3-, [Zn(ОН)4]2-, [Sn(ОН)6]2-, фторокомплексами - [А1F6]3-, [ВеF4]-, [ВF4]-.
2. Циклічні комплексні сполуки, утворені полідентатними лігандами, що складають групу так званих хелатних (клішнеподібних), наприклад типу три (етилендіамін) кобальт (III) хлориду з трьома п'ятичленними циклами:
NH2 (CH2)2 H2N
N Co N H2 H2 (CH2)2 (CH2)2 H2 H2 N N
6.3 Координаційна ємність (дентатність) лігандів. Внутрішня та зовнішня сфери комплексів. Природа хімічного зв'язку в комплексних сполуках. Одновалентні кислотні залишки, NН3, RNН2, С6Н5N і багато інших груп, що входять до складу комплексної сполуки, зв'язані з центральним іоном за допомогою одного зв'язку і займають одне координаційне місце. Але можливий випадок, коли один замісник зв'язаний з центральним іоном за допомогою двох або більше атомів, що входять до його складу. Такі комплексні сполуки називаються циклічними. Кількість координаційних місць, які може займати той або інший замісник біля центрального атома, називається координаційною ємністю, а самі аденди - одно-, дво-, три- і т.д. полікоординаційними замісниками. В якості полікоординаційних замісників можуть виступати нейтральні молекули, які містять два або декілька атомів із вільною електронною парою. Наприклад, NН2 - СН2 - СН2 - NН2, кислотні залишки багатоосновних кислот SО42-, С1O4- і т.п. Можливий випадок, коли один і той же замісник містить атом з донорною функцією і по способу свого утворення є кислотним залишком. Такими є кислотні залишки амінокислот, наприклад NН2СН2СОСl-. Число іонів або молекул, безпосередньо зв'язаних з центральним атомом-комплексоутворювачем, тобто число лігандів, що координуються навколо центрального атома, називають координаційним числом останнього. Наприклад, у комплексних сполуках [Аg(NН3)2]+Сl-, К4+[Fе(СN)6]4-, [Си(NН3)4]2+Сl2-, [Fе(СО)5] і [Те(СО)7] координаційне число дорівнює, відповідно, 2, 6,4, 5 і 7. У хімії комплексних сполук координаційне число грає приблизно ту ж роль, що і валентність у хімії сполук першого порядку. В залежності від хімічної природи і геометричних розмірів центрального атома і оточуючих його лігандів координаційне число може варіювати в межах від 1 до 12, причому найчастіше зустрічаються сполуки з координаційними числами 4 і 6. Деякі ліганди приєднуються до центрального атома не одним, а двома і більшим числом координаційних зв'язків, займаючи у внутрішній координаційній сфері відповідно два і більше число місць. У таких випадках даний ліганд має координаційну ємність, або дентатність, більше одиниці, тобто є полідентатним. Так, якщо ліганди типу Н2О, NН3, іонів галогенів і іона СN- завжди монодентатні, то, наприклад, сульфат- і карбонат-іони і молекула етилендіаміну H2N-CH2-CH2-NH2 завжди бідентатні, а серед складних органічних сполук зустрічаються і такі, котрі можуть виступати в ролі три-, тетра-, пента-, гекса- і навіть октадентатних лігандів. Полідентатні органічні ліганди, замикаючись двома або декількома координаційними зв'язками на центральний атом, можуть утворювати циклічні комплекси. Зазвичай хімічний зв'язок між центральними атомами і лігандами в комплексних сполуках обумовлений донорно-акцепторною взаємодією, причому ліганди є донорами електронних пар, а центральні атоми -акцепторами цих пар. Дійсно, іони і молекули, які найчастіше виступають у ролі лігандів, мають вільні неподілені пари електронів. Так, наприклад, молекула води, молекула аміаку, молекула монооксиду Карбону, іон гідроксила, ціанід-іон та іон Флуору можуть бути зображені так: H H ........ : O: H: N: H: C::: O:: O: H-: C::: N-:: F- : ........ H В той же час центральні атоми-комплексоутворювачі, у ролі яких найчастіше виступають атоми перехідних елементів, мають вільні орбіталі для розміщення цих електронів у d - i f -підрівнях. У зв'язку з цим комплексними сполуками іноді називають молекулярні сполуки визначеного складу, утворення яких з більш простих сполук не зв'язано з виникненням нових електронних пар. Слід, однак, обмовитися, що зведення хімічного зв'язку в комплексах тільки до донорно-акцепторної взаємодії не завжди правомірно. У зв’язку зцим більш коректно наступне визначення: комплексними називаються сполуки, у вузлах кристалічних ґраток яких знаходяться складні частинки (комплексні іони), що склаоаються з центрального атома і навколишніх його молекул або іонів причому цілісність цих комплексних іонів зберігається при переході сполуки в розплавлений або розчинений стан. 6.4 Застосування комплексних сполук у медицині. Унікальне значення внутрішньокомплексних сполук для життєдіяльності людського організму виявляється вже з того, що складні молекули гемоглобінів (Мг = 67 000) здійснюють перенесення молекулярного кисню від легень до тканин. Гемоглобін містить у своєму складі так звані простетичні (небілкові) групи, або геми, побудовані по типу
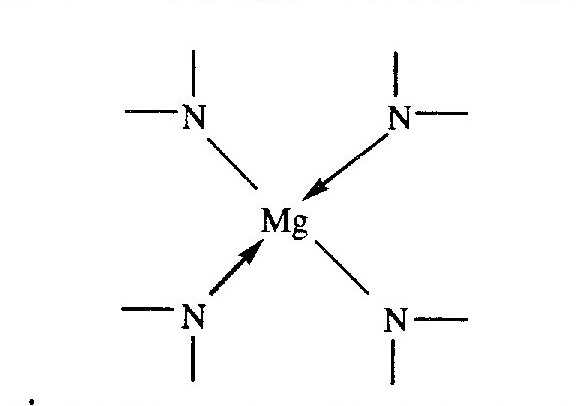
Для життя рослин унікальне значення мають хлорофіли-пігменти, за допомогою яких вищими рослинами і зеленими водоростями здійснюється фотосинтез. Хлорофіли являють собою внутрішньокомплексні сполуки, у яких комплексоутворювачами є іони Магнію, зв'язані з органічною частиною молекули чотирма зв'язками:
По типу внутрішньокомплексних сполук побудовані поліатомні молекули багатьох ферментів, роль комплексоутворювачів у яких відіграють частіше атоми таких елементів, як Ферум, Цинк, Кобальт, Молібден, Купрум і Манган, які К.Б.Яцимирський (разом з Натрієм, Калієм, Кальцієм і Магнієм) образно назвав "металами життя ". Так, простетична група гемоглобінів є також структурною складовою молекул пероксидази - ферменту, який каталізує окисно-відновні реакції за участю пероксида водню, а також каталази, яка каталізує розкладання пероксиду Гідрогену, що утворюється в процесах метаболізму. За рахунок внутрішньокомплексних зв'язків атоми Цинку включаються в структуру карбоксипептидази, яка каталізує гідролітичне відщеплення кінцевих кислотних залишків у білках і пептидах. Атоми Молібдену і Феруму входять до складу ксантиоксидази, яка каталізує окисно-відновні реакції, зв'язані з обміном пуринів і утворенням сечової кислоти. У медичній практиці комплексонометрію застосовують для визначення у різних рідинах і тканинах людського організму мікроелементів і вмісту різних катіонів металів у фармацевтичних препаратах. Запропоноване також використання комплексонів для маскування (зв'язування і знешкодження) іонів металів, що є присутніми у лікарських препаратах у вигляді забруднень. Є відомості про успішне застосування комплексонів для розчинення каменів, що утворюються в нирках, печінці і жовчному міхурі. Зрозуміло, таке застосування комплексонів вимагає дуже великої обережності, щоб разом з розчиненням каменів не відбувалося руйнування мінеральної основи кісткової й іншої тканин людського організму. Внутрішньокомплексні сполуки набули великого значення для аналітичної хімії. На їхньому застосуванні заснований комплексонометричний метод кількісного визначення іонів металів, введений в аналітичну практику Г.Шварценбахом (1945). Як реагенти в комплексонометрії (хелатометрії) для кількісного зв'язування металів звичайно використовують похідні амінополікарбонових кислот, що одержали назву комплексонів, з яких найбільше значення набув комплексон IIІ (або трилон Б, ЕДТА, версен). Комплексонометрія одержала велике поширення для кількісного визначення катіонів багатьох металів (Са2+, Мg2+, Sг2+, Zn2+, Рb2+, Сu2+, А13+ і ін.), а побічно і для визначення деяких аніонів (SО42-, РО42-, F- та ін.). Поняття про металолігандний гомеостаз. У живому організмі здійснюється цілий ряд зустрічних фізико-хімічних процесів (випаровування і конденсація, розчинення і кристалізація, електролітична дисоціація й утворення молекул з іонів і т.д.) -багато сотень тисяч біохімічних реакцій, що протікають у залежності від численних умов зовнішнього і внутрішнього середовища, з різними швидкостями. Проте завдяки тонкій нейрогуморальній регуляції досягається разюча сталість внутрішнього середовища (гомеостазис) - з погляду термодинаміки квазірівноважний, або стаціонарний стан. Особливе значення в гомеостазі мають d- елементи. Тут було наведено досить прикладів, щоб оцінити, яке велике значення хімії для теоретичного озброєння медицини і її подальшого прогресу. Чим більш строгими і кількісно визначеними будуть наші знання щодо закономірностей і умов перебігу окремих хімічних і фізико-хімічних процесів, що здійснюються в організмі, тим повніше будуть наші уявлення про багатогранний процес обміну речовин і енергії, тим ясніше стануть фізико-хімічні механізми, що лежать в основі нейрогуморальної регуляції організму. В організмі людини в якості лігандів (адендів) у біологічні комплекси входять органічні сполуки, що називаються біолігандами. Це білки, амінокислоти та їхні похідні, нуклеїнові кислоти, нуклеотіди, нуклеопро-теїди, азотисті основи, пептиди, жирні кислоти, вуглеводи, вітаміни, ферменти, гормони, вода, жовчні кислоти, кето- і оксикислоти та інші сполуки. Комплексоутворюючу здатність біологічних лігандів можна пояснити наявністю в їхніх молекулах декількох функціональних груп різного типу (звідси велика різноманітність цих сполук). Наприклад, нуклеїнові кислоти мають у своєму складі карбоксильні - СООН і аміногрупи - NН2, причому можуть бути первинні (-NН2), вторинні (-NН-), третинні (-N=) атоми Нітрогену, що здатні координувати іони металів. Характерно, що біологічні комплекси є відносно нестійкими при певних умовах (присутність розчинника, дія ферментів і т.д.) хімічні зв'язки розриваються, в результаті чого утворюються комплексні іони, активність яких у ряді випадків значно вища, ніж комплексних сполук. Біологічна роль хімічних елементів в організмі людини дуже багатогранна. Макроелементи, в основному, відіграють роль пластичного матеріалу в побудові тканин, підтримують осмотичний тиск, рН середовища, іонну рівновагу, кислотно-лужну рівновагу, стан колоїдів і т.д. Мікроелементи разом з ферментами, гормонами, вітамінами та іншими біологічно активними речовинами беруть участь у процесах розмноження, росту, обміну білків, жирів, вуглеводів тощо. Біологічні функції мікроелементів у живому організмі зв'язані, головним чином, з процесами комплексоутворення між біологічними лігандами й іонами відповідних металів. Участь мікроелементів у фізіологічних процесах може здійснюватися двома шляхами: 1) атом входить у структуру ферменту в якості комплексутворювача (метал - активатор); 2) елемент є сполучною ланкою між системами фермент - субстрат. В даний час відомо близько 200 ферментів, до складу яких у якості комплексоутворювачів і активаторів входять мікроелементи. У той же час деякі мікроелементи можуть блокувати активні центри молекул ферментів. Вплив мікроелементів на біологічні процеси може здійснюватися й через нуклеїнові кислоти. Мікроелементи входять або до складу ферментів, що активують синтез і розпад нуклеїнових кислот, або безпосередньо в комплексні сполуки з нуклеїновими кислотами. Крім того, мікроелементи сприяють стабілізації структури нуклеїнових кислот, впливають на їхню просторову конфігурацію і т.д. Таку ж участь приймають мікроелементи в обміні вітамінів, гормонів та інших біологічно активних сполук. Варто розрізняти специфічний і неспецифічний вплив мікроелементів на обмінні процеси. Приклади специфічного впливу: взаємозв'язок між обміном Цинку в тканині підшлункової залози і продукцією інсуліну, вплив Мангану на залози внутрішньої секреції, вплив Йоду на функцію щитовидної залози і т.д. Неспецифічний вплив, наприклад, на функцію щитовидної залози спостерігається в таких мікроелементів, як Купрум, Кобальт, Манган, Флуор та ін. Властивість іонів металів утворювати міцні зв'язки з сірковмісними лігандами використовується і при підборі ліків, вживаних для лікування при отруєннях. Такі ліки мають загальну назву - антидоти. У багатьох випадках фармацевтичні властивості медичних препаратів знаходяться в безпосередньому зв'язку з їх окисно-відновними властивостями. Так, багато з антисептичних, протимікробних і дезінфікуючих засобів, наприклад йод, перманганат Калію, пероксид Гідрогену, солі Купруму, Аргентуму і Меркурію, є в той же час і сильними окисниками. Застосування тіосульфату Натрію (3,3 М Nа2S2О3) як універсального антидоту (протиотрути) засновано на його здатності брати участь в окисно-відновних реакціях у ролі як окиснювача, так і відновника. У випадку отруєнь сполуками Арсену (III), Меркурію (II) і Плюмбуму (II) прийом усередину розчину Nа2S2О3 приводить до утворення важкорозчинних і тому практично неотруйних сульфатів, наприклад:
Рb (СН3СОО)2 + Na2S2О3 + Н2О = РbS+ Na2SO4 + 2СН3СООН.
Антіоксиданти - природні або синтетичні речовини що запобігають окисленню органічних сполук. Їх застосовують в харчовій промисловості для запобігання псуванню харчових продуктів. Надзвичайно важлива роль в захисті організму на молекулярному і клітинному рівнях від ушкоджувальної дії сильного окислювача - радикала НО2- належить ферменту супероксидісмутазі. Цей Ф є метоллопротєїдом і може містити як кофактор іони Мn2+, Fе2+, Сu2+, Zn2+. Реакція, що каталізується супероксидісмутазою має наступний вигляд: НО2- + НО2- → Н2О2 + О2 Подібні сполуки використовують у фармацевтичній промисловості для збереження лікарських засобів.
Самостійна робота: Ізомерія комплексних сполук. Будова та номенклатура. Велике поширення в хімії комплексних сполук має ізомерія - існування декількох сполук з однаковими складом і молекулярною масою, але молекули яких відрізняються за будовою, фізичними і хімічними властивостями. Для комплексних сполук особливо характерні наступні види ізомерії: сольватна (у водних середовищах - гідратна), іонізаційна, координаційна, геометрична і оптична (дзеркальна). Сольватна (гідратна) ізомерія полягає в різному розподілі молекул розчинника (води) між внутрішніми і зовнішньою координаційними сферами комплексу. Так, наприклад, гексагідрат хлориду Хрому (III) СгС13-ЗН2О існує у вигляді трьох ізомерів: [Сг(Н2О)6]С13 [СгС1(Н2О)5]С12-Н2О [СгС12(Н2О)4]С1-2Н2О трихлорид гексааква моногідрат дихлорида дигідрат монохлорида хрому(ІII) пентааквахлор тетрааквадихлоро хрому(ІII) хрому(ІII) Іонізаційна ізомерія обумовлена різним розподілом неоднакових за своєю природою іонів між внутрішніми і зовнішньою координаційними сферами комплексної сполуки, у зв'язку з чим змінюється характер дисоціації цієї сполуки, наприклад: (РtBr2(NHз)4]С12 [РtС12(NН3)4]Вг2 дихлорид тетраамінди- дибромід тетраамін- бромоплатини (IV) дихлороплатини (IV)
Координаційна ізомерія обумовлена тим, що в сполуці шо складається з комплексного катіона і комплексного аніона, ліганди можуть бути розподілені різним чином між цими двома комплексними іонами, наприклад:
гексаціанохромат (III) гексаціанокобальтат (III) гексаамінокобальта (III) гексаамінхрома (III) Суть геометричної ізомерії (цис-, транс -ізомерія) полягає у різному просторовому розташуванні адендів біля центрального іона і виявляється тільки в комплексних сполуках, які мають октаедричну або площинну будову, наприклад комплекс кобальту СоA4Ва2 існує у вигляді таких ізомерних форм:
Сполуки II і IV називаються цис -ізомерами, а І і III — транс -ізомерами. Чим складніший хімічний склад молекули, тим більше можливостей для прояву ізомерії. Так, для комплексних сполук, що містять у внутрішній сфері 6 різних адендів, можуть існувати 15 геометрично ізомерних форм. У багатоядерних сполуках можливості прояву геометричної ізомерії особливо широкі. У більшості випадків геометричні ізомери розрізняються між собою хімічними властивостями, розчинністю, магнітним сприйняттям, дипольними моментами. У випадку менш стійких сполук, наприклад похідних Со(ІІІ), Сг (II) та ін., в процесі хімічної взаємодії утворюється суміш двох або декількох ізомерів, які можна розділити перекристалізацією. Оптична (дзеркальна) ізомерія спостерігається у
|
|||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 512; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.44.232 (0.02 с.) |