
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Самостійна робота: Сильні та слабкі електролітиСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
3.1 Розчини електролітів.
Поведінка розведених розчинів неелектролітів добре описується законами Вант-Гоффа та Рауля. Виявилось, що для розчинів електролітів (кислот, основ, солей) ці закони порушуються: осмотичний тиск значно вищий, ніж це випливає з рівняння Вант-Гоффа, а точка кипіння і замерзання таких розчинів теж суттєво відрізняється від розрахованих значень для розчинів неелектролітів такої самої концентрації Відхилення у поведінці розчинів електролітів Вант-Гофф спробував пояснити за допомогою коефіцієнта i, введення якого у рівняння для осмотичного тиску дає можливість знайти осмотичний тиск Р осм для розчину електроліту з концентрацією с:
Росм = icRT
Виходячи з цього рівняння, множник, який він назвав ізотонічний коефіцієнтом, показує, у скільки разів експериментальне визначений осмотичний тиск розчину у електроліту Рексп більше за розрахований Рразр для неелектроліту з тою самою концентрацією: Р експ і = ----------- Р розр Пояснити відмічені відхилення у поведінці розчинів електролітів від законів Вант-Гоффа і Рауля вдалося тільки за допомогою теорії електролітичної дисоціації та теорії сильних електролітів. Сванте Арреніус(1883) сформулював теорію електролітичної дисоціації. Згідно цієї теорії, процес розпаду речовин в розчині на іони називається електролітичною дисоціацією. Кислоти - це речовини, що дисоціюють на іон гідрогену (Н+) і аніон, а основи - сполуки, які при дисоціації дають гідроксил-іон (ОН-) та катіон. Процесом нейтралізації називають реакцію сполучення іонів Н+ з іонами ОН-, внаслідок чого утворюється вода. Сіль - сполука, що дисоціює на катіон і аніон. Солі в розчинах дисоціюють на іони повністю, тоді як кислоти і основи дисоціюють не повністю. Внаслідок дисоціації встановлюється рівновага між продисоційованими іонами та недисоційованими молекулами, яка виражається за допомогою константи рівноваги і називається константою дисоціації. Електролітична дисоціація водних розчинів слабких електролітів- оборотний процес: у кожний даний момент за рахунок розпаду молекул утворюються іони (іонізація), а за рахунок зіткнення іонів утворюються молекули (молізація). Кількісну характеристику рівноважного складу дисоціації електроліту дає ступінь його дисоціації α, що вказує, яка частка молекул розпалась на іони:
(число молекул, що розпались) α = ----------------------------------------. (загальне число молекул)
Коефіцієнт і для неелектролітів дорівнює одиниці, а для електролітів більший за одиницю. Величина його з розбавленням розчину буде збільшуватись, наближаючись до граничного значення для кожного електроліту: до простого цілого числа 2, 3, 4 - в залежності від числа іонів, що утворюються при розчиненні молекули речовини. Наприклад, при розчиненні речовин:
NaCl ↔ Na+ + Cl- i → 2;
K2SO4 ↔ 2K+ + SO4- i → 3;
3.2 Електроліти, в організмі людини.
Електроліти відіграють колосальну роль у життєдіяльності організмів, зокрема людського організму. Якщо відвернутися від біохімічних і фізіологічних функцій кожного окремо катіона й аніона і зупинитися лише на їхній спільній дії, то потрібно відзначити, що наявністю електролітів, в основному, визначається величина осмотичного тиску фізіологічних рідин Існуванням перепадів осмотичного тиску (осмотичних градієнтів) пояснюються явища активного транспорту води, що відбуваються в живому організмі за допомогою осмосу. Наявність електролітів у фізіологічних рідинах помітно впливає на розчинність білків, амінокислот і інших органічних сполук, особливо низькомолекулярних з полярним характером молекул При невеликих концентраціях, коли іонна сила розчину I < 1-2, збільшення вмісту в рідинах електролітів приводить, наприклад, до підвищення розчинності в них гемоглобіну, карбоксигемоглобіну і цистіну. Однак подальше збільшення концентрації електролітів (I > 2) приводить до зниження розчинності цих речовин. Здатність електролітів утримувати воду у вигляді гідратів перешкоджає зневоднюванню організму.
При нормальному стані організму вміст катіонів у плазмі крові складає в середньому 154 моль/м3 і приходиться, в основному, на частку іонів натрію, калію, кальцію і магнію. Серед аніонів, загальний вміст яких у плазмі крові складає теж -154 моль/м3, велика частка приходиться на хлорид- і гідро-карбонат-іони, а також багатозарядні макроіони білків. По вмісту окремих катіонів і аніонів у плазмі крові близька проміжна (інтерстиціальна) рідина. Обидві ці позаклітинні рідини істотно відрізняються за складом від внутрішньоклітинних рідин (табл.).
Таблиця:
Важливо відзначити, що зневоднювання організму при недоліку в ньому електролітів не може бути повною мірою усунуто тільки посиленим споживанням води. Дефіцит електролітів і зв'язана з цим втрата організмом води приводять насамперед до згущення крові, що несприятливо позначається на всій динаміці кровообігу. Загальний вміст води в організмі людини в розрахунку на середню масу 70 кг складає 42 кг, або 60 % від усієї маси. Причому 2/3 цієї кількості зосереджено у внутрішньоклітинних рідинах (еритроцитах, клітках м'язової тканини і т.д.), а 1/3 - у позаклітинних (плазмі крові, тканинної рідини, лімфі тощо). У плазмі крові знаходиться -3,5 кг води, а в інтерстиціальній рідині ~ 10,5 кг (5 і 15 %, відповідно від маси тіла). Втрата приблизно 1/3 усієї кількості води, що знаходиться в позаклітинних рідинах, небезпечна, а втрата 2/3 вже є смертельною. Тому порушення нормального електролітного балансу організму викликає серйозні наслідки. Необхідно, щоб постійні втрати електролітів через шлунково-кишковий тракт, нирки і за рахунок потовиділення безупинно поповнювалися з їжею і питною водою. Про значення електролітів для життєдіяльності організму людини і тварин свідчать досвіди, у яких демонструється можливість тривалого (годинами) функціонування ізольованих органів тварин. Наприклад, серце жаби або кролика в розчині, що містить ту ж концентрацію електролітів, що і у плазмі крові, функціонує досить довго. У чистій воді або в розчинах з більш низькою концентрацією іонів їхня діяльність припиняється майже миттєво. Порушення обміну катіонів в організмі приводить до адінамії- м'язової слабкості, до припинення або різкого ослаблення рухової активності Серед катіонів, за винятком Н+, найбільше значення мають Na+ і К+, які виявляються практично у всіх тканинах. Натрій є в основному позаклітинним катіоном: його вміст у плазмі крові (130-155 моль/м3) значно вище, ніж у нерозділеній крові (79-91 моль/м3), у якій містяться ще форменні елементи (еритроцити, лейкоцити і кров'яні пластинки) із клітинною структурою. Калій, навпаки, є типовим внутрішньоклітинним катіоном: його вміст у цільній крові досягає 40-60 моль/м3, а в плазмі - 4,0-5,6 моль/м3. Загальна маса іонів натрію в організмі дорослої людини -0,15 кг, причому для забезпечення нормального обміну речовин необхідно споживати щодоби з їжею 0,010-0,015 кг кухонної солі (при безсольовій дієті не менш 0,002 кг). Недолік в організмі іонів натрію викликає негативні наслідки: падіння осмотичного тиску (гіпоосмія) у позаклітинних рідинах і зв'язане з цим проникнення води усередину еритроцитів, клітини головного мозку й ін., що призводить до гемолізу й інших форм цитолізу, а також до Досить небезпечні розлади викликані появою в організмі надлишку катіонів натрію. Якщо надлишок іонів натрію значний, то в міжклітинний простір, де він в основному накопичується, підсилюється приплив води, розвиваються набряки, одночасно порушуються і функції клітин, що втратили частину води, і вони поступово відмирають. Крім того, відбувається гальмування в передачі нервових імпульсів, розвивається надлишковий артеріальний тиск (гіпертонія). Загальний вміст іонів калію в організмі дорослої людини звичайно знаходиться на рівні 0,133-0,140 кг, добова потреба в ньому складає 0,002- 0,003 кг. Іони калію беруть участь у передачі нервових імпульсів, у здійсненні м'язових скорочень і в регулюванні діяльності серця (сповільнюють ритм і зменшують силу скорочень серцевого м'яза). Недолік в організмі калію (гіпокаліємія) може виникнути при тривалих і сильних проносах, блювоті, надлишковому сечовиділенні (через уживання сечогінних засобів; при введенні в організм великих кількостей розчинів, що не містять іонів калію; при порушенні функцій кори надниркової залози тощо). При цьому спостерігається придушення нервово-м'язової збудливості, гальмується синтез білка і підсилюється його розпад. Усе це призводить до м'язової слабкості, стомлюваності, задишці, нудоті, порушенню нормальної діяльності серця, підвищенню тиску крові у венах, зникненню рефлексів, розвитку паралічів і галюцинацій. Значний надлишок в організмі іонів калію викликає хвороби нирок, підсилює розпад еритроцитів (гемоліз) і тканинних клітин, порушення кислотно-лужної рівноваги, спостерігаються також специфічні розлади серцевої діяльності. Вміст іонів кальцію в організмі дорослої людини складає -1,050 кг, 99 % цієї кількості знаходиться в складі кісток у вигляді важко розчинних фосфатів, головним чином у виді трикальційфосфату Сa3(РО4)2. При недостатнім надходженні в організм кальцію (менш 0,007 кг/добу), особливо у дитячому віці, утворювана хрящеподібна тканина не костеніє, розвивається рахіт з такими загальновідомими наслідками, як скривлення кісток ніг, грудної клітки (куряча хвороба), хребта і таза (рахітичний горб і таз), розм'якшення кісток (остеомаляція) і т.д. У нерозділеній крові утримується —12 моль/м3 іонів кальцію, а в плазмі крові 4,5-5,7 моль/м3, однак роль цих іонів у забезпеченні нормальної діяльності нервової, м'язової і серцево-судинної систем надзвичайно велика. Взаємний вплив катіонів кальцію, що знаходяться у крові, і калію є одним з найбільш характерних прикладів прояву антагонізму іонів. Якщо іони калію флегматизують скорочення серцевого м'яза, то їхні антагоністи - іони кальцію, збільшують ритм і силу серцевих скорочень. При недоліку в плазмі крові іонів кальцію різко підсилюється збудливість нервової і м'язової систем, порушується нормальне функціонування клітинних ферментів, з'являються судороги, припадки, приступи заціпеніння (тетанія). Важливу роль відіграють іони кальцію в процесах згортання крові Якщо до крові додати 4 %-ний розчин лімонно-кислого натрію, то іони кальцію майже націло осаджуються у вигляді малорозчинного тетрагідрату Цитрату кальцію Са3(С6Н5О7)3.4Н2О. Кров втрачає здатність до згортання. У такому вигляді " нітратну кров " звичайно і використовують при переливанні крові. До неприємних наслідків призводить і надлишок іонів кальцію в плазмі крові (гіперкальціємія), при якій може виникнути гіпокаліємія, підвищене відкладення в організмі кальцієвих солей (ниркові камені, скам'яніння плоду у вагітних, міжтканеві опади тощо). Загальний вміст іонів магнію в організмі дорослої людини складає в середньому 0,028 кг, причому приблизно 0,009 кг знаходяться в складі внутрішньоклітинних і позаклітинних рідин. Добова потреба людини в магнії -0,0007 кг. Основна роль магнію зводиться до стимулювання активності ферментів вуглеводного обміну, а також до зниження збудливості центральної нервової системи. При підвищеному вмісті у крові іонів магнію спостерігаються сонливість, утрата чутливості, параліч кістякових м'язів; при значному збільшенні концентрації іонів магнію (>9 моль/м3) може наступити глибокий наркоз. Магній активно впливає на обмін в організмі калію і кальцію, при його недоліку розвивається гіперкаліємія і зв'язане з цим посилення нервово-м'язової збудливості. Споживання надмірних кількостей з'єднань магнію приводить до поступового витіснення кальцію з кісткової тканини, а дефіцит його в крові - до відкладення важкорозчинних солей кальцію в нирках, м'язах, серці і стінках артерій. У набагато менших концентраціях, ніж іони натрію, калію, кальцію і магнію, у складі рідин людського організму присутні іони ~50 інших елементів, велика частина яких знаходиться у формі комплексних іонів складної будови. Навіть і при таких невеликих концентраціях багато з цих іонів відіграють значну роль у процесах обміну речовин і енергії які безперервно відбуваються в організмі. 3.3 Ступінь та константа дисоціації слабких електролітів. Вивчаючи поведінку розчинів слабких електролітів (таких як СН3СООН, NН4ОН, С6Н5ОН, НСN, Н2О та інших) Оствальд (1888) помітив, що чим менша концентрація розчину (або чим більше розведення), тим стає більша ступінь дисоціації розчиненої речовини. Пояснення цього явища ним було дано на основі електролітичної дисоціації у вигляді закони розведення. Розглянемо на прикладі: СН3СООН + Н2О ↔ СН3СОО- + Н3О+
На основі закону діючих мас:
[СН3СОО-] . [Н3О+] Кдис = -------------------------- [СН3СООН]
Величина Кдис називається термодинамічною константою дисоціації або скорочено константою дисоціації. Виразимо загальну концентрацію електроліта в моль/л через с, а ступінь дисоціації позначимо через α. Тоді концентрація недисоційованої кислоти буде дорівнювати: [СН3СООН] = с (1 – α)
а концентрація продисоційованих іонів:
[СН3СОО-] = сα ; [Н3О+] = сα ;
підставивши, одержуємо закон розбавлення:
α 2 Кдис = -------------- . с; (1 - α)
Визначення ступеня дисоціації електроліту а. λν Обчислюється за формулою α = --------, в якій λν - еквівалентна елек- λ∞ тропровідність розчину при певному розведенні; λ∞ - гранична електропровідність. Еквівалентну електропровідність λν легко визначити експериментальне, а гранична електропровідність λ∞ при нескінченному розведенні розраховується за таблицями (згідно з законом Кольрауша).
Визначення константи дисоціації слабких електролітів. За законом розбавлення Оствальда:
α 2 Кдис = -------------- . с; (1 - α) Підставивши в це рівняння значення α получаємо:
α 2 λν2 . с Кдис = -------------- . с = -----------------; (1 - α) λ∞(λ∞ - λν)
Останнє рівняння безпосередньо зв'язує константу дисоціації Кдис з електропровідністю λν при певному значенні концентрації с. Вимірюючи експериментальне електропровідність λν при певних значеннях с, а також розраховуючи величину λ∞ знаходять константу дисоціації.
3.4 Властивості розчинів сильних електролітів. Теорія розчинів сильних електролітів. С. Арреніус вважав, що і в розчинах сильних електролітів відбувається оборотна дисоціація на іони, оскільки знайдені досвідченим шляхом значення електричної провідності, ізотонічного коефіцієнта, ступеня дисоціації, колігативні властивостей для сильних електролітів виявляється менше, ніж слід було б чекати при 1ОО % - вій дисоціації.
Проте таке трактування Ареніуса виявилося помилковим. Практично повна дисоціація сильних електролітів на іони незалежно від концентрації їх розчинів підтверджується фізичними і фізико-хімічними методами дослідження. Так, значення теплоти нейтралізації всіх сильних кислот сильними підставами в розбавлених розчинах практично однакові. Незалежно від природи кислоти і підстави набувають однакового значення ΔН= - 56,5 кдж/моль. Цей факт - наочний доказ повної дисоціації розбавлених розчинів кислот і основ. У всіх випадках загальним протікаючим при нейтралізації процесом є з'єднання іонів Н3О+ і ОН- в молекулі води:
Н3О+ + ОН- = 2Н2О; ∆Н = - 56,5 кДж/моль.
Інший доказ повної дисоціації сильних електролітів на іони дає рентгеноструктурне дослідження кристалів сильних електролітів типа КС1, яке показало, що ці речовини навіть в твердому вигляді складаються не з молекул, а з позитивно і негативно заряджених іонів, розташованих у вузлах кристалічної решітки. Крім того, дослідження концентрованих розчинів сильних електролітів оптичними методами показало відсутність молекул в цих розчинах. Суперечність, що здається, пояснюється в теорії Дебая і Хюккеля електростатичною міжіоною взаємодією в розчинах. У водних розчинах сильні електроліти практично повністю дисоційовані. І на відміну від розчинів слабких електролітів їх розчини містять значно більше число іонів. У не дуже розбавлених розчинах відстань між іонами мало. Це приводить до сильної міжіоною взаємодії. В результаті біля кожного іона знаходяться переважно іони протилежного знаку: утворюються іонні пари:
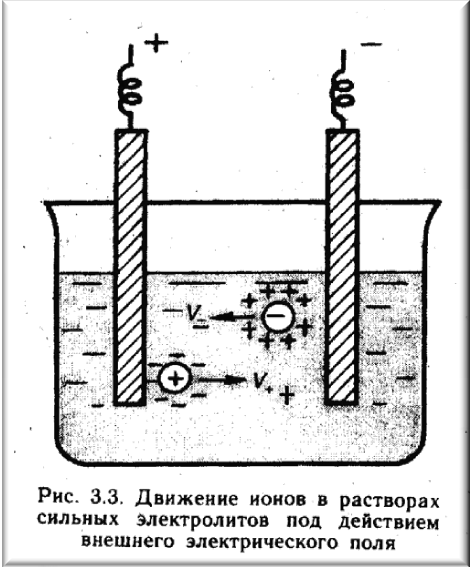
Кt+Аn-, триплети Кt+Аn- Кt+ або Аn- Кt+Аn- і «іонні атмосфери» (мал. 3.2). Як наслідок, виникає ефект зменшення числа іонів, що беруть участь в хімічних процесах. При русі іонів під дією електричного поля іон даного знаку рухається до протилежно зарядженого електроду, а що оточує його «іонна атмосфера» гальмує рух і зменшує рухливість іона (мал. 3.3). Чим більше концентрація розчину, тим сильніше виявляється гальмуюча дія «іонної атмосфери». Крім того, рух іонів гальмується також сольватними оболонками. При розбавленні розчину вплив «іонної атмосфери» зменшується, а при нескінченному розведенні зникає, оскільки іони практично не взаємодіють між собою. В результаті гальмуючої дії «іонних атмосфер» (міжіоні взаємодії) знижується ефективність іонів в таких явищах, як перенесення заряду (електричний струм) в розчинах, пониження температури замерзання, підвищення температури кипіння. Саме тому визначувана, наприклад, по електричній провідності розчинів ступінь дисоціації сильних електролітів є ступенем дисоціації, що здається, оскільки вона не відповідає дійсному ступеню розпаду електроліту на іони.
Таким чином, можна вважати, що у всіх процесах в розчинах електролітів беруть участь лише «активні іони», тобто іони, що не беруть участі в даний момент в міжіоних взаємодіях. У зв'язку з цим для оцінки концентраційних ефектів в розчинах сильних електролітів вводиться величина, звана активністю α:
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 858; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.75.217 (0.012 с.) |



 Зменшення цієї величини із зростанням концентрації розчину пояснюється не рекомбінацією іонів з утворенням молекул, а збільшенням міжіоних взаємодій і утворенням іонних пар Кt+Аn-, триплети Кt+Аn- Кt+ або Аn- Кt+Аn- і інших іонних асоціатів, внаслідок цього збільшується гальмуюча дія «іонних атмосфер», ослабляється дія електричного поля на частинки.
Зменшення цієї величини із зростанням концентрації розчину пояснюється не рекомбінацією іонів з утворенням молекул, а збільшенням міжіоних взаємодій і утворенням іонних пар Кt+Аn-, триплети Кt+Аn- Кt+ або Аn- Кt+Аn- і інших іонних асоціатів, внаслідок цього збільшується гальмуюча дія «іонних атмосфер», ослабляється дія електричного поля на частинки.


