
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Колігативні властивості розведених розчинів неелектролітів і електролітівСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Розчини є способом існування і середовищем протікання всіх біохімічних процесів. Всі фізіологічні рідини - плазма, кров, лімфа, шлункові та кишкові соки є розчинами різних речовин у воді. Розчинами називають гомогенні термодинамічно стійкі системи, що складаються з двох і більше компонентів і продуктів їх взаємодії. Розчинником у розчинах, які обумовлюють земну форму життя є вода. Така поширена і відома всім вода має незвичайні властивості, які обумовлені її будовою. Між атомами Оксигену і Гідрогену зв’язок утворюється при перекриванні гібридних орбіталей атома Оксигену з s- орбіталями атома Гідрогену, зв’язок між ними ковалентний полярний.
Тому іноді молекули води зображують у вигляді диполя Крім того, між молекулами води існують і інші види зв’язків -водневі. Це міжмолекулярні трицентрові зв’язки між частково позитивно зарядженим атомом Гідрогену однієї молекули і негативно зарядженим атомом Оксигену іншої. Тому воду можна розглядати як асоціати, де безперервно відбуваються процеси утворення і розриву зв’язків, що дає змогу зрозуміти велику ступінь рухомості структури рідкої води та її низьку в’язкість. Вода має аномально високі значення температур плавлення і кипіння, що можна пояснити наявністю водневих зв’язків. Вода має велику теплопровідність, що дає змогу рівномірно розподіляти теплоту між тканинами організму. Утворення і руйнування водневих зв’язків пояснює велику теплоємність води, що дозволяє організму звільнятись від надлишку теплоти шляхом її випаровування у вигляді поту. Вода є добрим розчинником для більшості речовин, а її молекули мають тенденцію з’єднуватись з йонами утворюючи гідратовані йони. Такі унікальні властивості води зумовлюють її участь в усіх біологічних процесах, що відбуваються в живому організмі. Властивості розчинів, які не залежать від природи розчиненої речовини, а визначаються кількістю частинок (виражені концентрацією розчину), називають колігативними. Термін колігативні означає "зв’язані між собою". До них відносяться: 1.зниження тиску пари розчинника над розчином; 2.зниження температури замерзання; 3.підвищення температури кипіння розчину; 4.осмотичний тиск розчину. Ці властивості розглядають разом, тому що вони обумовлені спільними причинами. Знання колігативних властивостей розбавлених розчинів дає можливість аналізувати такі явища як дифузія, осмос, тургор, перехід речовин через біологічні мембрани, йонообмін в організмі, гемоліз, мембранна рівновага. Велику роль у життєдіяльності організмів відіграє дифузія. Дифузія – це процес вирівнювання концентрації розчиненої речовини у розчині, зумовлений тепловим рухом частинок розчиненої речовини та розчинника. Як правило дифузія розчиненої речовини відбувається у напрямку з розчину з більшою концентрацією у розчин з меншою концентрацією до вирівнювання концентрацій. Здатність речовини до дифузії визначається коефіцієнтом дифузії D, який кількісно дорівнює кількості речовини, що дифундує за одиницю часу крізь одиницю площі при градієнті концентрацій, що дорівнює одиниці. D - є кількісною мірою дифузії в стандартних умовах. Для розчинів, в яких характерні процеси дифузії можна застосувати закон, встановлений А.Фіком (1855). Закон Фіка – маса (m) розчиненої речовини, що дифундує через переріз площею S в інший шар за проміжок часу (Δτ) пропорційна зміні концентрації Δ С на відрізку Δ X.
З дифузією пов’язаний процес переносу поживних речовин та продуктів обміну в живих організмах. Дифузія відбувається тоді, коли на межі між розчином та чистим розчинником помістити напівпроникну перегородку - мембрану, яка має здатність пропускати молекули розчинника або молекули жиру. В цьому випадку маємо справу з односторонньою дифузією. Прикладом такої дифузії є процес газового обміну в легенях. Внаслідок різниці тиску СО2 і О2 венозної крові і повітря в легенях вуглекислий газ виділяється, а кисень поглинається кров’ю. Очевидно процес відбувається за участю легеневих та венозних діафрагм. Розчинність газів в розчинах відрізняється від розчинності в чистому розчиннику. Зменшення розчинності газу в розчині солі було виявлено російським вченим фізіологом М.М.Сєченовим, який встановив співвідношення, що виражає вплив концентрації електроліту в розчині на розчинність газів,і виражається залежністю: S=Soe-KC де So - розчинність даного газу в чистій воді; S - розчинність його в розчині електроліту, концентрацією С (в моль/л) за тієї ж температури; e - основа натурального логарифму; K - емпірична константа, що залежить від природи газу, електроліту та температури. Закон Сеченова можна сформулювати так, що розчинність газів тим менша в порівнянні з розчинністю в чистій воді чим більша концентрація розчинених в ній солей. В логарифмічному вигляді:
Залежність розчинності від тиску визначається законом Генрі. Розчинність газу в рідині за сталої температури прямо пропорційна його тиску над рідиною: Ср= К*Р, де Ср - концентрація газу в розчині; Р - тиск газу над розчином; К - коефіцієнт пропорційності, що залежить від природи газу, розчинника та температури, але не залежить від тиску. Зміна розчинності газів під впливом тиску здатна викликати важку патологію людського організму. Різке зниження атмосферного тиску, наприклад, при швидкому піднятті водолазів з великих глибин, при розгерметизації кабін або скафандрів при висотних польотах, проводить до "закипання" крові внаслідок виділення розчинених в ній газів. Їх пухирці закупорюють дрібні судини мозку та інших частин організму, що може привести до серйозних захворювань (кесонна хвороба) та загибелі людини. Для лікування такого хворого поміщають в барокамеру, де створюють великий тиск. Пухирці газів знову розчиняються в крові. При послідуючому повільному зниженні тиску в барокамері (протягом декількох діб) надлишок газів виділяється з крові людини через легені. На основі даних законів розроблені методи, що дозволяють покращити забезпечення тканин киснем при деяких видах анемії, легеневій недостатності, серцево-судинних та інших захворюваннях. Хворих поміщають в палати з підвищеним вмістом кисню в повітрі. Цей метод особливо ефективний при лікуванні газової гангрени, тобто при боротьбі з анаеробними мікробами, що розмножуються в безкисневих умовах глибоких ран та відмерлих тканин. ОСМОС. Якщо два розчини різної концентрації розділити напівпроникною перегородкою яка пропускає молекули розчинника і не пропускає молекули чи йони розчиненої речовини, то пройде тільки одне направлене переміщення розчинника із розчину меншої концентрації в розчин більшої концентрації. Таке явище називається осмосом. Осмос протікає проти градієнту концентрації. Тиск, який треба прикласти до розчину, щоб зупинити осмос, називається осмотичнимтиском. Осмос має складний механізм і залежить від: 1) розчинності молекул розчинника в матеріалі мембрани; 2) від взаємодії мембрани з розчинником; 3) розміру отворів у мембрані, яка є пористою перегородкою з певним розміром пор і поводить себе як молекулярне сито. Мембрани діляться на три групи: 1) природні - тканини тваринних і рослинних організмів 2) штучно виготовлені органічні мембрани (колодій і желатина) 3) штучно виготовлені неорганічні мембрани (керамічні) Прилади для вимірювання осмотичного тиску називають осмометрами. Найпростіший осмометр - це посудина з напівпроникним дном, яку заповнюють розчином, і занурюють у чистий розчинник. В результаті осмосу об’єм розчину буде поступово збільшуватись і це приведе до збільшення гідростатичного тиску, що протидіятиме подальшому переходу води в посудину. Згодом встановлюється динамічна рівновага і осмос припиняється. Кількісно величину осмотичного тиску характеризує закон Вант-Гоффа (1886р.): осмотичний тиск розчину прямо пропорційний молярній концентрації і абсолютній температурі розчину. π= CRT або Експериментально визначивши осмотичний тиск розчину можна визначити молярну масу речовини. Такий метод називається осмометрією і використовують для визначення молярної маси білків, полісахаридів і інших речовин. Явище осмосу має надзвичайно велике значення для біологічних систем. Кров, лімфа, а також усі тканинні рідини живих організмів є водними розчинами багатьох органічних та мінеральних речовин, низько- та високомолекулярних електролітів та неелектролітів. Ці розчини мають певний осмотичний тиск. Осмотичний тиск крові людини досить постійний. При 37 °С (310 К) він досягає значної величини 7,4 – 7,7 атм, або 740-780 кПа, що зумовлено електролітним складом крові, зокрема вмістом натрію хлориду. Високомолекулярні сполуки, переважно білки (альбуміни, глобуліни) становлять 0.5% загального тиску крові. Частину осмотичного тиску, обумовлену білками крові називають онкотичним тиском, величина якого сягає 3,5 – 3,9 кПа. Онкотичний тиск має важлива значення для життєдіяльності організму. При зниженні вмісту білку в крові (гіпопротоглікемія, голодування, порушення діяльності травного тракту, втрата білка з сечею при захворюванні нирок) викликає різницю в онкотичному тиску у тканинах, рідинах та крові. Вода прямує в бік більш високого тиску - у тканини. При цьому виникають так звані онкотичні набряки підшкірної клітковини ("голодні" та "ниркові" набряки). Організм людини здатний підтримувати осмотичний тиск на постійному рівні. При зміні осмотичного тиску організм прагне повернути його до норми. Так, якщо з їжею в організм вводиться велика кількість розчинних речовин (сіль, цукор), осмотичний тиск змінюється, на що організм зразу ж реагує: змінюється кількість та склад слини, поту, сечі та кількість пари, що виділяється. При патологічних явищах у тканинах організму осмотичний тиск може значно коливатись і в осередку запалення у 2-3 рази перевищує норму. Осмотичному тиску крові людини відповідає осмомолярна концентрація розчинених в плазмі речовин, яка становить 0,287-0,303 моль/л. Розчини з осмотичним тиском, що дорівнює осмотичному тиску розчину, прийнятого за стандарт називають ізотонічним розчином. Розчини з осмотичним тиском вищим за стандарт, називають гіпертонічним, а нижчим - гіпотонічним. В медичній практиці ізотонічними називають розчини з осмотичним тиском, що дорівнює осмотичному тиску плазми крові. Таким розчином є 0,85% розчином хлориду натрію (0,146 моль/л). Ізотонічним розчином є також розчин глюкози 4,5 - 5% (0,3 моль/л). Ізотонічні розчини можна вводити в організм людини в великих кількостях. Такі розчини вводять хворим після операцій для компенсації втрат крові. Гіпертонічні розчини вводять в організм людини тільки в невеликих кількостях. При введенні великої кількості гіпертонічного розчину еритроцити втрачають воду, різко зменшуються в об’ємі та зморщуються. Це явище називається плазмолізом. В хірургії гіпертонічні розчини широко використовуються як зовнішні для змочування марлевих пов’язок, що вводять у гнійні рани. Згідно з законом осмосу рідина з рани прямує по марлі назовні, що сприяє очищенню рани від гною, мікроорганізмів, продуктів розкладу, тощо. Гіпертонічні розчини деяких солей (МgSO4, Nа2SO4), які погано всмоктуються шлунково-кишковим трактом використовуються як послаблююче. Це пояснюється тим, що внаслідок осмосу відбувається перехід великої кількості води із слизової оболонки в просвіт кишечника. Гіпотонічні розчини внутрішньовенно не вводять. Це зумовлено тим, що в гіпотонічному розчині осмос в еритроциті йде в зворотному напрямку (ендоосмос). Молекули води переходять всередину еритроцитів внаслідок чого вони збільшуються в об’ємі і руйнуються. Таке явище називають гемолізом. Початкова стадія гемолізу настає при зниженні осмотичного тиску у плазмі до 400-360 кПа, а повний гемоліз - при зниженні тиску до 260-300 кПа. Однією із колігативних властивостей розчинів є зниження тиску пари розчинника над розчином. Температура кипіння рідини - така температура, при якій тиск насиченої пари над рідиною дорівнює зовнішньому. Температура замерзання (кристалізації) рідини - така температура, при якій тиск насиченої пари над рідиною дорівнює тиску над випадаючими з неї кристалами твердої фази розчинника. Особливістю розбавлених розчинів нелетких речовин є те, що тиск пари над розчином завжди нижчий від тиску пари чистого розчинника, тому температура кипіння розчину підвищується, а температура кристалізації знижується. Кількісно це явище підпорядковується першому закону Рауля (1887р.): Тиск пари розчинника над розведеним розчином нелеткої речовини прямо пропорційний концентрації розчинника у розчині p=po.x1 Якщо ж тиск зв’язати із концентрацією розчиненої речовини (х2), то цей закон можна сформулювати так: зниження тиску пари розчинника над розчином прямо пропорційне концентрації розчиненої речовини: Δp=po x2 де po - тиск насиченої пари над чистим розчинником; х1 - мольна доля розчинника; x2 - мольна доля розчиненої речовини. Відносне пониження тиску пари розчинника над розчином дорівнює мольній долі розчиненої речовини. Із першого закону Рауля випливає другий закон: пониження температури замерзання та підвищення температури кипіння розведених розчинів неелектролітів прямо пропорційна моляльній концентрації Δtкип.=Е.ВХ, К – кріоскопічна постійна Е – ебуліоскопічна постійна Δtзам.=t зам.розчинника – t зам. розчину Δtкип.=t к ип.роз-ну - t кип.розчинника Величину Δ t зам називають депресією (пониженням) температури замерзання. Фізичний зміст кріоскопічної сталої К - величина пониження температури замерзання розчину, що містить 1 моль розчиненої речовини (неелектроліту) у 1 кілограмі розчинника. Тобто якщо Вх =1 моль /1 кг розчинника, то Δtзам. = К Величини кріоскопічних сталих для різних розчинників можуть мати різне значення. Для води величина К=1,86 °С/моль*кг. Біологічні системи, які є водними розчинами мають температуру замерзання нижчу за 0 °С. За величиною депресії температури замерзання деяких біологічних рідин можна визначити вміст у них різних речовин:
Фізичний зміст ебуліоскопічної постійної - величина зростання температури кипіння розчину, що містить 1 моль розчиненої речовини (неелектроліту) в 1 кг розчинника. Для води вона становить Е=0,516°С/моль*кг. Вимірюючи температуру замерзання чи температуру кипіння розчину можна визначити молярну масу розчиненої речовини:
де mx - маса розчиненої речовини в г;
Отже, приготувавши розчин з певної наважки розчиненої речовини і води і визначивши експериментально різницю в температурах замерзання чистого розчинника і розчину можна визначити молярну масу розчиненої речовини.
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 952; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.113 (0.012 с.) |

 Молекула води є полярною через здатність більш електронегативного атома Оксигену відтягувати на себе електронну густину від атомів Гідрогену.
Молекула води є полярною через здатність більш електронегативного атома Оксигену відтягувати на себе електронну густину від атомів Гідрогену. .
.
 - градієнт концентрації в напрямку переносу розчиненої речовини.
- градієнт концентрації в напрямку переносу розчиненої речовини.
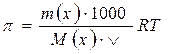

 розчиненої речовини: Δtзам.=К.Вх, де
розчиненої речовини: Δtзам.=К.Вх, де  моль/кг
моль/кг звідки
звідки 
 - маса води, кг.
- маса води, кг.


