
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Електрокінетичні властивості колоїдних системСодержание книги
Поиск на нашем сайте Властивості диспергованих колоїдних розчинів визначаються тим, що завдяки адсорбції йонів електролітів на поверхні колоїдних частинок вони набувають певного заряду, знак якого визначається законом адсорбованих частинок, а величина їх кількістю. Навколо зарядженої частинки розташовані йони з протилежним зарядом, оточені молекулами розчинника. При пропусканні постійного електричного струму через шматок глини в якій були поміщені дві скляні трубки заповненні водою, а на дні трубок поміщений пісок, переміщався до аноду, а біля катоду рівень води зростав. Цей дослід поставлений Рейсом показав, що частинки глини зарядженні негативно. Рух частинок під дією зовнішнього електричного поля називається електрофорезом, а рух рідини через пористе тверде тіло – електроосмосом. Електрофорез застосовується в клінічних лабораторіях з метою діагностики, а також при оцінці клітинного імунітету в онкологічних хворих. Вивчення електрокінетичних властивостей мікро гетерогенних систем вказує, що на їх поверхні міститься подвійний електричний шар (ПЕШ). Будова ПЕШ згідно з теорією Гельмгольца-Перрена має будову, представлену на
Запропонована Гельмгольцем будова ПЕШ можлива лише при відсутності теплового руху йонів. У реальних умовах розподіл зарядів на межі фаз у першому наближенні визначається співвідношенням сил електростатичного притягання йонів і теплового руху йонів, які прагнуть рівномірно розподілятися у всьому об’ємі рідкої або газоподібної фази. Враховуючи це, Г. Гуі і Д. Чепмен запропонували свою модель ПЕШ, яка пропускає, що подвійний електричний шар має розпушену (дифузійну) будову і всі протийони знаходяться у його дифузійній частині (рис. 8.2 б). Сучасна теорія будови ПЕШ – узагальнююча теорія Штерна. Аналізуючи недоліки попередніх теорій, Штерн припустив, що ПЕШ складається з двох частин: внутрішньої – адсорбційний шар і зовнішньої – дифузійний шар Гуі. Внутрішню частину ПЕШ, яка знаходиться безпосередньо біля міжфазової поверхні, Штерн уявляв як адсорбційний моноіонний шар, товщиною не менше двох радіусів йонів. За сучасними уявленнями будова подвійного електричного шару визначається двома протилежними силами – електростатичними та дифузійними. В результаті взаємодії даних сил протийони утворюють два шари – адсорбційний (нерухомий) в якому йони міцно утримуються електростатичними силами на поверхні твердого тіла, та рухомий шар, в межах якого завдяки тепловому руху Йони вільно пересуваються. При цьому межі адсорбційного шару виникає різниця потенціалів, яка називається електрокінетичним або ξ (дзета потенціалом). Електрокінетичний потенціал – це різниця потенціалів між нерухомим адсорбційним шаром, зв’язаним із поверхнею твердої фази, та рухомою масою рідини. Він є частиною термодинамічного потенціалу. ξ =ε - ε1 Де ε1 – падіння потенціалу в нерухомому шарі, яке викликають адсорбовані в ньому йони. Визначається за формулою: ξ = D – діалектрична стала розчинника; H – градієнт потенціалу; V – середня швидкість; η – в’язкість розчину. Агргативна стійкість – це здатність протидіяти злипанню, яке відбувається внаслідок зменшення поверхні поділу фаз. Коагуляція – це процес злипання частинок дисперсної фази при втраті системою агрегативної стійкості. Це процес термодинамічно вигідний ∆ G <0. Викликати коагуляцію можуть різні фактори: різка зміна температури, інтенсивна механічна дія, дія світла, випромінювання. Та найбільшим фактором є дія електролітів. Електроліти дуже швидко і різко впливають на товщину подвійного електричного шару і на величину ξ – потенціалу, який є одним із головних факторів стійкості колоїдних систем. Коагуляція відбувається при певній кількості електроліту. Мінімальна молярна концентрація, яка викликає коагуляцію колоїдного розчину називається (СК) – критичною концентрацією або порогом коагуляції. Це значення є критерієм стійкості. Величина обернена порогу коагуляції називають коагулюючою здатністю VK:
Коагулююча здатність показує об’єм золю скоагульованого 1 молем йона-коагулятора. Початок коагуляції може бути визначений по різних ознаках - зміні забарвлення золя, появі каламуті, початку виділення дисперсної фази в осад і т.д. Поява цих ознак не завжди збігається в часі. Крім того, поріг коагуляції певною мірою залежить від концентрації золя. Тому поріг коагуляції є досить відносною характеристикою стійкості золя стосовно даного електроліту. Експериментально встановлено 2 емпіричні правила. Перше встановив Г. Шульце (1882 р.) і друге – М. Гарді (1900 р.) За правилом Гарді (правило значності) коагулюючу дію має не вся молекула електроліту, а лише той йон, який має заряд протилежний заряду гранули. За правилом Шульце (правило валентності) коагулююча дія йона коагулятора тим більша, чим вища його валентність. Згідно правила Шульце-Гарді критична концентрація йона-коагулятора зменшується із збільшення його валентності. Для двовалентних йонів поріг коагуляції в десятки раз, а для трьох валентних в сотні раз менший, ніж для одновалентних
Це тільки для неорганічних йонів бо органічні такі великі, і мають сильнішу коагулюючу дію. Для побудови строгої теорії коагуляції треба було визначити кількісну міру коагуляції. Такою мірою є швидкість коагуляції:
Існують багато теорій стійкості колоїдних частинок. Сучасна теорія – об’єднана теорія Б. Дерягіна, Л. Ландау (1937), Е. Фервей, Я.Овербек (1941) (ДЛФО) розглядає процес коагуляції як результат спільної дії молекулярної енергії притягання та електростатичної теорії відштовхування. Згідно цієї теорії можна теоретично розрахувати ck не проводячи експериментальних дослідів. Результатом врахування всіх сил взаємодії можна одержати вираз порогу коагуляції:
де z – валентність йону коагулятора. Якщо для одновалентного йону коагулятора ck = 1, то
Теоретичні розрахунки уточнюються з експериментальними даними. Знаючи процес коагуляції можна провести захист від цього явища, який називають колоїдним захистом. Це має важливе значення для біології та фармації. Так білки крові захищають краплинки холестерину та інших гідрофобних речовин від коагуляції. При деяких захворюваннях вміст захисних білків зменшується, що приводить до відкладання холестерину на стінках судин, утворення камінців у нирках та печінці. Явице колоїдного захусту використовують для одержання медичних бактерицидних препаратів. Чим вищий заряд йона, тим вище його коагуляційна дія РАІ3+ > РСа2+ > РК+ Відповідно для порогу коагуляції можна записати: CK+ > CCa2+ > CAI3+ Тобто, чим нижчий заряд йона, тим при більшій концентрації електроліту буде відбуватися коагуляція. Такі ж ліотропні ряди можна записати і для аніонів:
Для йонів одного заряду коагулююча здатність залежить від радіуса сольватованого йона: чим більше радіус, тим менша його коагулятивна дія. Наприклад, для катіонів лужних металів можна записати наступний ліотропний ряд:
Для аніонів:
Коагуляційна здатність багатьох органічних речовин набагато вища, ніж неорганічних. Це зв'язано з їх високою адсорбційною здатністю. Такою властивістю володіють багато алкалоїдів, барвники, а також йони гідроксонію і гідроксид-йони. Коагуляція багатьох ліофобних золів настає раніше, ніж досягається їх ізоелектричний стан. Дзета-потенціал, при якому починається явна коагуляція, називається критичним, його величина складає ± 30 мВ. Явища, що супроводжують коагуляцію. При коагуляції часто спостерігаються особливі явища: антагонізм і синергізм йонів, явище “неправильних рядів”, “звикання” золів до дії електролітів і т.д. При коагуляції сумішами електролітів можуть спостерігатися три випадки: 1) адитивність - коагулятивна дія електролітів у суміші дорівнює сумі коагулятивної дії кожного електроліту. Таке явище спостерігається відносно рідко, коли йони-коагулянти мають однаковий заряд і близькі за ступем гідратації; 2) антагонізм - коагулятивна дія йонів у суміші стає менша, ніж їх дія окремо; 3) синергізм - коагулятивна дія йонів у суміші підвищується. Пороги коагуляції знижуються в обох іонів. Розглянуті явища дуже складні, тому що є результатом взаємодії йонів з колоїдними частинками, з розчинником і один з одним.
|
|||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 821; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.007 с.) |

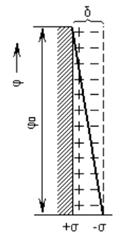 а) Будова ПЕШ за Гельмгольцем-Перреном
а) Будова ПЕШ за Гельмгольцем-Перреном
 б) Будова ПЕШ за
Гуї-Чепменом
б) Будова ПЕШ за
Гуї-Чепменом
 в) Будова ПЕШ за
Штерном
в) Будова ПЕШ за
Штерном



 - зміна числа частинок за одиницю часу t.
- зміна числа частинок за одиницю часу t.







