
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дослідження реакційної здатності гетерофункціональних сполук. АмінокислотиСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
До гетерофункціональних карбонових кислотналежать похідні карбонових кислот, у вуглеводневому радикалі яких один або декілька атомів Гідрогену заміщені на інші атоми або групи атомів, наприклад, на галоген, гідроксогрупу, аміногрупу тощо. Гідроксокислоти. Гідроксокислотами називаються похідні карбонових кислот, які містять у вуглеводневому радикалі одну або кілька гідроксильних груп. Залежно від природи вуглеводневого радикала розрізняють аліфатичні гідроксикислоти (спиртокислоти) і ароматичні (фенолокислоти). Аліфатичні гідроксикислоти за взаємним розміщенням карбоксильної та гідроксильної груп поділяють на α-, β-, γ- та ін.
НОМЕНКЛАТУРА У номенклатурі гідроксикислот широко застосовують тривіальні назви. За замісниковою номенклатурою IUРАС як родоначальну беруть тривіальну або систематичну назву карбонової кислоти. Гідроксильна група позначається префіксом гідрокси- (гідроксі-). При використанні тривіальної назви родоначальної структури положення гідроксильної групи у вуглеводневому ланцюзі позначають літерами грецького алфавіту α-, β-, γ та іншими, а при вживанні систематичної назви родоначальної структури положення ОН-групи вказують цифровими локантами. Хімічні властивості. Реакційна здатність гідроксикислот зумовлена наявністю в їх структурі двох функціональних груп — карбоксильної та гідроксильної. По карбоксильній групі гідроксикислоти дають усі реакції, властиві карбоновим кислотам. Зокрема, вони утворюють солі, естери, галогенангідриди, аміди. 1. Так, при дії на гідроксикислоти галоге- нуючих реагентів (РСl5 та ін.) утворюються галогенангідриди галогенокарбонових кислот:
2. При взаємодії зі спиртами у присутності концентрованої Н2SO4 гідроксикислоти спочатку перетворюються на естери, а потім можуть утворюватись і етери по гідроксильній групі.
З участю гідроксильної групи аліфатичні гідроксикислоти вступають у реакції, характерні для спиртів.
Відношення до нагрівання. α-Гідроксикислоти при нагріванні зазнають міжмолекулярної дегідратації та утворюють циклічні естери — лактиди:
β-Гідроксикислоти при нагріванні зазнають внутрішньомолекулярної дегідратації з утворенням а,р-ненасичених кислот:
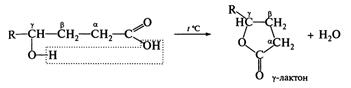
γ та δ-Гідроксикислоти вже при кімнатній температурі або незначному нагріванні зазнають внутрішньомолекулярної дегідратації з утворенням циклічних естерів — лактонів:
Найважливіші представники гідроксикислот. Молочна кислота (α-гідроксипропіонова кислота). Уперше її було виділено з кислого молока. Молочна кислота утворюється внаслідок молочнокислого бродіння вуглеводів:
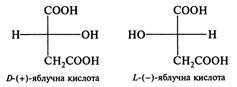
Міститься в кислому молоці, кефірі, мочених яблуках, квашеній капусті, різних соліннях тощо. Яблучна кислота (гідроксіянтарна кислота) НООСС*Н(ОН)СН2СООН.
У природі зустрічається L-(-)-яблучна кислота. Вона міститься в недостиглих яблуках, ягодах горобини, клюкви, малини, барбарису тощо. У промисловості широко застосовується L-(-)-яблучна кислота — у виробництві вина, фруктових вод та кондитерських виробів, а також у синтезі лікарських засобів. Винна кислота (α,α' дигідроксибурштинова кислота).
У природі зустрічається тільки D-(+)-винна кислота; особливо багато у винограді, який є вихідною сировиною для її добування. Винна кислота утворює кислі та середні солі. Кислі солі називаються гідротартратами, середні — тартратами. Калієво-натрієва сіль винної кислоти називається сегнетовою сіллю:
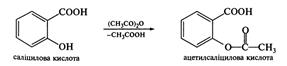
При взаємодії з купрум (II) гідроксидом у лужному середовищі сегнетова сіль утворює комплекс яскраво-синього кольору, який дістав назву реактив Фелінга, що застосовується для якісного визначення альдегідної групи. Саліцилова кислота (о-гідроксибензойна кислота). Саліцилова кислота застосовується в медицині у вигляді спиртових розчинів і мазей як антисептичний лікарський засіб. Вона також є сировиною для синтезу інших лікарських засобів, таких, як натрій саліцилат, метилсаліцилат, фенілсаліцилат (салол), саліциламід, ацетилсаліцилова кислота (аспірин).
Аспірин застосовують у медицині як жарознижувальний засіб. Амінокислоти Амінокислоти — карбонові кислоти, що містять у своєму складі одну або кілька аміногруп. Вони належать до поліфункціональних органічних сполук. За характером будови вуглеводневого залишку розрізняють аліфатичні, ароматичні, гетероциклічні амінокислоти. Ізомерія в ряді амінокислот пов'язана як з ізомерією карбонового ланцюга, так і з положенням аміногрупи відносно карбоксильної. Серед амінокислот найважливішими є α-амінокислоти, оскільки вони є структурними елементами, з яких побудовані білки. До складу природних амінокислот можуть входити карбоксильні, аміно-, гідрокси-, тіольні —SН групи. Вісім амінокислот — лізин, треонін, триптофан, метіонін, лейцин, ізолейцин, валін та фенілаланін — є незамінними амінокислотами, тобто такими, які організм людини не синтезує сам, а має одержувати з їжею. Загальна формула:
Залежно від взаємного розташування карбоксильної і аміногруп розрізняють α-, β-, γ- і т.д. амінокислоти.
На сьогодні існує 200 амінокислот, проте лише 20 входять до складу білків, їх називають основними (потеїногенними). Класифікація амінокислот. 1) за кислотно-лужними властивостями амінокислоти поділяють на: - неполярні: пролін, валін, аланін, триптофан, фенілаланін, ізолейцин, метіонін, лейцин; - полярні: гліцин, цистеїн, аспарагін, глутамін, треонін, серин, тирозин; - кислотні: глутамінова та аспарагінова кислоти; - основні: гістидин, лізин, аргінін. 2) за біологічним значенням розрізняють: - незамінні: валін, ізолейцин, лейцин, треонін, лізин, метіонін, триптофан, фенілаланін (у дітей незамінними є гістидин та аланін) – тобто такими, які організм людини не синтезує сам, а має одержувати з їжею; - напівзамінні: аргінін, гістидин, тирозин (частково синтезуються). - замінні: глутамінова кислота, аспарагінова кислота, аланін, глутамін, гліцин, аспарагін, пролін, серин, цистеїн. 3) залежно від природи радикала (R) – амінокислоти діляться на аліфатичні, ароматичні та гетероциклічні: Класифікація α-амінокислот
Ізомерія · вуглецевого скелету · положенням функціональних груп, · для α-амінокислот характерна оптична (дзеркальна) ізомерія. Всі α-амінокислоти, крім гліцину, оптично активні. Наприклад, аланін має один асиметричний (хіральний) атом вуглецю (відзначений зірочкою). Асиметричний атом – це атом карбону, який з’єднаниний з чотирма різними замісниками.
тобто, існує у вигляді оптично активних енантіомерів:
Всі природні α-амінокислоти відносяться до L– ряду. Фізичні властивості Амінокислоти є безбарвними кристалічними речовиновинами, легко розчинними у воді, гірше — в органічних розчинниках. Деякі з них є солодкими на смак. Температури плавлення амінокислот як цвіттер-йонів є досить високими, деякі з них плавляться з розкладом. Природні α-амінокислоти (крім гліцину) є оптично активними речовинами Одержання амінокислот Найбільш важливими є способи одержання амінокислот з галогенкарбонових кислот. Синтез відбувається в 2 стадії:
Хімічні властивості 1) Кислотна (–COOH) і основна (–NH2) групи в молекулі амінокислоти взаємодіють одна з одною, утворюючи внутрішні солі (біполярні йони). Положення рівноваги залежить від pH середовища. В ізоелектричній точці (ІЕТ), коли концентрація катіонів та аніонів рівні, конценотрація біполярного іона максимальна і рух його в електричному полі не відбувається. Наприклад, для гліцину
2) α-амінокислоти є амфотерними сполуками · утворюють солі з лугами (pеакція заміщення):
натрієва сіль гліцину · утворюють солі з кислотами (реакція приєднання)
3) α -Амінокислоти вступають одна з одною в реакцію поліконденсації (реакція між СООН групою першої кислоти і NH2 групою другої кислоти). Продукти такої конденсації називаються ПЕПТИДАМИ. При взаємодії двох амінокислот утворюється дипептид:
При конденсації трьох амінокислот утворюється трипептид і т.д.
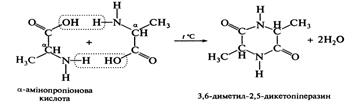
Загальнi хiмiчнi властивостi амiнокислот визначаються реакцiйною здатнiстю їх рiзних функцiональних груп: За карбоксильною групою вони утворюють солi, складнi ефіри, ангiдриди, галогенангiдриди, амiди кислот. У реакцiях декарбоксилування утворюються спирти з гiдроксикислот та амiни з амiнокислот. За групою –NН2 вiдбуваються реакцiї ацилування, алкiлулування, дезамiнування. Відношення до нагрівання. 1. При нагріванні α-амінокислот, відбувається міжмолекулярне дезамінування і утворюється дикетопіперазин.
2. b-амінокислоти відщеплюють амоніак і дають амонійну сіль ненасиченої кислоти. Причиною такої реакції є рухливість водневих атомів в сусідстві з карбоксильною групою:
3. g-,d-амінокислоти уворюють при нагріванні внутрішні аміди -лактами
Пептиди. Білки
Умовно вважають, що пептиди містять в молекулі до 100 (відповідає молекулярній масі до 10000), а білки – понад 100 амінокислотних залишків (молекулярна маса від 10000 до декілька мільйонів). Склад і будова молекули Усі білки містять Карбон, Гідроген, Оксиген і Нітроген. Більшість білків містять ще і Сульфур, деякі і Фосфор. До складу гемоглобіну входить Ферум, до білку щитовидної залози – Йод. Молекулярна маса білків – до кількох мільйонів. Поширення в природі Найважливіша складова частина живих організмів, білки входять до складу шкіри, рогових покривів, м’язової та нервової тканин. Вміст білків: В м’язах людини – 80% В шкірі – 63% В печінці – 57% В мозок – 45% В кістках – 28% Елементарний склад білків
С – 50 – 54% Н – 6,5 – 7,3% О – 21,5 – 23,5% N – 15 – 17% S – 0,3 – 2,5% P, J, Fe, Si, Cu і т.д. мікроелементи Білкова молекула – поліпептид містить від 2 до 100 амінокислотних залишків. Для білків (протеїнів) характерні чотири рівні просторової організації, які прийнято називати первинною, вторинною, третинною і четвертинною структурами.
- Третинна структура білка - тривимірна конфігурація закрученої спіралі в просторі. Утворена за рахунок зв’язків: дисульфідних –S–S–, йонних та гідрофобних.
- Четвертинна структура білка - структура, що утворюється за рахунок взаємодії між різними поліпептидними ланцюгами. Четвертинна структура характерна лише для деяких білків, наприклад гемоглобіну Хімічні властивості 1) ДЕНАТУРАЦІЯ – це втрата білком природної конформації, що супроводжується звично втратою його біологічної функції. Тобто – це руйнування вторинної і третинної структур білка, зумовлене дією кислот, лугів, нагрівання, радіації і т.д. Первинна структура білка при денатурації зберігається. Денатурація може бути оборотною (так звана, ренатурація) і необоротною. Приклад необоротної денатурації при тепловій дії – згортання яєчного альбуміну при варінні яєць.
2) ГІДРОЛІЗ БІЛКІВ – руйнування первинної структури білка під дією кислот, лугів або ферментів, що приводить до утворення α-амінокислот, з яких він був побудований.
þ 3) Якісні реакції на білки: · Біуретова реакція – фіолетове забарвлення при дії солей купруму (II) в лужному розчині. Таку реакцію дають всі сполуки, що містять пептидний зв'язок. · б) Ксантопротеїнова реакція – поява жовтого забарвлення при дії концентрованої нітратної кислоти на білки, що містять залишки ароматичних амінокислот (фенілаланіну, тирозину). Заняття 28
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 604; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.238.1 (0.01 с.) |



























 біполярний йон
біполярний йон





 .– α- спіраль
.– α- спіраль  - β – спіраль.
- β – спіраль.




