
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кінцеві продукти розпаду амінокислотСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
В результаті різних перетворень амінокислот у тканинах організму утворюються аміак, вуглекислий газ і вода. Після дезамінування а-амінокислот утворюються безазотисті сполуки. Ми вже знаємо, що в основному це а-кетокислоти, які на певних ділянках включаються в цикл трикарбонових кислот, де піддаються дегідруванню і декарбоксилюванню, і зрештою перетворюються в Н2О і СО2. Деякі кетокислоти, зазнаючи окиснювального декарбоксилювання, утворюють кислоти з різною хімічною структурою, залежно від якої в одних випадках вони окиснюються шляхом р-окиснення, в інших - шляхом перетворення вуглеводів. Проте й у цих випадках врешті-решт утворюються СО2 і Н2О. Вуглекислий газ частково виводиться з організму, частина, що залишилася, використовується для синтетичних процесів, наприклад, для синтезу вищих жирних кислот, пуринових основ та ін. Обмін аміаку. Основним джерелом аміаку в організмі є амінокислоти. Аміак - дуже токсична речовина. Навіть незначне збільшення його кількості в крові викликає отруєння організму, особливо нервової системи. Щодоби в організмі людини дезамінується 100-120 г амінокислот, що відповідає приблизно 18-23,6 г аміаку. Проте, незважаючи на постійне утворення аміаку в тканинах і надходження в його кров, концентрація його в крові незначна. Навіть у капілярах нирок, де кількість аміаку найбільша, його концентрація в нормі не перевищує 1 мг%. У ході еволюції в людини виробилися спеціальні механізми для його знешкодження. До них належить утворення глутаміну, аспарагіну, амідів білків, відновне амінування, нейтралізація кислот, синтез сечовини. Одним із найважливіших механізмів знешкодження аміаку є утворення глутаміну й аспарагіну. Синтез цих амідів має для організму велике значення, оскільки відбувається в місцях безпосереднього утворення аміаку: у печінці, мозку, нирках, сітківці ока, м'язах. Глутамінова й аспарагінова кислоти. які завжди знаходяться в тканинах у вільному стані, зв'язують аміак шляхом реакції амідування. У результаті з глутамінової кислоти утворюється глутамін, з аспарагінової – аспарагін. Ці реакції відбуваються за допомогою ферментів глутамін- і аспарагінсинтетаз:
і Знешкоджений таким шляхом аміак може бути використаний організмом як джерело азоту, наприклад, для синтезу пуринових і піримідинових основ, глікозамінгліканів і т.д. У тканинах людини існує ще один ферментативний механізм знешкодження аміаку - зв'язування його шляхом амідування карбоксильних груп білків тканин. Амідування білків зумовлене наявністю в їх складі вільних карбоксильних груп глутамінової й аспарагінової кислот. Частина аміаку знешкоджується шляхом реакцій відновного амінування - процесу, протилежного дезамінуванню, що забезпечує зв'язування аміаку кетокислотами з утворенням відповідних амінокислот. Основна роль у цьому належить а-кетоглу-таровій кислоті. Невелика кількість аміаку використовується для нейтралізації неорганічних і органічних кислот, у результаті чого утворюються амонійні солі. Цей процес знешкодження аміаку має місце тільки в нирках. Основний же шлях знешкодження аміаку пов'язаний з утворенням сечовини. Синтез сечовини є основним шляхом детоксикації аміаку в ссавців і головною формою виділення білкового азоту з організму. Сечовина, що являє собою нейтральну сполуку, розчинну у воді, виводиться з організму із сечею. На частку азоту сечовини припадає від 80 до 85% загальної кількості азотистих речовин сечі. Вперше схему синтезу сечовини запропонував М.В. Ненцький. Він довів, що синтез цієї сполуки відбувається за рахунок двох молекул аміаку й однієї молекули вуглекислого газу. За допомогою спеціальних дослідів І.В. Залеський і С.С. Салазкін установили, що основним органом, де відбуваються знешкодження аміаку і синтез сечовини, є печінка. Утворення сечовини відбувається за участю ряду ферментів І речовин за певним циклом, існування якого було доведено В.А. Кребсом і К. Хенселайтом, внаслідок чого цей цикл одержав назву циклу сечовини, або циклу Кребса-Хенселайта. У циклі сечовини виділяють два основні етапи: перший супроводжується синтезом аргініну, другий - гідролізом аргініну з утворенням сечовини й орнітину. На цей час установлено, що джерелом однієї з аміногруп молекули сечовини є аміак, який утворюється в процесі окиснювального дезамінування глутамінової кислоти в мітохондріях:
Цей аміак разом Із СОг утворює сполуку карбамоїлфосфат. Реакція відбувається під дією ферменту карбамоїлфосфатсин-тетази з використанням енергії двох молекул АТФ:
Карбамоїлфосфат далі реагує з орнітином, у результаті чого утворюється цитрулін і фосфатна кислота. Реакція каталізується ферментом орнітинтранскарбамілазою:
На наступній стадії в цикл сечовини залучається друга аміногрупа, що є аміногрупою аспарагінової кислоти, утвореної з глутамінової під дією ферменту аспартат-глутамат - амінотрансферази:
Таким чином, джерелом аміаку для синтезу сечовини врешті-решт є глутамінова кислота, в якій зібраний весь фонд аміногруп у результаті реакцій переамінування між а-амінокислота-ми, які утворились при гідролітичному розщепленні білків у травному каналі, і а-кетоглутаровою кислотою. Цим ще раз підкреслюється важлива біологічна роль глутамінової кислоти в азотистому обміні. Наступні реакції супроводжуються перетворенням цитруліну в аргінін. Спочатку цитрулін взаємодіє з аспарагіновою кислотою за участю аргініносукцинат-синтетази з утворенням ар-гініноянтарної кислоти. У цій реакції використовується енергія однієї молекули АТФ:
Потім аргініноянтарна кислота підлягає ферментативному розщепленню з утворенням аргініну і фумарової кислоти:
Реакція каталізується аргініносукцинат-діазою. На цьому закінчується перший етап синтезу сечовини. Фумарова кислота повертається в цикл трикарбонових кислот, де перетворюється в щавлево-оцтову. Остання, вступаючи в реакцію з глутаміновою кислотою, знову утворює аспарагінову, яка на відомій нам уже стадії циклу сечовини передає свою аміногрупу цитруліну. На другому етапі утворений аргінін під дією аргінази гідролітично розщеплюється на орнітин і сечовину:
Орнітин може знову вступати в реакцію з карбамоїлфосфатом, і весь цикл почнеться спочатку. Таким чином, в організмі людини і вищих тварин існують досить сильні механізми знешкодження аміаку і використання його для біосинтезу. Аміак є не тільки кінцевим продуктом білкового обміну, але й будівельним матеріалом для утворення багатьох сполук. ЯКІСТЬ БІЛКОВОГО ХАРЧУВАННЯ Білки, як уже відомо, є основним пластичним матеріалом нашого організму, який іншими речовинами замінити неможливо. Білки відрізняються один від одного вмістом окремих амінокислот. Тому залежно від амінокислотного складу для покриття потреб організму в білку необхідна різна кількість окремих білків. Різні білки мають неоднакову біологічну цінність. Чим ближчий амінокислотний склад того або іншого білка до складу білків даного організму, тим вища його біологічна цінність. Найбільш цінними є білки, які в достатній кількості містять всі необхідні організмові незамінні амінокислоти (тобто такі, що в організмі зовсім не синтезуються або синтезуються в дуже малій кількості). Таким чином, біологічна цінність білка визначається якісним І кількісним складом амінокислот, що входять до його молекули. Для людини цінними є білки молока, м'яса і курячого яйця, із рослинних білків - білок картоплі, що за своєю біологічною цінністю перевищує не тільки білок хліба, але й за деякими амінокислотами навіть білок коров'ячого молока. У змішаній дієті, що складається з 110-120 г білків, 40-60 г жирів і 600-700 г вуглеводів, має міститись не менше 50% білків тваринного походження. Така дієта забезпечує потребу організму в усіх незамінних амінокислотах. БІОСИНТЕЗ БІЛКА Одним з основних шляхів перетворення амінокислот, що утворилися в процесі розщеплення харчових білків у порожнині кишечника, є використання їх для біосинтезу специфічно видових білків. Цей процес з різною швидкістю відбувається у всіх органах і тканинах. Щодоби в організмі людини утворюється близько 1,3 г білка на 1 кг маси тіла. Якщо врахувати, що середня маса людини складає 70 кг, то за добу в її організмі синтезується приблизно 90 г білків. Загальна ж кількість білків в організмі становить 12-14 кг. Таким чином, усі вони оновлюються за 135-155 діб. Синтез деяких білків відбувається в організмі з дуже великою швидкістю. Наприклад, за 1 с в крові людини руйнується і знову синтезується близько 3 млн. еритроцитів, кожний з яких містить приблизно 300 молекул гемоглобіну. Загалом же синтез молекули білка в живій клітині закінчується за 2-3 с Будова рибосоми. Біосинтез білка - складний багатоступінчатий процес, який здійснюється на рибосомах - клітинних мікроструктурах, розміщених у цитоплазмі. За своєю хімічною природою рибосоми є нуклеопротеїдами, що складаються з РНК (50-60%) і білків (35-50%). Рибосоми всіх клітин мають однакову структуру і відрізняються лише розмірами й вмістом РНК. Кожна рибосома складається з двох субодиниць (частин) різного розміру, на які вона може дисоціювати, а потім знову асоціювати. Дисоціація й асоціація рибосом на дві субодиниці, як буде показано далі, є характерною рисою цих мікроструктур і безпосередньо пов'язана з механізмом біосинтезу білка. У рибосомі є дві ділянки - аміноацильна і пептидильна, або Л-ділянка. Аміноацильна ділянка служить для приєднання амінокислот, що надходять із цитоплазми необхідні для біосинтезу білка й утворення пептидного зв'язку між ними, пептидильна - для утримання синтезованого полінептидного ланцюга (рис. 20).
Найбільш вивченими є рибосоми бактеріальних клітин. Вся рибосома бактеріальної клітини позначається як 70 S утворення, яке дисоціює на дві субодиниці - 50 S і 30 S (рис.21) (S -константи седиментації окремих субодиниць і рибосоми в цілому). Субодиниці 50 S і 30S мають різний набір білків. Відомо, що деякі з них виконують каталітичні функції. У клітині рибосоми знаходяться звичайно у вигляді скупчень від 3 до 100 одиниць, утворюючи полірибосому, або полісому. У по-лісомі окремі рибосоми сполучені між собою своєрідною ниткою, яку видно під електронним мікроскопом. Цією ниткою є інформаційна РНК. Кожна рибосома здатна самостійно синтезувати один поліпептидний ланцюг, група рибосом, тобто полісома, - декілька таких ланцюгів. Матричний шлях біосинтезу білка. Як відомо, відмінність одного індивідуального білка від іншого визначається, насамперед, природою і послідовністю чергування амінокислот, що входять до його складу, тобто первинною структурою. Передача цього повідомлення є однією з основних Центром керування білкового синтезу є ядро клітини, в якому знаходиться носій всієї інформації - молекула ДНК. Інформація закодована в ДНК певною послідовністю азотистих основ, які входять до її молекули. Передача спадкових ознак, інформації про первинну структуру білка здійснюється через інформаційну РНК (ІРНК), яка синтезується на певній ділянці (гені) одного з ланцюгів ДНК. В основі передачі інформації лежить принцип комплементарності. Нагадаємо, що синтез ІРНК полягає в тому, що молекула ДНК, яка має форму подвійної спіралі, в окремі моменти розкручується на певних ділянках (ця ділянка називається геном). На кожній розкрученій ділянці двох ниток ДНК будується молекула ІРНК за принципом комплементарності. Відбувається свого роду»списування» порядку чергування азотистих основ розкрученої ділянки однієї з ниток ДНК на молекулу РНК. Цей процес "списування" інформації називається транскрипцією. У результаті транскрипції порядок чергування азотистих основ у молекулі ІРНК комплементарно повторює послідовність азотистих основ розкрученої ділянки молекули ДНК. Таким чином, молекула ІРНК одержує інформацію про первинну структуру білка. Потрапляючи в цитоплазму, молекула ІРНК "обростає" рибосомами і служить матрицею, на якій будується білок відповідно до вміщеної в ній інформації про порядок амінокислот. Процес передачі інформації від ІРНК, який полягає в суворо визначеній послідовності чергування нуклеотидів у її молекулі, на мову амінокислот молекул білка має назву трансляції. У зв'язку з тим, що для синтезу білка з певною первинною структурою використовується інформація молекули ІРНК, яка служить матрицею, такий шлях білкового синтезу називають матричним. Сама ДНК безпосередньої участі в біосинтезі білка не бере, вона лише постачає ІРНК усією необхідною інформацією. Коротко матричний шлях біосинтезу білка можна зобразити так: Процеси, пов'язані з реплікацією ДНК, транскрипцією і трансляцією, починаються з моменту зародження організму і з різною інтенсивністю відбуваються протягом усього життя.
|
||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 691; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.98.91 (0.009 с.) |



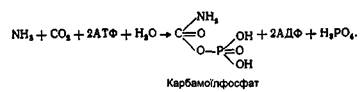

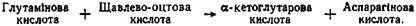




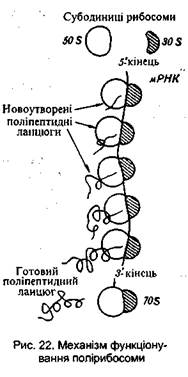 рис біосинтезу білка.
рис біосинтезу білка.



