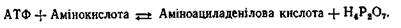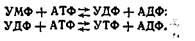Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основні етапи біосинтезу білкаСодержание книги
Поиск на нашем сайте Дослідження, проведені в різних лабораторіях, показали, що синтез поліпептидних ланцюгів проходить у чотири стадії. На першій стадії синтезу білка, яка називається активацією, здійснюється активація амінокислот шляхом зв'язування їх із відповідними тРНК. Цей процес відбувається в розчинній частині цитоплазми клітин за рахунок енергії АТФ. Друга стадія біосинтезу білка називається ініціацією поліпеп-тидного ланцюга. На цій стадії шляхом зв'язування ІРНК і першої, або ініціюючої, активованої амінокислоти з вільною рибосо-мною 30 S-субодиницею, що потім зв'язується рибосомною 50 S-субодиницею, відбувається утворення ініціюючого комплексу. На третій стадії, яка називається елонгацією, відбувається подовження поліпептидного ланцюга шляхом послідовного приєднання нових амінокислот, які приносяться до ІРНК відповідними тРНК. Причому кожна тРНК, яка переносить певну амінокислоту, специфічно відбирається відповідною ділянкою іРНК - кодоном. Після утворення чергового пептидного зв'язку молекула ІРНК і утворений поліпептидний ланцюг переміщуються, або транслюються на рибосомі. При цьому наступий кодон ІРНК займає на рибосомі робоче положення, до нього може приєднуватися нова тРНК Із принесеною амінокислотою. На стадії елонгації використовується енергія, що поставляється у формі ГТФ. На четвертій стадії, яка називається термінацією поліпептидного ланцюга, синтез білка закінчується. Сигналами термінації служать певні ділянки ІРНК. Коли при транслокації вони досягають рибосоми, синтез поліпептидного ланцюга припиняється і він відокремлюється від рибосоми. Розглянемо більш докладно весь процес біосинтезу білка. Активація амінокислот. На першій стадії білкового синтезу 20 амінокислот, що входять до складу білків, активуються. Вони з'єднуються з певними тРНК під дією ферментів, які називаються аміноацил-тРНК-синтетазами. При цьому кожній амінокислоті відповідає свій специфічний фермент. Активація амінокислот проходить у два етапи. Спочатку амінокислота взаємодіє з АТФ, утворюючи аміноациладенілову кислоту:
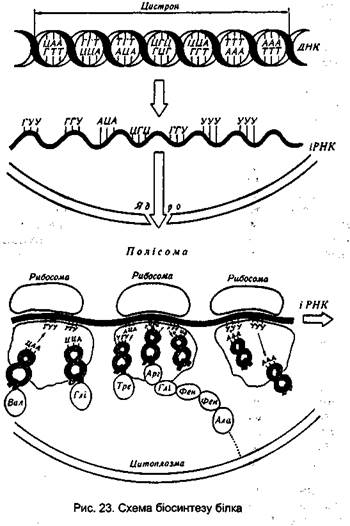
На другому етапі відбувається перенос аміноацильної групи з аміноациладенілової кислоти на тРНК. При цьому утворюється аміноацил-тРНК і аденілова кислота: Аміноацильна група зв'язується з тРНК на тому кінці її молекули, який має послідовність нуклеотидів ЦЦА. Нагадаємо, що на протилежному кінці молекули тРНК, яка має форму листка конюшини, знаходиться особлива ділянка з трьох нуклеоти-дів, або триплет, яку називають антикодоном тРНК. Завдяки антикодону, що має певну послідовність нуклеотидів, кожна тРНК «впізнає» своє місце на іРНК, а амінокислота, яка транспортується, займає правильне місце в зростаючому поліпептидному ланцюзі. Ініціація поліпептидного ланцюга. Встановлено, що по-ліпептидний ланцюг будується, починаючи з NН2-кінцевої амінокислоти, тобто перша амінокислота вступає в утворення пептидного зв'язку своєю карбоксильною групою. Крім того, синтез більшості, а можливо, і всіх білків починається з амінокислоти метіоніну. Однак ініціюючий залишок метіоніну, включається в початок білкового синтезу не у вигляді метіоніл-тРНК, а як N-форміл-метіоніл-тРНК. Інакше кажучи, у молекулі метіоніну аміногрупа блокована формільною групою. Тому дана кислота і не бере участі в утворенні пептидного зв'язку своєю аміногрупою. Залишок N-формілметіонілу не залишається в складі синтезованого поліпептидного ланцюга, він відщеплюється після закінчення білкового синтезу. Участь метіоніну у вигляді форміл-метіоніл-тРНК на початку білкового синтезу виключає, очевидно, можливість синтезу рибосомою пептидного ланцюга з середини іРНК. Дуже важливою обставиною в ініціації поліпептидного ланцюга є постійна дисоціація 70 S-рибосоми на 50 S- і 30 S-суб-одипиці і постійна реасоціація цих субодиниць з утворенням 70 S-рибосоми. Дисоціація і реасоціація 70 S-рибосоми має важливе біологічне значення, яке полягає в тому, що рибосома починає синтез поліпептидного ланцюга саме з початку молекули іРНК, а не в будь-якому її місці. Процес ініціації здійснюється після дисоціації 70 S-рибосоми на 50 S- і 30 S-субодиниці. Він починається з утворення комплексу між 30 S-субодиницею рибосоми, ІРНК і формілметіоніл-тРНК. У цьому процесі беруть участь ГТФ і три речовини білкової природи, які називають чинниками ініціації. До ініціюючого комплексу, що утворився, далі приєднується 50 S-субодиниця, у результаті чого утворюється повна функціональна 70 S-рибосо-ма, зв'язана з початком полінуклеотидного ланцюга іРНК. Фор-мілметіоніл-тРНК, яка надійшла спочатку в аміноацильну ділянку рибосоми, переміщається потім у пептидильну ділянку. На цьому процес ініціації закінчується. Елонгація поліпептидного ланцюга. У момент закінчення процесу ініціації формілметіоніл-тРНК розташована в пептиди-льній ділянці рибосоми, аміноацильна ділянка вільна і готова до прийняття наступної аміноацнл-тРНК. Стадія елонгації складається з трьох етапів. На першому етапі в аміноацильну ділянку 70 S-рибосоми надходить нова аміноацил-тРНК, що зв'язується з наступним по черзі кодоном іРНК. Цей етап відбувається з використанням енергії, яка поставляється у вигляді ГТФ. На другому етапі на аміноацильній ділянці 70 S-рибосоми відбувається утворення пептидного зв'язку між новою аміноацил-тРНК і формілметіоніл-тРНК. Остання переміщується на цю ділянку з пептидильного. При цьому тРНК, що звільнилася від формілметионільного залишку залишається усе ще зв'язаною з пептидильною ділянкою. Утворення пептидного зв'язку відбувається без участі АТФ і ГТФ, але під дією ферменту пептидилтрансферази, яка є частиною 50 S-субодиниці рибосоми. На третьому, заключному, етапі елонгації утворений дипептид, зв'язаний Із тРНК, що принесла нову амінокислоту, переміщується з аміноацильної ділянки на пептидильну, витісняючи з нього звільнену раніше від формілметионільного залишку тРНК. Процес переміщення дипептиду (або поліпептиду) з аміноацильної ділянки на пептидильну називається транслогацією. Він супроводжується витратою енергії у формі ГТФ. У процесі транслокації відбувається звільнення аміноацильної ділянки рибосоми, до якої приєднується наступна аміноацил-тРНК, і весь процес повторюється. Механізм елонгації поліпептидного ланцюга залишається однаковим протягом усього процесу біосинтезу білка. Термінація поліпептидного ланцюга. Зчитування інформації з ІРНК, тобто трансляція, і ріст поліпептидного ланцюга продовжується до останнього С-кінцевого залишку її молекули. Сигналом для закінчення синтезу служить надходження на аміноацильну ділянку рибосоми одного з так званих "беззмістовних" кодонів (триплетів УАА, УАГ і УГА), що не транслюють жодної амінокислоти. Один із таких триплетів (або два підряд) розташовані на іРНК відразу за кодоном останньої амінокислоти. Процес термінації вивчений меншою мірою, ніж інші стадії білкового синтезу. Проте відомо, що спочатку поліпептидний ланцюг переміщується з аміноацильної ділянки, де утворився останній пептидний зв'язок, на пептидильний. Потім відбувається розрив зв'язку між кінцевою амінокислотою і її тРНК, і поліпептидний ланцюг покидає рибосому. Після цього розпадається комплекс рибосома – іРНК, а сама рибосома дисоціює на дві субодиниці, які знову використовуються в біосинтезі. Синтезований поліпептидний ланцюг, потрапляючи в цитоплазму, набуває властивої йому просторової конфігурації. Весь процес біосинтезу білка можна зобразити схематично. Як бачимо, біосинтез білка в клітині здійснюється за
участю нуклеїнових кислот, які справедливо називають "живими молекулами". Головне місце в білковому синтезі належить молекулі ДНК, у полінуклеотидних ланцюгах якої у вигляді унікальної І специфічної послідовності нуклеотидів закладена генетична інформація про послідовність амінокислот для мільйонів білків, що синтезуються. Молекули ДНК зберігають спадкову інформацію і шляхом реплікації передають її з покоління в покоління. Доказом провідної ролі ДНК у формуванні специфічних особливостей білка і його синтезу є той факт, що при руйнуванні ДНК ядер порушується або зовсім припиняється білковий синтез. Це спостерігається за умови дії радіоактивного випромінювання, додавання радіоактивного фосфору, а також при розщепленні ДНК під впливом ферментів. Свою спадкову функцію ДНК виконує не безпосередньо, а за допомогою РНК. Так, інформація про структуру білка передається молекулою ДНК на іРНК, яка є посередником між ДНК і білками. Інші РНК виконують ніби підсобні функції: тРНК доставляє необхідні для білкового синтезу амінокислоти, інші РНК входять до складу рибосом і допомагають списувати інформацію з ІРНК. Таким чином, нуклеїнові кислоти мають надзвичайно важливе значення в білковому синтезі. Розглянемо тепер, як відбувається розшифровка генетичного коду, тобто яким чином нуклеїнові кислоти, що складаються з чотирьох нуклеотидів, кодують і передають інформацію на амінокислотну мову білків. ГЕНЕТИЧНИЙ КОД На цей час точно встановлено, що Інформація про специфічну будову білкової молекули закладена в послідовності нуклеотидів молекули ДНК, яка називається кодом. Само собою зрозуміло, що передача інформації не може здійснюватися за принципом "один нуклеотид - одна амінокислота", оскільки таким шляхом можнй закодувати тільки 4 амінокислоти. Двох нуклеотидів також не вистачає, оскільки чотири нуклеотиди можуть дати тільки 16 різноманітних сполучень по два нуклеотиди (42=16). Кількість же різних сполук із трьох нуклеотидів складає вже 64 (4а=64), і, отже, 20 амінокислот можуть бути закодовані за допомогою триплетного коду. Таким чином, код для 20 амінокислот, які входять до складу молекул природних білків, має бути як мінімум триплетним. Перше експериментальне підтвердження триплетності генетичного коду було одержано в 1961 р. Ф. Криком, а пізніше було остаточно доведено М. НіренбергоМ, П. Ледером і X. Кораною. Доказ триплетності коду поставив нові питання: оскільки для двадцяти амінокислот цілком достатньо двадцять триплетів, яка роль зайвих (сорока чотирьох) колонів? Як показали дослідження, окремі амінокислоти можуть кодуватися не одним, а декількома колонами. Кодони 20 амінокислот подані в табл. 4. Таблиця показує, що тільки триптофан і метіонін кодуються кожний одним триплетом, а на інші амінокислоти припадає по 2,
З, 4 і навіть по 6 кодонів. З 64 триплетів 61 кодують амінокислоти, а три, що залишились, не кодують ніяких амінокислот - їх назвали "беззмістовними кодонами". Роль цих кодонів полягає в поданні сигналу про закінчення біосинтезу білка, тобто стадії термінації, тому вони називаються ще кодонами термінації. Існування декількох кодонів для однієї і тієї ж амінокислоти називають виродженням генетичного коду. Ця властивість генетичного коду має важливий біологічний зміст. Якби кожній амінокислоті відповідав тільки один триплет, то при заміні одного нуклеотиду в кодоні він перетворювався б у беззмістовний, що призводило б до припинення білкового синтезу. Проте внаслідок того, що код вироджений, тобто майже кожній амінокислоті відповідає декілька кодонів, заміна одного нуклеотиду в кодоні призводить лише до заміни однієї амінокислоти іншою і синтез білка не зупиняється. При цьому, якщо заміна амінокислоти відбулася не в активному центрі білка, його біологічні властивості не порушуються. З таблиці генетичного коду видно, що код вироджений нерівномірно. Наприклад, для серину і лейцину він вироджений шестикратно (існує 6 кодонів для серину і 6 - для лейцину), а для таких амінокислот, як тирозин, гістидин, глутамінова кислота й Інші, код вироджений лише дворазово. Неважко помітити, що в багатьох випадках виродженість коду стосується тільки третього нуклеотиду в кодоні, причому це положення зайняте або піримідиновою, або пуриновою основою. Іншими словами, кодування однієї амінокислоти визначається головним чином двома першими нуклеотидами, а третій нуклеотид не має істотного значення. Тому можна вважати, що генетичний код не триплетний. Важливою особливістю генетичного коду є відсутність "розділових знаків" між кодонами. У зв'язку з цим зчитування інформації з ІРНК має починатись у строго визначеному місці, інакше вся послідовність нуклеотидів буде прочитана невірно, що призведе до біосинтезу "беззмістовного" білка з правильною структурою. Необхідно також відзначити, що генетичний код універсальний - триплети, що кодують одні й ті ж амінокислоти, однакові у всіх живих організмів, навіть у таких дуже віддалених видів, як людина, рослини і бактерії. ОБМІН НУКЛЕЇНОВИХ КИСЛОТ Нуклеїнові кислоти є складовою частиною нуклео-протеїдів і входять до складу харчових продуктів. Особливо багаті нуклеїновими кислотами продукти тваринного походження. Під дією травних соків травного каналу нуклеопротеїди розщеплюються на прості білки і нуклеїнові кислоти. Білки розщеплюються до вільних амінокислот уже відомим нам шляхом, а нуклеїнові кислоти під впливом ферментів, які називають нуклеазами, розщеплюються на окремі мовонуклеотиди. Мононуклеотиди, що утворилися, розпадаються далі на нук-леозиди і фосфорну кислоту під дією нуклеотидаз. Нуклеозиди й окремі мононуклеотиди є тими формами нуклеїнових кислот, що всмоктуються стінкою кишок і включаються в клітинний обмін. У результаті повного розщеплення мононуклеотидів утворюються азотисті основи (пуринового і піримідинового ряду), пентози (рибоза або дезоксирибоза) і фосфатна кислота. Ці продукти можуть перетворюватися у відповідні кінцеві продукти або ж використовуватися організмом для біосинтезу різних сполук, у тому числі нуклеотидів, нуклеїнових кислот і нуклеопротеїдів. Фосфатна кислота використовується для синтезу АТФ, фосфатидів, кісткової тканини. Пентози через ряд проміжних реакцій перетворюються в СО2 і Н2О або вступають в інші реакції. Щодо азотистих основ, то вони зазнають перетворень, у результаті яких Із пуринових основ утворюються сечова кислота й алантоїн, із піримідинових - аміак. |3-амінокислоти і вуглекислий газ. Перетворення пуринових основ. Перетворення аденіну і гуаніну супроводжується дезамінуванням і наступним їх окисненням в оксипурин, Аденін під дією аденази дезамінується до гіпоксантину, який перетворюється потім у ксантин, гуанін дезамінується гуаназою до ксантину. Ксантин окислюється далі ксантиноксидазою до сечової кислоти:
Сечова кислота є кінцевим продуктом обміну пуринових основ у людини і людиноподібних мавп і виділяється з організму разом із сечею, В інших тварин (коней, собак, кішок, кроликів) сечова кислота окислюється далі до алантоїну - кінцевого продукту обміну пуринових основ:
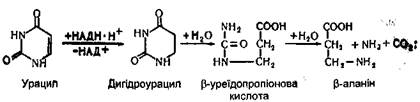
Перетворення піримідинових основ. Перетворення цитозину, урацилу і тиміну порівняно з пуриновими основами мають деякі особливості. Піримідинові основи в тканинах і печінці спочатку відновлюються, а потім розщеплюються на більш прості речовини. Цитозин спочатку дезамінується і перетворюється в урацил:
Урацил перетворюється в Р-аланін, при цьому звільняютіся аміак і вуглекислий газ:
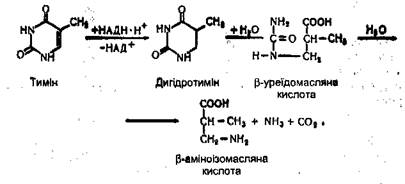
Тимін утворює β-аміноізомасляну кислоту, аміак і вуглекислий газ:
Утворені β-амінокислоти (β-аланін і β-аміноізомаслява кислоти) перетворюються потім у сечовину. Аміак і вуглекислий газ, що виділилися при розпаді піримідинових основ, також використовуються для біосинтезу сечовини. Таким чином, основними кінцевими азотовмісними продуктами обміну нуклеїнових кислот і нуклеопротеїдів в організмі людини є сечова кислота і сечовина.
БІОСИНТЕЗ НУКЛЕОТИДІВ Оскільки мононуклеотиди складаються з азотистих основ (аденіну, гуаніну, урацилу, цитозину і тиміну), рибози або дезоксирибози і фосфатної кислоти, для синтезу окремих мононуклеотидів необхідна наявність у клітині цих складових компонентів. Пентози і фосфатна кислота, потрапляючи з харчовими продуктами, знаходяться в організмі в достатній кількості. Основним шляхом забезпечення організму азотистими основами є синтез їх у клітинах тканин людини і вищих тварин. Попередники пуринових і піримідннових основ. Методом мічених атомів з'ясовано, що для синтезу азотистих сполук пуринового ряду необхідні такі речовини-попередники: аспарагінова кислота, глутамін, мурашина кислота, гліцин і СО2. У наведеній нижче формулі пурину показано, за рахунок яких із названих сполук утворюються окремі частини пуринового кільця:
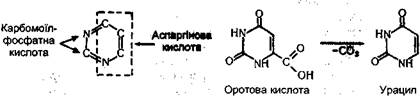
Для синтезу піримідинових основ використовуються аспарагінова кислота, вуглекислий газ і аміак. На першому етапі а аміаку І вуглекислого газу за участю АТФ утворюється карба-моїлфосфатна кислота, яка утворює одну з частин піримідинового кільця. Інша частина цього кільця утворюється за рахунок аспарагінової кислоти. Синтез піримідйнових основ здійснюється через проміжну сполуку оротову кислоту, яка утворює з діримідинових азотистих основ - урацил. Нижче подано цикл піримідину і перетворення оротової кислоти в урацил:
Урацил є азотистою основою мононуклеотиду - уридилової кислоти, яка шляхом амінування перетворюється в цитидилову кислоту. Остання внаслідок метилювання перетворюється в ти-мідилову кислоту. Біосинтез мононуклеотидів. Пуринові мононуклеотиди синтезуються не шляхом простого сполучення їх основних компонентів між собою в послідовності азотиста основа - пентоза -фосфатна кислота. їх синтез починається з пірофосфатного фосфорилювання рибозо-5-фосфату за рахунок енергії АТФ. Потім до напівацетального гідроксилу пентози у визначеній послідовності приєднуються речовини, що беруть участь у побудові кільця пуринової основи:
У результаті цих послідовних реакцій утворюється інозинова кислота, яка за участю аспарагінової кислоти і АТФ перетворюється в аденілову. При взаємодії інозинової кислоти з глутаміном утворюється гуанілова кислота. Таким чином, при синтезі пуринових мононуклеотидів кільце азотистої основи формується на фосфорильованій пентозі. Синтез піримідинових мононуклеотидів на відміну від пуринових відбувається після того, як сформується кільце піриміди-нової основи, а саме, коли з карбамоїлфосфату й аспарагінової кислоти утвориться оротова кислота. До кільця оротової кислоти приєднується рибозо-5-фосфат, у результаті чого утворюється оротидил-5-фосфат. Останній, декарбоксилюючись, перетворюється в уридилову кислоту (піримідиновий мононуклеотид). Уридинова кислота у формі УТФ, утвореного за рахунок енергії АТФ, служить попередником інших піримідинових нуклеотидів:
Уридинтрифосфат шляхом амінування за участі енергії АТФ утворює цитидинтрифосфат:
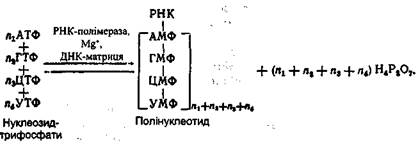
Шляхом метилювання уридилової кислоти утворюються тимідинова кислота. БІОСИНТЕЗ НУКЛЕЇНОВИХ КИСЛОТ Синтез нуклеїнових кислот здійснюється шляхом сполучення між собою залишків великої кількості мононуклеотидів, джерелом яких служать нуклеозидтрифосфати. Останні завжди є в клітині в достатній кількості. У синтезі ДНК нуклеозидтрифосфатами служать такі дезоксирибонуклеозидтрифос-фати: дАТФ, дЦТФ, дГТФ і дТТФ, у синтезі РНК - рибонуклео-зидтрифосфати: АТФ, ГТФ, ЦТФ і УТФ. Специфічний біосинтез нуклеїнових кислот здійснюється за допомогою ферментів ДНК- і РНК-полімераз. Для ефективного функціонування цих ферментів необхідна наявність "затравки" у вигляді вже готового ланцюга, який відіграє роль матриці. Остання обставина має принципове значення, оскільки завдяки наявності матриці забезпечується специфічний синтез нуклеїнових кислот з певною заданою послідовністю нуклеотидних залишків у молекулі. Біосинтез ДНК. Специфічний синтез ДНК здійснюється за допомогою ДНК-полімерази при невеликій кількості готових молекул ДНК. Загальна схема біосинтезу ДНК за допомогою ДНК-полімерази може бути подана такою схемою:
Роботами А. Корнберга і його колег було виявлено, що нати-вна двоспіральна ДНК не здатна підтримувати синтез ДНК, у той час як денатурована ДНК {особливо коли її ланцюги роз'єднані і знаходяться на великій відстані) виявляє максимальну активність. Ці факти є свідченням того, що для ДНК-полімерази необхідна одноланцюгова ДНК насамперед як матриця для синтезу полінуклеотидного ланцюга. Дослідження останніх років показали, що ДНК-полімераза функціонує з найбільшою ефективністю в тому випадку, якщо ДНК містить два ланцюги - матричний і затравочний (рис. 24). При цьому приєднання окремих нуклеозидмонофосфатів і з'єднання їх між собою відбувається на затравочному ланцюзі, а порядок, в якому ДНК-полімераза приєднує нові мононуклеоти-дні залишки, визначається послідовністю основ у матричному ланцюзі. За допомогою ДНК-полімерази здійснюється хімічна реакція, яка полягає в перенесенні залишку нуклеозидмонофосфату на кінцевий нуклеотидний залишок затравочного ланцюга молекули ДНК, а потім на кінцевий нуклеотид полінуклеотидного ланцюга, який росте в процесі біосинтезу. Перенесення здійснюється на місце атома водню гідроксильної групи, розташованої біля третього атома вуглецю дезоксирибози кінцевого нуклеотиду. Вільна гідроксильна група біля третього вуглецевого атома дезоксирибози попередньо приєднаного нуклеотидного залишку реагує з гідроксильною групою у п'ятому положенні наступного нуклеотидного залишку. У такий спосіб здійснюється ступінчатий біосинтез полінуклеотиду шляхом нарощування його з одного кінця. Цей процес відбувається по всій довжині матричного ланцюга в напрямку 5→3. Синтез полінуклеотидного ланцюга забезпечується за рахунок енергії розщеплення макро-ергічних зв'язків у трифосфатних угрупованнях при звільненні пірофосфату.
Оскільки матриця являє собою од но ланцюгову структуру, необхідною умовою для біосин-тезу молекул ДНК, які характеризуються двоспіральною структурою, є розходження двоспірального ("батьківського") полідезо-ксирибонуклеотиду на односпіральнї полінуклеотидні ланцюги (кожен з яких може служити матрицею), на яких і відбувається складання комплементарних їм полінуклеотидів. У результаті цього з однієї двоспіральної молекули ДНК утворюється дві ("дочірні") двоспіральні молекули ДНК, абсолютно ідентичні як між собою, так і до вихідної молекули ДНК. ДНК-лігази. Важливе місце в біосинтезі ДНК займають реакції, що каталізуються ДНК-лігазою. Цей фермент здатний ліквідовувати розриви, які виникають в одному з ланцюгів під впливом ендонуклеаз, шляхом утворення нового 3'→5'-зв'язку між роз'єднаними кінцями. Тому ДНК-лігази називають зшиваючими ферментами. Крім того, ДНК-лігаза може з'єднувати кінці лінійної дволанцюгової молекули ДНК з утворенням кільцевої структури. Для прояву своєї активності ДНК-лігаза потребує наявності інтактного комплементарного ланцюга ДНК, за рахунок спарювання з яким два кінця, що з'єднуються, виявляються поруч. Саме в таких умовах між ними виникає новий фосфодиефірний зв'язок. Утворення кільцевих дволанцюгових молекул ДНК за участю ДНК-лігази відбувається завдяки наявності комплементарних "липких" кінців у лінійній молекулі ДНК-попередника. ДНК-лігази виявлені в найрізноманітніших клітинах. Біосинтез РНК. Синтез РНК найбільш інтенсивно відбувається в ядрі. Дослідження показали, що в цьому синтезі матрицею виступає один з ланцюгів ДНК і бере участь РНК-полімераза. Процес синтезу РНК із використанням матрицею ядерної ДНК одержав назву транскрипції ("списування" інформації). Синтезовану таким чином РНК назвали інформаційною, оскільки вона передає інформацію від ДНК до місця синтезу білків. Синтез РНК, як і ДНК, проходить у чотири стадії: приєднання РНК-полімерази до ДНК-матриці; ініціація ("списування" інформації з ДНК-матриці на послідовність нуклеотидів у молекулі РНК); елонгація (подовження) ланцюга РНК; термінація, тобто закінчення синтезу РНК.
Загальну схему синтезу РНК, що каталізується РНК-полімеразою, можна зобразити так:
Так само, як і в синтезі ДНК, джерелом енергії для цього процесу служить реакція розщеплення рибонуклеозидтрифосфатів. РНК, синтезована в присутності ДНК-матриці, характеризується нуклеотидним складом, комплементарним нуклеотидному складу використаного як матриця ланцюга ДНК. Відмінність полягає лише в тому, що залишку тиміну в ДНК-матриці відповідає залишок урацилу в синтезованій РНК.
|
||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 1473; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.137 (0.014 с.) |