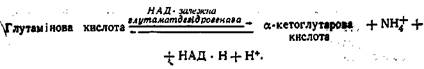Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Перетворення амінокислот після всмоктуванняСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
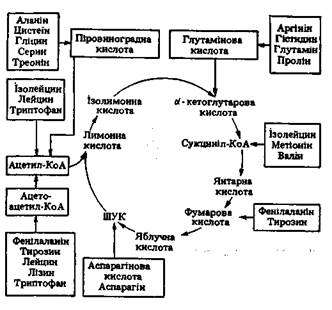
У клітинах окремих органів і тканин амінокислоти зазнають різних перетвореннь. Частина їх використовується як матеріал для синтезу специфічних для організму білків, інші - для утворення небілкових азотистих сполук, які є складовими частинами клітин і тканин, деякі амінокислоти розпадаються до кінцевих продуктів азотистого обміну. Утворенню кінцевих продуктів білкового обміну передує попереднє внутрішньоклітинне окиснення амінокислот. При цьому для окиснення двадцяти різних амінокислот, що входять до складу білків, існує і двадцять різних шляхів, кожний з яких у свою чергу складається з великої кількості ферментативних реакцій. Проте всі ці шляхи в підсумку призводять до утворення невеликої кількості продуктів, які залучаються в різних місцях до циклу трикарбонових кислот, де підлягають дегідруванню і декарбоксилюванню. Шляхи включення вуглецевих скелетів двадцяти амінокислот у цикл Кребса показані на схемі:
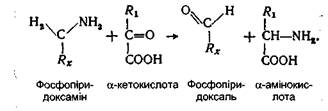
Шляхи включення вуглецевих скелетів амінокислот у цикл Кребса Десять амінокислот через піровиноградну кислоту й ацето-ацетил-КоА перетворюються в ацетил-КоА, п'ять інших перетворюються в а-кетоглутарову кислоту, три - у сукциніл-КоА і дві - у щавлево-оцтову кислоту. Причому дві амінокислоти (фенілаланін і тирозин) розщеплюються таким чином, що частина їх вуглецевого ланцюга включається в цикл у вигляді ацетил-КоА, інша частина - у вигляді фумарової кислоти. Перетворення амінокислот в організмі людини відбувається переважно в клітинах печінки, нирках і незначною мірою - у клітинах скелетних м'язів. Перед включенням вуглецевих скелетів вільних амінокислот у цикл Кребса відбувається їх дезамінування. Дезамінування амінокислот. Найбільш важливими процесами, за допомогою яких відбувається відщеплення аміногруп від амінокислот у ссавців, є трансамінування й окиснювальне дезамінування. Перезмінуванням, або трансамінуванням, називають хімічну реакцію, при якій відбувається перенесення амінної групи від однієї молекули до іншої без утворення вільного аміаку. Процес переамінування був відкритий у 1937 р. радянськими біохіміками А.Е. Браунштейном і М.Г. Крицман. Він здійснюється за допомогою ферментів амінотрансфераз (трансаміназ), що містять простетичну групу фосфопіридоксаль (фосфорний ефір вітаміну В6). Переамінування є складним процесом, що відбувається у два етапи. На першому етапі здійснюється перенос NH2-групи від амінокислоти на фосфопіридоксаль амінотрансферази. При цьому амінокислота перетворюється у відповідну кетокислоту, а фосфопіридоксаль у фосфопіридоксамін:
На другому етапі аміногрупа з фосфопіридоксаміну передається на кетокислоту, яка перетворюється в амінокислоту:
За допомогою реакцій переамінування аміногрупи більшості амінокислот переносяться на три α-кетокислоти: піровиноградну, α-кетоглутарову і щавлево-оцтову, у результаті чого вони перетворюються в кетоаналоги вихідних амінокислот, а α-кетокислоти перетворюються відповідно в аланін, глутамінову й аспарагінову кислоти: 1) α-амінокислота + Піровиноградна кислота → а-кетокислота + Аланін; 2) α-амінокислота + α-кетоглутарова кислота → a-кетокислота + Глутамінова кислота; 3) α-амінокислота + Щавлево-оцтова кислота → а-кетокислота V + Аспарагінова кислота. Відомі дві найбільш важливі амінотрансферази: аланінаміно-трансфераза, що каталізує реакцію (1) і глутаматамінотрансфераза, що каталізує реакцію (2). У деяких організмів функціонує й аспартатамінотрансфераза, що каталізує реакцію (3). Загальний результат переамінування різних амінокислот полягає в тому, що всі їх аміногрупи зрештою збираються в загальний фонд у вигляді однієї амінокислоти, якою в організмі ссавців є глутамінова кислота. Таким чином, аміногрупи, накопичені у формі аланіну Й аспарагінової кислоти, переносяться потім на a-кетоглутарову кислоту з утворенням глутамінової. Ці реакції здійснюються двома відповідними ферментами - аланін: 2-оксоглутарат- І аспартат: 2-оксоглутаратамінотрансфера-вами, або скорочено АЛТ і ACT:
Отже, незалежно від початкових реакцій трансамінуванвя кінцевим акцептором аміногруп більшості амінокислот є α-кетоглутарова кислота. Перетворюючись у глутамінову кислоту, вона служить каналом, за допомогою якого аміногрупи передаються в заключну серію реакцій, які ведуть до утворення кінцевих продуктів азотистого обміну. Окиснювальне дезамінування полягає у відщепленні аміногрупи від амінокислот з виділенням аміаку. Аміногрупи, зібрані за допомогою амінотрансфераз від різних амінокислот, виявляються в результаті a-аміногрупами глутамінової кислоти. Остання піддається окиснювальному дезамінуванню за допомогою ферменту НАД-залежноі глутаматдегідро-генази. Окиснювального дезамінування можуть зазнавати й інші амінокислоти. Проте найбільш активно цей процес відбувається з глутаміновою кислотою, оскільки тільки для цієї амінокислоти існує дуже активна дегідрогеназа. Глутаматдегідрогеназа, таким чином, відіграє центральну роль у процесі окиснювального дезамінування амінокислот у багатьох організмів. Аміногрупи різних амінокислот, зібрані в складі глутамінової кислоти, звільняються у вигляді іонів NH4+:
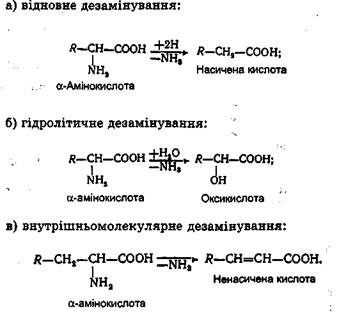
Відомі й інші шляхи дезамінування α-амінокислот, такі, як відновне, гідролітичне і внутрішньомолекулярне:
Ці види дезамінування а-амінокислот найбільш характерні для мікроорганізмів і рослин. На закінчення необхідно підкреслити, що глутамінова кислота в організмі ссавців відіграє дуже важливу роль. З одного боку, вона є тією формою, за допомогою якої відбувається видалення аміаку в тканинах, з іншого боку - служить тими "воротами", через які аміак і аміногрупи, акцептовані в її складі, або передаються на заключну стадію азотистого обміну, або за допомогою амінотрансфераз переносяться на сс-кетокислоти. Остання обставина важлива тому, що завдяки глутаміновій кислоті шляхом амінування а-кетокислот відбувається синтез окремих амінокислот в організмі. Декарбоксилювання амінокислот є одним Із шляхів перетворення амінокислот, утворених в результаті гідролитичного розщеплення білків їжі. У результаті реакцій декарбоксилювання амінокислот у тканинах людини і вищих тварин утворюються аміни. Аміни (тирамін, адреналін, гістамін, серотонін і ін.) - це біологічно активні речовини, деякі з них є отрутами. Аміни виконують в організмі важливу роль. Так, гістамін, тирамін і серотонін мають потужний фармакологічний вплив на кров'яний тиск і кровоносні судини. Проте реакції декарбоксилювання амінокислот на відміну від реакцій переамінування не є основним шляхом перетворення амінокислот, незважаючи на велике фізіологічне значення утворених продуктів реакції. Швидкість цих реакцій дуже мала.
|
||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 727; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.210.196 (0.008 с.) |


 і
і