
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема: Амінокислоти. Незамінні амінокислоти.Содержание книги
Поиск на нашем сайте План 1. Будова амінокислот. 2. Класифікація амінокислот. 3. Ізомерія амінокислот. 4. Фізичні і хімічні властивості. 5. Незамінні амінокислоти, їх біологічне значення. 6. Промислове використання глутамінової кислоти. Література 1. Гурецька В.Л., "Органічна хімія", М., Вища школа, 1999 - с. 221-229
Питання 1. Будова амінокислот. Амінокислоти – похідні кислот, в яких гідроген у радикалі заміщений на аміногрупу (NH2). CH3COOH CH2(NH2)COOH оцтова кислота аміно оцтова кислота (глікокол) Загальна формула: H2N-R-COOH Питання 2. Класифікація амінокислот. Залежно від числа амінокислота карбоксогруп розрізняють: моноамінокарбонові NH2-R-COOH; діамінокарбонові (NH2)-R-COOH; (одноосновні) моноамінодикарбонові NH2-R-(COOH)2; діамінодикарбонові (NH2)2-R-(COOH)2; (двохосновні)
Питання 3. Ізомерія амінокислот. Ізомерія амінокислот залежить від розміщення аміногрупи і ізомерії вуглецевого ланцюга. Залежно від взаємного розміщення функціональних груп розрізняють £ β γ… амінокислоти. γ β £ β £
γ – аміномасляна кислота NH2 β – аміномасляна кислота
£ H2N-CH2-СООН £ - амінооцотова кислота Залежно від природи вуглеводневого радикалу бувають аліфатичні, ароматичні, гетероциклічні амінокислоти.
Питання 4. Фізичні і хімічні властивості. Амінокислот існує велика кількість.
NH2 £ - амінопропіонова кислота Хімічні властивості. Амінокислоти одночасно є основами і кислотами, так як містять дві функціональні групи – аміногрупу - NH2 і карбоксил – СООН. 1. Водні розчини амінокислот мають нейтральну реакцію на лакмус, що пояснюється утворенням внутрішньої солі. 2. Амінокислоти вступають в реакцію з кислотами і лугами, утворюючи солі. Значить, амінокислоти є амфотерними сполуками. 3. Із спиртами амінокислоти утворюють складні естери: СН2-(NH2)-CООН+НОC2H5→CH2(NH2)—СООС2Н5+Н2О амінооцтовоетиловий естер
4. Амінокислоти із нітритною кислотою утворюють оксикислоти: NH2-СН2-CООН+НОNО→НО-CH2-СООН+N2-H2О оксиоцтова кислота
5. Амінокислотам характерні і специфічні реакції. Найбільш важливою із реакцій амінокислот є їх поліконденсація:
H2N--С-ОН+Н-N-R-C-ОН→Н2О+H2N-R-С-N-R-СООН дипептид
О Н називаємий пептидним зв’язком, а утворена речовина називається дипептидом. Так як утворена молекула дипепитида має групи -NH2 і –CООН, то можливий подальший ріст ланцюга, який призведе до появи поліпептида. Важливість утворення поліпептидів визначається тим, що поліпептидні ланцюги із £ - амінокислот являються структурною основою білків.
Питання 5. Незамінні амінокислоти, їх біологічне значення. Амінокислоти мають велике біологічне значення для організмів. Деякі амінокислоти не можуть синтезуватись в живому організмі, але необхідні для його нормально розвитку і існування. Виключення таких амінокислот із дієти призводить до порушення азотного обміну, а в подальшому і загибелі організму. Тому розрізняють замінні і незамінні для організму кислоти. До незамінних відносять: валін, лейцін, тріпитофан, метіонін фенілаланін, трионін, лізин, гістедин, аргінін. Питання 6. Промислове використання глутамінової кислоти. Амінокислоти відносяться до білкових збагачувачів їжі. Вони можуть частково заміняти в харчувані білки, так як практично складні білкові сполуки засвоюються організмом у вигляді амінокислот. В даний час здійснюють синтез глутамінової кислоти і незамінних амінокислот – лізина і метионіна. НООС-СН(NH2)-СН2-СН2-CООН глутамінова кислота її можна отримати і мікробіологічним шляхом. Її добавляють в консерви, харчові концентрати, застосовується і її натрієва сіль – так називає мий глутаматом натрію. Це білий порошок, який придає продуктам смак і аромат м’яса. Його добавляють в варені ковбаси, харчові концентрати. Питання для 1. Які речовини називаються амінокислотами? 2. Які функціональні групи є в молекулах амінокислот? Чому амінокислоти амфотерні? 3. Які амінокислоти називаються незамінними і чому? 4. Які амінокислоти використовують в виробництві харчових продуктів? 5. Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення:
6. Які амінокислоти є незамінними: а) аланін; б) серін; в) лізин; г) валін; д) глутамат.
Самостійна робота № 6 Тема: Жири. План 1. Будова і типи гліцеридів, які входять до складу харчових продуктів. 2. Класифікація жирів. 3. Фізичні і хімічні властивості жирів і їх основні фізико-хімічні константи.
Література 1. Черних В.П., Грищенко В. М., Єлисєва Л.І. Органічна хімія: підручник для студентів вищих навчальних закладів I – II рівнів акредитації. К.: Либідь, 2004 – с. 156– 171, 176. 2. Гурецька В. Л. Органічна хімія. М.: Вища Школа, 1999- с. 159-171. Питання 1. Будова і типи гліцеридів, які входять до складу харчових продуктів. Жири широко розповсюджені в природі. В рослинах вони накопичуються переважно в насінні, в плодовій м'якоті; в тваринних організмах - в з'єднальній, підшкірній і жировій тканині. Вперше будова жирів була відкрита у 1811р. французьким вченим Бертло. Жири (ліпіди) представляють собою суміш гліцеридів, в основному різнокислотних тригліцеридів, в зв'язку з чим жири часто називають просто тригліцеридами. В тригліцеридах залишки гліцерину складають приблизно 10% від загальної маси жиру, а решта йде на вхідні в гліцериди жири.
Основні кислоти, що входять до складу жирів: С3Н7СООН - масляна кислота С15Н31СООН - пальмітинова кислота С16Н33СООН - маргаринова кислота С17Н35СООН - стеринова кислота С17Н33СООН - олеїнова кислота С17Н31СООН - ліколева кислота С17Н29СООН - ліколенова кислота С19Н31СООН - арахідінова кислота Кожен жир має свій склад кислот. Гліцериди, утворені насиченими твердими кислотами - тверді, гліцериди ненасичених рідких кислот - рідкі. Тверді гліцериди утворюють основу твердих жирів (бараній і гов'яжий), а рідкі входять переважно до складу м'яких і рідких жирів (гусиний, рослинний). Тригліцериди - тристеарин, трипальмітин, гриолеїн, входять до складу всіх тваринних і рослинних жирів. Гліцериди масляної кислоти містяться в коров'ячому маслі, гліцериди ліколевої і лінолевої кислот - переважно врослинних маслах. Практично жири отримують із природних джерел: 1. Витоплення - нагріванням тваринних тканин; 2. Вичавлюванням - пресуванням нагрітих рослинних тканин; 3.-Екстрагуванням рослинних жирів в хімічних розчинниках з послідуючим їх діленням. Питання 2. Класифікація жирів. За походженням жири поділяють на рослинні і тваринні. Рідкі рослинні жири (масла) по здібності утворювати на поверхні плівки ділять на: 1. висихаючи масла (льняне, конопляне, тунгове); 2. напіввисихаючі (соєве, соняшникове, бавовні); 3. невисихаючі масла (оливкове, мигдальне).
Питання 3. Фізичні і хімічні властивості жирів і їх основні фізико-хімічні константи. Питома вага жирів менше 1, в середньому 0,9-0,95. Всі жири мають маслянисту консистенцію. Жири легко проходять через самі малі пори, тому їх зберігають в пергаментному папері. Температура плавлення жиру визначається процентним вмістом твердих насичених кислот. Температура твердіння на 5-10° нижче їх І плавлення. Температура димоутворення (максимальна температура, котру може витримати жир не згораючи). Найвищу температуру димоутворення має кухонний жир (230°). Жири не розчинні в Н2О, ну розчинні в органічних розчинниках. Жири погані провідники тепла. Жири мають високу теплоутворюючу здатність. При смаженні може відбуватись угар жиру, тобто його трата (розбризкування, димоутворення, поглинання його продуктами). Жири здатні емульгувати. Більшість продуктів харчування є емульсіями: молоко, вершкове масло, маргарин, майонез, морозиво та інші. Хімічні в ластивості: 1. Гідроліз або омилення жирів. Застосовується 4 основні способи гідролізу жирів: водою, мінеральними кислотами, лугами, ферментами. а) водою
тригліцерид гліцерин карбонова кислота б) омилення лугів. Омилення ферментами відбувається в кишечнику людини і тварини під дією ферменту ліпази. Процес гідролізу має місце в процесі їх зберігання і є причиню їх псування. СН2 – О - СОR СН2ОН
тригліцерид гліцерин мило Гідрогенізація жирів. При цьому рідкі жири переходять в рідкий стан.
 СНОСОС17Н33 + 3Н2 СНОСОС17Н33 СНОСОС17Н33 + 3Н2 СНОСОС17Н33
Тверді гідрогенізовані жири мають перевагу перед рідкими: вони зручніші при транспортуванні, більш стійкі при зберіганні, мила твердих кислот кращі по якості. Маргарин являє собою очищений гідрогенізований жир, змішаний з різними харчовими добавками: рослинним маслом, молоком, вершками, яйцями, вітамінами и таке інше. Жири і масла можуть окислюватись безпосередньо киснем повітря, а також при нагріванні. Прискорить окислення ряд факторів: світло, вологість, підвищення температури, наявність деяких металів (Ре, Со, РЬ).
Питання 4. Йодне число. Кислотне число. Фізико-хімічні константи жирів. Кислотне число, або коефіцієнт кислотності» показує скільки вільних жирних кислот міститься в жирі. Воно виражається числом МГ КОН, яке витрачається на нейтралізацію вільних кислот в 1 г. жиру. Кислотне число служить показником свіжості жиру. Йодне число, показник ненасиченості жиру, визначається кількістю грамів йоду, що приєднується до 100 г. жиру. Чим вище йодне число, тим більш ненасиченим є жир
Питання 5. Зміна жирів при тепловій обробці. З жирами при нагріванні відбуваються різні перетворення, характер їх залежить від складу жиру, часу нагрівання і температури. В процесі варки і жарки відбувається гідроліз. Крім того при жарінні змінюються і самі продукти гідролізу. Гліцерин дегідрується і перетворюється в ненасичений альдегід - акролеїн, чим і обумовлений неприємний запах і сльозоточивість від кухонного чаду.
акролеїн
Кислоти жирів можуть окислюватись з утворенням оксидних, пероксидних форм і різних низькомолекулярних сполук, придаючи жиру неприємний смак. При тривалому нагріванні жирів з ними відбуваються глибокі хімічні зміни.
Питання 6. Види псування жирів. Розрізняють 3 основні види псування жирів. 1. Прокисання є. початковою стадією псування жирів. Воно пов'язане лише з гідролізом жиру, який призводить до накопичення жирних кислот, які придають кислий присмак. 2. Прогіркання пов'язане в першу чергу з окисненням ненасичених жирних кислот, які знаходяться в вільному і зв'язаному стані. Кінцевими продуктами окислення є низькомолекулярні сполуки: кислоти, альдегіди, кетони і інші сполуки, яка придають жирам гіркий смак. При енергійних процесах можуть окислюватись і насичені кислоти. 3. Осалення - найбільш глибокий процес псування жирів. Воно пов'язане з окисленням ненасичених кислот до оксикислот. В процесі осалення змінюється консистенція жиру, підвищується температура плавлення, жир знебарвлюється і набуває салистий присмак. Процесу осалення сприяє прогіркання, Осаленний жир не може бути використаний як харчовий продукт: його використовують лише в технічних цілях. Питання і вправи. 1. Написати структурну формулу гліцериду, утвореного масляною, пальметиновою і стеариновою кислотами. 2. Напишіть структурну формулу пальмітинодістеарину. 3. Напишіть структурну формулу стеаропальмітиноолеїна. 4. Напишіть рівняння реакції гідролізу олеолінолеостеарина, назвіть отримані речовини. 5. Які речовини можна використати для розчинення жирів? 6. Яким шляхом одержують жирові емульсії і де вони використовуються?
Самостійна робота № 7. Тема: Жироподібні речовини. Мила і синтетичні миючі засоби План 1. Фосфатиди: хімічна природа, біологічне значення, використання в промисловості. 2. Воски: склад, розповсюдження в природі. Значення. 3. Мило і синтетичні миючі засоби.
Література 1. Черних В.П., Грищенко В. М., Єлисєва Л.І. Органічна хімія: підручник для студентів вищих навчальних закладів I – II рівнів акредитації. К.: Либідь, 2004 – с. 156– 171, 176. 2. Гурецька В.Л. Органічна хімія. М.: Вища школа, 1983 - с. 171-176.
Питання 1. Фосфатиди: хімічна природа, біологічне значення, використання в промисловості. Жири, які входять до рослинних і тваринних тканин і добуваються з них, містять у своєму складі, крім гліцеридів (хімічно чистих жирів), ряд сопутніх речовин - жироподібних (ліпіди) і нежироподібних. До жироподібних речовин відносяться такі сполуки, які, подібно жирам, являють собою складні естери. Але ці складні естери можуть бути утворені різними спиртами і кислотами. Найбільш поширені в природі жироподібні речовини фосфатиди, або фрсфоліпіди, стериди і стероли. Близькі до цих сполук і воски. Фосфатиди - складні естери гліцерину, утворені з участю жирних кислот і фосфорної кислоти. Якщо останню естерифіцірувати аміном чи спиртом, то такий фосфатид називається лецетином:
дігліцерид фосфатна кислота холін
лецетин
Лецетин міститься не тільки в жирах, але і в багатьох клітинах тваринного і рослинного організмів. Він входить до складу мозкових і нервових тканин, насіння і ростків рослин. Особливо його багато у яєчному жовтку і сої, звідки його і одержують. Чистий лецетин - біла маса, швидко жовтіє на повітрі. Легко гідролізує з утворенням гліцерину, жирних кислот, фосфорної кислоти і холіна. Розчиняється лецетин в спирті і ефірі. В воді не розчиняються, але набухає. утворюючи емульсії, томуйого використовують в якості емульгатора для виробництва маргарина, майонеза. Стериди - складні естери одноатомних поліциклічнихспиртів і жирних кислот. Стерини містяться в жирах не тільки в зв'язаному вигляді, але і в вільному стані. Вони поширені як в рослинному, так і в тваринному світі. Найбільше значення із тваринних стеринів має холестерин, а із рослинних — ергостерин. Холестерину багато в мозковій речовині, печінці, нирках, шкіряному жирі. Підвищений вміст холестерину у крові визиває ряд захворювань (атеросклероз, холецистит.) Холестерин набухає у воді і при певних умовах дає стійкі емульсії. Питання 2. Воски: склад, розповсюдження в природі. Значення. Воски. Близькі по хімічній природі до жирів воски. Воски від гліцеридів відрізняються тим, що вони утворені не гліцерином, а одноатомним високомолекулярними спиртами, наприклад до складу спармацету входить складний естерцетилового спирту С16Н33ОН і пальмітинової кислоти, а до складу бджолиного воску - естермерицилового спирту С31Н63ОН і пальмітинової кислоти: С16Н33 – О – СО – С15Н31С31Н63 – О – СО – С15Н31 спарцит бджолиний віск Рослинні воски знаходяться на поверхні плодів, квітів, застерігаючи їх від висихання та частково захищають від проникання мікроорганізмів в середину.
|
||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 296; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.216 (0.012 с.) |

 H2N-CH2-CH2-CH2-СООН CH3-CH-CH2-СООН
H2N-CH2-CH2-CH2-СООН CH3-CH-CH2-СООН Більшість амінокислот – безбарвні кристалічні речовини, добре розчинні в воді, часто солодкі на смак. Водні розчини, за виключенням розчину глікокола, мають оптичну активність, так як в молекулах амінокислот знаходяться асиметричні атоми карбону, наприклад, Н
Більшість амінокислот – безбарвні кристалічні речовини, добре розчинні в воді, часто солодкі на смак. Водні розчини, за виключенням розчину глікокола, мають оптичну активність, так як в молекулах амінокислот знаходяться асиметричні атоми карбону, наприклад, Н СН3-С*-COOH
СН3-С*-COOH





 О Н О О Н
О Н О О Н

 Реакція іде за рахунок взаємодії аміногрупи одної кислоти з карбоксильною групою другої. При відщеплені від них виникає зв’язок -С-N-
Реакція іде за рахунок взаємодії аміногрупи одної кислоти з карбоксильною групою другої. При відщеплені від них виникає зв’язок -С-N-
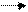
 С2Н2 СН3CHО CН3СООH ClCH2 – COOH NH2-CH2-COOH
С2Н2 СН3CHО CН3СООH ClCH2 – COOH NH2-CH2-COOH








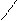

 СНОН СН2 = СН - С
СНОН СН2 = СН - С СН2ОН Н
СН2ОН Н




