
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема: Хімічні властивості полісахаридів.Содержание книги
Поиск на нашем сайте
План 1. Хімічні властивості крохмалю. 2. Хімічні властивості целюлози. Література: 1. Черних В.П., Грищенко В. М., Єлисєва Л.І. Органічна хімія: підручник для студентів вищих навчальних закладів I – II рівнів акредитації. К.: Либідь, 2004 – с. 207 – 210. 2. Гурецька В.Л. Органічна хімія. М.: Вища школа, 1999 – с. 196 – 207. Питання 1. Хімічні властивості крохмалю. Крохмаль - хімічно малоактивна речовина, з йодом, за рахунок амілози, дає яскраво-синє забарвлення, що зникає при кип'ятінні і знову з'являється при охолодженні. Амілопектин з йодом дає фіолетове забарвлення. Найбільш важливими хімічними властивостями крохмалю є: гідроліз, декстринізація і клейстеиізація. Гідроліз крохмалю може відбуватися при нагріванні в присутності кислот (кислотний гідроліз), а також під впливом ферментів (ферментативний гідроліз). При кислотному гідролізі амілоза і амілопектин діють однакові продукти. Процес гідролізу крохмалю відбувається ступінчато по схемі:
де n, m, х - число залишків молекул глюкози. Кінцевим продуктом кислотного гідролізу крохмалю є глюкоза.
крохмаль α-Д-глюкоза
Продукти гідролізу крохмалю розрізняють по йодній реакції і по розчинності. Розчинний крохмаль з йоду дає синє забарвлення, декстрини - від фіолетового до жовтого. Мальтоза і глюкоза йодом не забарвлюються. Розчинний крохмаль розчиняється в гарячій воді, а всі останні продукти гідролізу і холодній. Хімічні властивості целюлози. Клітковина має велику механічну і хімічну стійкість; вона не розчинна у воді, спирті, ефірі, кислотах. Розчиняється в реактиві Швейцара. Целюлоза добре горить, утворюючи СО2 і Н2O. При термічній обробці без доступу повітря отримують деревне вугілля, воду і ряд органічних сполук, наприклад метанол, ацетон, оцтову кислоту. При нагріванні з концентрованими кислотами H2SO4 і НСl клітковина підлягає гідролізу:
амілоїд глюкоза
Гідроліз відбувається поступово. При нетривалій дії концентрованої Н2SO4 клітковина переходить в амілоїд, який синіє від йоду. Амілоїд використовують в техніці для приготування пергаментного паперу. При тривалій дії мінеральних кислот клітковина переходить в гідроцелюлозу - крихка речовина, легко перетворюється в порошок.
Самостійна робота № 17 Тема: Білки План 1. Принцип поліпептидної теорії будови 2.Фізичні властивості білків. 3.Класифікація білків по складу і будові 4.Основні білки продуктів харчування 5.Повноцінні білки продуктів харчування
Література 1. Гурецька В.Л. Органічна хімія М.: Вища школа. 1983, с.230-243. Питання 1. Принцип поліпептидної теорії будови Білкові речовини займають особливе місце серед всіх органічних сполук. Вони являються носіями життя і виконують в живих організмах самі різноманітні функції. Із них складається основна маса протоплазми клітин вони виконують каталітичні, будівельні, енергетичні, обмінні, захисні та інші функції. Класичне визначення зв'язку життя з білками доводив Ф.Енгельс: "Життя є спосіб існування білкових тіл...".
Питання 2.Фізичні властивості білків Білками називаються природні полімерні речовини, що складаються із залишків L-амінокислот. Амінокислоти в білках зв'язані пептидними зв'язками
деR Фізичні властивості білків Білкові речовини різноманітні: рідкі, напіврідкі, тверді. Деякі білки мають консистенцію в'язких рідин або драглів. Молекулярна маса білків коливається від десятків тисяч до мільйонів вуглецевих одиниць. При високій температурі всі білки згорають. При цьому з'являється специфічний запах паленого волосся. Білки не мають температури плавлення і кипіння, так як більшість із них при нагріванні звертаються. Вони є оптично активними речовинами. Розчинність білків теж різна. Деякі з них нерозчинні, а деякі розчиняються, але в залежності від властивостей в різних розчинниках. В розчинах білки проявляють багато властивостей колоїдних систем: вони здатні адсорбувати на своїй поверхні, переходити в залежності від температури із рідкого стану (Золя) в желеподібне (гель). Всі білки важко кристалізуються. В тваринних клітинах білка міститься більше ніж в рослинних. Добова потреба людини в білках 100-150 г. Джерело білка - їжа. Питання 3.Класифікація білків по складу і будові. До складу білків входять п'ять основних елементів в %: С-50-55, Н-6, О-21, 5-23, N-15-18, S-0, 3-2, 5. Деякі білки містять Р, Fе, Сu, галогени. При гідролізі білків, виявляють 20-30 різних L-амінокислот. Білки побудовані більш складніше ніж поліпептиди. По будові макромолекули розрізняють фібрільярні і глобулярні. В перших поліпептидні ланцюги розтягнуті, а в другому ці ланцюги упаковані більш компактно, інколи в клубок, або звернуті у вигляді спіралі. В складній структурі макромолекули білка розрізняють декілька рівнів організацій: первинну, вторинну, третинну і четвертинну структури. Первинна структура являється основою будови білка. Вона визначає характер поліпептидного ланцюга і залежить від того, які амінокислоти і скільки входять до складу даного поліпептиду і від послідовності чергування амінокислотних залишків. Вторинна структура характеризує стан поліпептидного ланцюга в просторі. Ці ланцюги скручені в циліндричну спіраль, окремі витки якою утримуються багатьма водневими зв'язками з участю гідрогену аміногрупи і атома оксигену групи СО. Водневі зв'язки слабкіші ковалентних, але так як їх по довжині поліпептидного ланцюга багато, то вони в цілому утворюють стійку структуру. Третинна структура визначає конфігурацію макромолекули білка. Вона представляє собою тим чи іншим чином звернуту спіраль і обумовлена виникненням між окремими ділянками поліпептидних ланцюгів нових ковалентних зв'язків. Підчетвертинною структурою білка розуміють просторове розміщення самих глобул. Свою біологічну функцію білки виконують тільки якщо зберігається вторинна і третинна структура. Руйнування третинної і вторинної структур називається денатурацією білка. При денатурації білка зберігається тільки первинна структура білка. Класифікація білків Білки діляться за будовою на глобулярні і фібрилярні, а за складом на протеїни (прості білки) і протеїди (складні). Прості білки складаються лише із залишків амінокислот, а складні містять ще речовини небілкового характеру. У фібрилярних білків окремі поліпептидні ланцюги розтягнуті, а у глобулярних ланцюги упаковані більш компактно, інколи у клубок, а бо у вигляді спіралі. Питання 4.Основні білки продуктів харчування Повноцінні білки харчування. Білки харчових продуктів в залежності від амінокислотного складу бувають повноцінні і неповноцінні. Повноцінні білки містять усі незамінні амінокислоти. Важливо теж їх співвідношення. Найкраща амінокислотна форма при співвідношенні триптофану, лізину і метіоніну з циститом як 1:3:3. Біологічно повноцінними є білки тваринного походження (білки м'яса, риби, молока, яєць). Із білків тваринного походження найбільш цінні містяться у сої, соняшнику, картоплі, гречаній крупі, квасолі, чечевиці, рисі. Основні білки продуктів харчування здібні розчинятися в розчинниках.
Питання 5. Повноцінні білки продуктів харчування До глобулярних протеїнів відносяться альбуміни, глобуліни, проламіни, глютеліни, гістони, протаміни. До фібрилярних протеїнів, широко розповсюджені у тваринних організмах, відносяться: фіброїн, кератин, колаген. Еластин. Чим більше у з'єднувальних тканинах м'яса колагену (і менше еластину), тим легше воно розм'якшується при варці і тим більше здібне давати драглисту масу. До протеїнів відносяться: фосфопротеїди, лико протеїди, глюкопротеїди. Основні білки деяких харчових продуктів
Контрольні питання 1. Які елементи входять до складу білків і як побудовані молекули? 2. Яке біологічне значення білків? 5. Які речовини утворюються при гідролізі білків? При яких умовах іде гідроліз і які ферменти його викликають? 6. На які групи і по яким ознакам ділять білки?
Самостійна робота № 18 Тема: Білки План 1. Хімічні властивості білків (розчинність, фактори, визиваючи звертання білка, гідроліз, кольорові реакції на білки) 2. Хімізм процесу гниття білків 3.3міна білків харчових продуктів при нагріванні
Література 1. Гурецька В.Л. Органічна хімія М.: Вища школа. 1983, с.230-243. Питання 1. Хімічні властивості білків (розчинність, фактори, визиваючи звертання білка, гідроліз, кольорові реакції на білки). Хімічні властивості Гідратація і денатурація Гідратація білків (поглинання води, набухання) відбувається за рахунок властивостей різних полярних груп білків утримувати (адсорбувати) молекули води. Внаслідок гідратації сухі білкові компоненти (мука, крупа) при кулінарній обробці набухають. Дегідратацією білків називають втрату білками води. Існує два види дегідратації: 1. Зворотна, наприклад сублімаційна сушка виробів, при яких сушений продукт зберігає свою структуру (перед вживанням його занурюють у воду). 2. Незворотна (при розмороженні м'яса, риби, при тепловій обробці продуктів). При денатурації зменшується здібність білків до гідратації. Вони легше піддаються гідролізу, покращується її атакуємість ферментами. 3. Осадження. Вони здібні осаджуватись, тобто виділятись із розчинів. Існує два основних типи осадження: - зворотне осадження - висолювання, коли білки після осадження можуть бути знову повернуті в розчин додаванням нової порції розчинника, наприклад води. Осадження білків визивають етиловим спиртом, ацетоном, мінеральними солями. При зворотному осаджені властивості білків не змінюються. - незворотне осадження (звертання) призводить до повної зміни внутрішньої структури білка - денатурація. Після незворотного осадження білок не можливо перевести знову в розчин. Денатурація супроводжується зміною фізичних і хімічних властивостей білків. Вона може бути викликана дією солей важких металів, лугів,. кислот, дубильних речовин, ультрафіолетових, рентгенівських променів, інтенсивної дегідратації при сушці або заморожені, механічних діях (збиванні, струшуванні), нагріванні. Незворотне осадження білків при нагріванні називають тепловою денатурацією. Питання 2. Хімізм процесу гниття білків Хімізм процесу гниття білків. Під дією мікроорганізмів білки можуть підлягати гниттю. Гниття - це розпад, глибоке розщеплення білка, супроводжуване утворенням пахнучих продуктів, а інколи й отруйних речовин. Гниття відіграє велику роль в круговерті речовин в природі. Процес гниття перебігає багато стадійно. Розклад білка починається з його гідролізу під дією протеолітичних ферментів. Подальший розклад білкових речовин відбувається під дією гнилісних бактерій. Одні з них енергійно розщеплюють білкову молекулу до полі пептидів і амінокислот (фенол, крезол, меркаптани, метан, водень). Отримані азотні і без азотні сполуки в залежності від умов підлягають подальшим перетворенням: при доступі кисню (аеробні умови) відбувається окислення цих сполук, їх повна мінералізація з утворенням аміаку, вуглекислого газу, води. Сірководню. При анаеробних умовах (при відсутності кисню) не відбувається повного окислення продуктів розпаду амінокислот і накопичуються прості органічні сполуки: аміни, спирти, кислоти. Амінокислоти можуть підлягати дальшим змінам і давати різні продукти реакції: кетокислоти, оксикислоти, ненасичені кислоти. Багато із цих речовин надають продуктам неприємний запах. Утворені при гнитті диамінокислоти можуть декарбоксилуватись з утворенням отруйних діамінів (кадаверін). Декарбоксилування - відщеплення СO2 від групи - СООН. Питання 3. 3міна білків харчових продуктів при нагріванні Зміна білків харчових продуктів при нагріванні. Температура, визиваюча денатурацію, визначається характером білка. Так, денатурація білків саркоплазми м?яса починається при 30-40°С, білка яйця - при 55°С. Додаток до білків сахарози або інших небілкових сполук підвищує температуру денатурації білка. Реакція середовища теж впливає значною мірою на денатурацію. В кислому і лужному середовищі денатурація відбувається при більш високій температурі, тобто термічна обробка продуктів супроводжується меншою гідратацією (продукт залишається більш соковитим). Тому в практиці кулінарії використовують такі прийоми як маринування, додавання кислих приправ. В залежності від початкової концентрації білка й його стану прийнято розрізняти слідуючи види звертання білків: - при невеликій концентрації білка утворюється піна (пластівці); - при великій концентрації білка утворюється желеподібна речовина (при варінні яйця); - якщо білок до нагрівання був у вигляді гелю, як наприклад, драглеподібний білок міофібрил м'яса, то він спочатку скорочується в об'ємі, а потім виділяє частину рідини. М'язові волокна при цьому ущільнюються і міцність їх підвищується. При тепловій денатурації значно змінюються і фібрилярні білки (колаген, еластин). Фібрилярна структура білка руйнується, волокна стають скловидними (зварюються). Вони скорочуються в довжину у 3-4 рази і значно збільшуються в об'ємі. При тривалому нагріванні білку відбувається повна його руйнація молекули білка - так звана деструкція колагену. Волокна коллагена стають менш міцними, більш еластичними. Частина коллагена переходить у добре розчинний білок глютин. Розчин глютину при охолодженні застигає. Денатурований колаген і глютин, як і глобулярні білки, легко розщеплюється протеолітичними ферментами. При деструктації білка утворюються речовини, що надають продукту специфічний аромат і смак. Контрольні питання 1. В чому заключається процес коагуляції білків і які фактори викликають коагуляцію? 2. Якими кольоровими реакціями можна відкрити білки? 3. Які речовини утворюються при гідролізі білків? При яких умовах іде гідроліз і які ферменти його викликають? 4. В чому заключається процес гниття білків? Які речовини утворюються при аеробному і анаеробному гнитті?
Самостійна робота № 21
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 113; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.134.196 (0.013 с.) |



 Крохмаль розчинний крохмаль ряд декстринів мальта глюкоза
Крохмаль розчинний крохмаль ряд декстринів мальта глюкоза

 (С6Н10О5)n (С6Н10О5)m (С6Н10О5)х С12Н22О11 С6Н12O6
(С6Н10О5)n (С6Н10О5)m (С6Н10О5)х С12Н22О11 С6Н12O6  (С6Н10О5)n + nН2O nС6Н12O6
(С6Н10О5)n + nН2O nС6Н12O6 
 (С6Н10О5)n + хН20 (С6Н10О5)n С6Н12O6
(С6Н10О5)n + хН20 (С6Н10О5)n С6Н12O6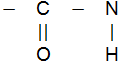 . Структура такого ланцюга білкового полімеру можна представити таким чином:
. Структура такого ланцюга білкового полімеру можна представити таким чином:
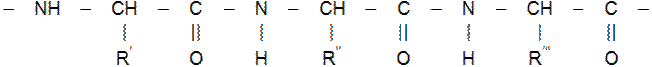
 ,R
,R  , R
, R  - бокові радикали однакових або різних α-амінокислот.
- бокові радикали однакових або різних α-амінокислот.


