Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Високомолекулярні жирні кислоти.Содержание книги
Поиск на нашем сайте Високомолекулярні карбонові кислоти. Найбільше значення мають кислоти нормальної будови: пальмітинова СН3 - (СН2)14 - СООН (або С15Н31СООН); стеаринова СН3 - (СН2)16 - СООН (або С17Н35СООН) Вони знаходяться у вигляді гліцеринів майже в усіх тваринних і рослинних жирах. Практично ці кислоти виділяються із жирів. Значну частину їх отримують окисленням парафінів. Із 1000 кг парафінів виділяють 600-700 кг вищих кислот. Всі вищі насичені кислоти - безбарвні, тверді, не мають певного запаху і смаку, в воді нерозчинні, але розчиняються в спирті і ефірі. Розчиняються і в водних розчинах їдких лугів, утворюючи солі.
Натрієві і калієві солі вищих жирних кислот розчинні в воді і представляють собою мило: солі лужноземельних металів (Са, Ва, Мq), а також важких металів в воді нерозчинні. Суміш пальмітинової і стеаринової кислот використовується для виробництва свічок. Вищі кислоти, отримані із нафти, застосовуються в виробництві мила, гуми, лінолеуму, змащувальних масел і інше.
Вищі ненасичені жирні кислоти. Найбільше значення із цього класу мають олеїнова, лінолева, ліноленова. Всі вони рідкі, входять до складу різних природних жирів і олій. Олеїнова кислота С17Н33-СООН - містить один подвійний зв'язок між 9 і 10 атомами карбону: СН3 - (СН2)2 - СН = СН - (СН2)7 - СООН Зустрічаються у вигляді 2-х ізомерів цис і транс-ізомерів. Олеїнова кислота - безбарвна рідина, затвердіває на холоді (tпл. = 14°С, tкип.=223°С), входить до складу майже всіх жирів. Має властивості ненасичених сполук. Вона легко гідрується і переходить в тверду стеаринову кислоту
Ця реакція має велике значення при отриманні твердого жиру із рідкого. С7Н33СООН може приєднувати бром (знебарвлює бромну воду). Вона окисляється по місту подвійного зв'язку (змінює забарвлення розчину КМnO4) до 9, 10 діоксістеаринової кислоти. Калієві і натрієві солі алеїнової кислоти (мило) знаходять застосування в техніці Лінолева кислота С17Н31 - СООН - має два подвійних зв'язки: СН3 - (СН2)4 - СН = СН - СН2 - СН = СН - (СН2)7 - СООН Вона рідка, tпл. = 5°С. Входить до складу рослинних олій. При гідруванні переходить в тверду стеаринову кислоту. Легко окисляється і полімеризується. Ліноленова кислота Сі7Н29СООН - найбільш ненасичена кислота, має три подвійні зв'язки: СНз - СН2 - СН = СН - СН2 - СН = СН - СН2- СН = СН- (СН2)7 - СООН По властивостях аналогічна лінолевій кислоті і також знаходиться переважно в рідких рослинних оліях. Лінолева і ліноленова кислоти необхідні для організму, але в ньому вони не синтезуються і повинні поступати з їжею. Тому ці кислоти відносяться до незамінних. Контрольні питання 1.Вкажіть сполуки, що мають цис і транс-ізомери: а) СН3 - СН = СС1 - СН3 б) СНз - СН - СС1 - СООН в) СНз - СС1 - СС1 - СООН г) СНз - (СН2)2 - СН = СН (СН2)7 - СООН 2. Вкажіть сполуку,яка широко застосовується в харчовій промисловості:
3. Напишіть рівняння реакції утворення рідкого і твердого мила стеариновою кислотою. 4. У кажіть формули нерозчинних у воді кислот: а) С17Н35СООН б) С15Н31СООН в) С15Н11СООН г) С3Н7СООН д) С4Н9СООН Назвіть ці кислоти. 5. Напишіть рівняння реакції взаємодії олеїнової кислоти з бромною водою. Самостійна робота № 14 Тема: Аміни
План 1. Аміни: мокоаміни, діаміни. 2. Властивості, поширення в природі, утворення в продуктах харчування. Література 1. Черних В.П., Грищенко В. М., Єлисєва Л.І. Органічна хімія: підручник для студентів вищих навчальних закладів I – II рівнів акредитації. К.:Либідь, 2004 – с. 209 - 216 2. Гурецька В.Л., Органічна хімія, М., Вища школа, 1999 - с. 123 -127.
Питання 1. Аміни: мокоаміни, діаміни. Амінами називаються похідні аміаку, в котрому один, два або всі три атоми гідрогену заміщені на радикали. В залежності від числа радикалів аміни розрізняють: первинний R-NH2 СН3 - NН2 СН3-СH2-NH2 метиламін етиламін вторинний R'-NН-R" СН3 - NН – СН3 СН3-NН-С2Н3 диметилаламін метилетиламін третинний R'-N-R" СН3 - N – СН3 СН3-N-С2Н3 | | | R СН3 С3Н7 триметил аламін метилетилпропіламін Радикали, що входять до складу амінів, можуть бути однаковими і різними. Група -NH2 у первинних амінах називається аміногрупою, група - NН у вторинних амінів - іміногрупою. Назва амінів походить від назви радикалів з добавленням слова „амін". Аміни можуть містити декілька аміногруп з двома аміногрупами - діаміни, з трьома - триаміни. Наприклад:. H2N-СН2–СH2-СH2-СH2-NH2 (тетраметилендіамін) Питання 2. Властивості, поширення в природі, утворення в продуктах харчування. Властивості амінів. Нищі аміни: метиламін, диметиламін, триметиламін - гази, які мають запах аміаку; середні члени ряду амінів - рідини із слабким запахом; вищі - тверді речовини без запаху. Газоподібні аміни добре розчинні у воді; із збільшенням їх молекулярної ваги розчинність зменшується, а вищі аміни у воді не розчиняються. Аміни повторюють хімічні властивості аміаку,розчиняючись у воді, вони утворюють основи.
метиламін гідратокису метиламонію
Диметиламін гідратокису диметиламіну Таким чином, водні розчини амінів є органічними основами. При взаємодії з кислотами аміни утворюють солі:
метиламін хлористий метиламін хлористоводневий метиламін Солі амінів повторюють властивостей солей амонію і як і вони, дисоціюють на іони:
Тому їх водні розчини проводять електричний струм. Відрізняються від аміаку аміни тим, що горять на повітрі. При дії нітратної кислоти на первинні аміни відбувається виділення вільного азоту і утворення спирту.
Одержання амінів. Аміни широко розповсюджені в пре роді. Вони є нормальними продуктами обміну речовин живих організмах. Зустрічаються в деяких рослинах: лободі, гльоді. Утворюються при гнитті риби, міститься в оселедцевому розсолі. Первинні аміни можна одержати дією галогеналканів на аміак, вторинні - на первинний амін, третинний - на вторинний амін. а) отримання первинного аміну
б) отримання вторинного аміну
Окремі представники амінів. Метиламін СНзNН2 - газ із запахом аміаку, добре розчинний у воді. Утворюється при гнитті риби, при сухій перегінці кісток. Міститься в деяких рослинах. Диметиламін СНз - NН — СНз - газоподібна речовина з запахом аміаку, добре розчиняється у воді. Утворюється при гнитті риби, міститься в оселедцевому розсолі. Триметиламін (СН3)3N — газоподібна речовина з запахом аміаку і гнилої риби. Міститься в оселедцевому розсолі, в листках рослин (лободі, гльоді) в виділеннях пітних залоз і сечі. Діаміни. Діаміни утворюються при гнитті білкових речовин. Вони мають явно виражені лужні властивості. Путресцин, або тетраметилендіамін - 1.4 NН2 - СН2- СH2- СH2- СН2- NН2 виявлений вперше був у гноєві. Це кристалічна речовина. Кадаверін, або пентаметилендіамін -1.5 NH2-(СН2)5-NН2 Був знайдений в розлагаючих групах. Це рідина, t кипіння =178oС. Путресцин і кадаверін утворюються в результаті життєдіяльності багатьох бацил (стовбняка, холери) і грибків, зустрічаються в сирі, спорин'ї, мухоморі, пивних дріжджах.
Контрольні питання 1. Із приведених нижче формул речовин випишіть формули амінів і дайте їм назви:
2. Складіть рівняння реакцій, підтверджуючі основні властивості амінів.
Самостійна робота № 19 Тема: Замінники цукру План 1. Замінники цукру: сахарин, сорбіт, їх будова. 2. Отримання та застосування замінників цукру. Література 1. Черних В.П., Грищенко В. М., Єлисєва Л.І. Органічна хімія: підручник для студентів вищих навчальних закладів I – II рівнів акредитації. К.:Либідь, 2004 – с. 210 – 223. 2. Гурецька В.Л., Органічна хімія, М., Вища школа, 1999 - с. 243 -249. Питання 1. Замінники цукру: сахарин, сорбіт. Сахарин - імід ортосульфобензойної кислоти - є продуктом заміщення в ортосульфобензойній кислоті гідроксильної групи карбоксилу і сульфогрупи на імуногрупу NН. Випускається у вигляді кристалогідрату натрієвої солі - кристалози.
Сам сахарин - кристалічна безбарвна речовина, температура плавлення = 225°С, погано розчинна в воді. Кристалоза ж добре розчиняється в воді. Солодкий смак сахарину відчувається при розведенні в воді в співвідношенні 1: 100000. Сахарин приблизно в 400-500 разів солодше цукру. Організмом людини він не засвоюється.
Питання 2. Отримання та застосування замінників цукру. Харчовий сорбіт С6Н8(ОН)6 та ксиліт С5Н7(ОН)5 - насичені ациклічні багатоатомні спирти - кристалічні речовини, розчинні в воді, хімічно реакційно-здібні, солодкі на смак. На відміну від сахарину є поживними речовинами. По калорійності майже рівноцінні цукру, не шкідливі для діабетиків, тому широко використовуються в виробництві різних кондитерських виробів для хворих діабетом. Крім того, ці спирти дуже гігроскопічні, що дає можливість використовувати їх в якості стабілізаторів вологи. Сорбіт застосовується в кондитерському виробництві для запобігання виробів від висихання. Він є сировиною при синтезі аскорбінової кислоти.
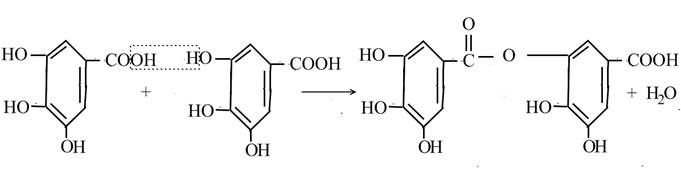
Самостійна робота № 20 Тема: Дубильні речовини План 1. Загальне поняття про дубильні речовини. 2. Властивості деяких представників дубильних речовин. Література 1. Черних В.П., Грищенко В. М., Єлисєва Л.І. Органічна хімія: підручник для студентів вищих навчальних закладів I – II рівнів акредитації. К.:Либідь, 2004 – с. 155 – 157. 2. Гурецька В.Л., Органічна хімія, М., Вища школа, 1999 - с. 243 -249. Питання 1. Загальне поняття про дубильні речовини До дубильних речовин відносять цілий клас рослинних речовин, які мають в'яжучий смак, здібні осаджувати білки і перетворювати сиру шкіру в дублену. Вони знаходяться в багатьох рослинах: в корі іви, в наростах листків дубу (чорнильні горішки). Порівняно в великій кількості знаходяться в чаї, надаючи йому гіркий, в'яжучий смак. В'яжучий смак «терпких» вин не обумовлений наявністю дубильних речовин. Особливо багаті дубильники речовинами тропічні рослини. Питання 2. Властивості деяких представників дубильних речовин Поширеною в природі дубильною речовиною є танін. Існує декілька типів таніну. Більшість із них при повному гідролізі розбавленою сульфатною кислотою розщеплюються на глюкозу і галлову кислоту, остання входить в молекулу Танина в основному у вигляді дігалловой кислоти:
галлова кислота галлова кислота М-дигаллова кислота
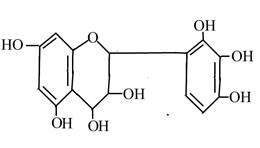
Танин має велику молекулярну вагу. Він представляє собою слабо-жовтий амфотерний порошок, легко розчинний в воді, має в'яжучий смак. В'яжуча дія танину обумовлена його здібністю звертати білки - давати з ним альбумінати (нерозчинні речовини). На цій властивості основана його використання для дублення шкір: білки шкури тварини в розчині Танину звертаються, переходячи в нерозчинний стан, і утворює шкіру. Танин використовують в медицині як засів, звертаючи кров. Його розчини осаджують ядовиті алкалоїди. Примочки із спиртового розчину Танину можуть попередити утворення пухирів при опіках. Танин використовують для виробництва кращих сортів чорнил, так як з хлоридом заліза(2) дає стійке фіолетове забарвлення. Танин і інші дубильні речовини застосовують як протрави при фарбуванні тканин, для освітлення виноградних вин. Дубильними речовинами рослинного походження являються і катехіни - речовини фенольного характеру, що знаходяться в чаї, фруктах.
Чайний кахетін
Самостійна робота № 23 Тема. Складні естери
План 1. Будова і поширення в природі. 2. Номенклатура. 3. Способи отримання. 4. Фізичні і хімічні властивості. 5. Застосування. Література 1. Черних В.П., Грищенко В. М., Єлисєва Л.І. Органічна хімія: підручник для студентів вищих навчальних закладів I – II рівнів акредитації. К.:Либідь, 2004 – с. 155 – 168. Питання 1. Будова і поширення в природі.
Загальна формула складних естерів:
До складу складних естерів можуть входити залишки низькомолекулярних, високомолекулярних, насичених і ненасичених, органічних кислот і спиртів. Складні естери одноатомних спиртів і низькомолекулярних карбонових кислот широко розповсюджені в природі, Багато з них входять до складу ефірних олій. Питання 2. Номенклатура. Номенклатура. Частіше всього назва складних естерів утворюється від назви кислоти і спирту, їх утворюючих. Інколи називають із найменування радикала спирту і кореня латинської назви кислоти із доданням до нього закінчення - ат.
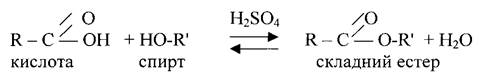
Питання 3. Способи отримання. 1. Добувають із природних продуктів. 2. Реакцією етерифікації
Питання 4. Фізичні і хімічні властивості. Фізичні властивості. Складні естери низьких і середніх гомологів кислот і спиртів - безбарвні рідини, легші води. Багато з них мають приємний аромат плодів, ягід фруктів. В воді навіть низькомолекулярні естери розчиняються погано, в органічних розчинниках вони добре розчиняються. Хімічні властивості. Найбільш характерні для складних естерів слідуючі реакції. 1. Гідроліз - реакція зворотна
2.Відновлення. При відновленні складних естерів утворюються два спирта
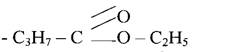
Питання 5. Застосування. Застосування. Ряд складних естерів, як оцтово етиловий естер СН3 - СОО - С2Н5 і оцтово ізоаміловий СН3 - СОО - С5Н11 використовуються як розчинники деяких пластмас, нітроцелюлозних лаків. Ізоамілацетат застосовують в парфумерії і в харчовій промисловості.
Контрольні питання 1. Написати рівняння реакції отримання мурашинометилового естеру, виходячи із метану, використовуючи всі необхідні для цього речовини. 2. Написати рівняння реакції гідролізу слідуючи естерів: а)масляноетилового; б)мурашинопропілового; в)оцтовоемілового
3. Отримали 200 г оцтовоетилового естеру, що складає 80% до теоретичного виходу; Скільки грамів оцтової кислоти і мілілітрів етилового спирту витрачено? (ρ (С2Н5ОН) = 0,791 г/мл3
Самостійна робота № 27 Тема: Алкалоїди
План 1. Загальне поняття. 2. Представники: кофеїн, теобромін, нікотин. Властивості, розповсюдження в природі. Література 1. Черних В.П., Грищенко В. М., Єлисєва Л.І. Органічна хімія: підручник для студентів вищих навчальних закладів I – II рівнів акредитації. К.:Либідь, 2004 – с. 148 – 154.
Питання 1. Загальне поняття. Алкалоїдами називають органічні основи, які зустрічаються в рослинах. По своїй хімічній природі більша частина алкалоїдів відноситься до азототовмісних гетероциклічних сполук. Для тварин і людини алкалоїди, як правило; являються сильною отрутою, але в малих дозах, багато із них застосовуються як ліки. Алкалоїди - кристалічні речовини гіркого смаку, лише деякі із них - рідини (коніїн, нікотин), Рідкі алкалоїди не містять оксигену, погано розчиняються у воді. Зараз відомо більш 600 алкалоїдів, одначе хімічна будова встановлена далеко не для всіх. У вигляді солей щавлевої, яблучної, винної, лимонної та інших, вони містяться у деяких рослинах сімейства макових, лютикових, бобових, напр. хінін — у корі осинових дерев. Питання 2. Представники: кофеїн, теобромін, нікотин . Із алкалоїдів, які входять до складу харч, прод., слідує виділити кофеїн, теобромін, нікотин. Кофеїн - кристалічна речовина (tплав. = 237°С), має сильну збуджуючу дію на центральну нервову систему і стимулює роботу серця.
кофеїн теобромін
Кофеїн і теобромін відрізняються від інших алкалоїдів тим, що вони є не отруйними речовинами, кофеїн міститься у ряді харч, прод.: у листовому чаї, зернах кофе, какао, горіхах кола, отримують його із чайного пилу. Чайний кофеїн називається теїном. Відрізняється від кофеїну, кави, тим, що не затримується в організмі і не отруює його. Теобромін входить до складу зерен какао і міститься в какаопродуктах. Обидва алкалоїди в невеликих дозах збуджують і стимулюють нервову систему, підвищують працездатність. Вмістом цих алкалоїдів^ у багатьох випадках визначають харчову цінність чаю, кави, какаопродукт Нікотин - головний алкалоїд табака, в якому він знаходиться у вигляді солей лимонної і яблучної кислот.
нікотин Нікотин - сильна отрута. Це безбарвна масляниста рідина, tкип. = 247°С, є сильною отрутою. Невелика кількість його збуджує нервову систему. Нікотин застосовується в боротьбі із шкідниками с\г. Для людини смертельна доза біля 40мг.
Контрольні питання 1. До якої групи орг. сполук відносяться алкалоїди? В чому особливості їх будови? 2. Як алкалоїди розповсюджені в природі? 3. Як впливають алкалоїди на організм людини? 4. Які алкалоїди знаходяться у продуктах харчування? 5.-Які харчові продукти містять кофеїн і теобромін? Яка фізіологічна дія цих алкалоїдів? 6. Де зустрічається нікотин та яка його дія на живі організми? 7. З якою метою використовують алкалоїди в медицині? Приведіть приклади таких алкалоїдів.
Самостійна робота № 27 Тема: Вітаміни План 1. Вітаміни (В1; В2; РР1; С1; А1; Д) та їх значення для вітамінізації харчових продуктів. 2. Будова вітамінів. Вміст вітамінів у продуктах харчування. Відношення вітамінів до нагрівання.
Література 1. Черних В.П., Грищенко В. М., Єлисєва Л.І. Органічна хімія: підручник для студентів вищих навчальних закладів I – II рівнів акредитації. К.:Либідь, 2004 – с. 256 – 258. 2. Гурецька В.Л., Органічна хімія, М., Вища школа, 1983, стор. 254-257.
Питання 1. Вітаміни (В1; В2; РР1; С1; А1; Д) та їх значення для вітамінізації харчових продуктів. При вивченні цієї теми треба пам'ятати, що вітаміни відіграють велику роль в більшості життєвих процесів і що вони не утворюються в організмі, а повинні поступати до нього з зовні. Ознайомимося із класифікацією вітамінів і запам'ятайте основні види водорозчинних (вітаміни групи Н вітамін С Р і інших і жиророзчинних (А, Д, Е, К і т.д.) Вітамінів. Розглядаючи характеристику кожного з них, дотримуйтесь такого плану: 1) хімічна природа вітаміну; 2) розповсюдження в складі харчових продуктів; 3) зміна вітаміну при зберіганні і тепловій обробці продукту При вивчені вітаміну „С" зверніть увагу на те, що він найменш стійкий із всіх відомих вітамінів, так як легко окислюється киснем повітря, особливо при високій температури, в присутності катіонів заліза і міді. При вивчені вітамінів В1 тиаміна: В2-рибоофлавін відмітьте, що ці речовини відносяться до гетероциклічних сполук, мають атоми азоту в гетероциклічних сполук, мають атоми азоту в гетероциклах і обидва вони стійкі до нагрівання в кислому середовищі, але можуть руйнуватися в лужному середовищі і при дії ультрафіолетових променів. Із жиророзчинних вітамінів потрібно особливо чітко знати властивості вітаміну А (ретинол) і Д (кальціферол). Питання 2. Будова вітамінів. Вміст вітамінів у продуктах харчування. Відношення вітамінів до нагрівання. Запам'ятайте, що вітамін А являється одноатомнім ненасиченим спиртом і може бути отриманий гідролізом барвникової речовини каротину, що міститься в рослинах Слід пам'ятати, що вітамін А - теплостійка речовину, але руйнується при окислені, особливо на світлі. При вивчені вітаміну Д треба відзначити; що він має декілька біологічно активних ізомерів і стійкий до окисних процесів при нагріванні, а значить добре зберігаються в харчових продуктах при їх консервуванні і кулінарній обробці Вітаміни підвищують харчову цінність продуктів. тому треба звернути увагу на питання синтезу вітамінів і отримання їх мікробіологічними методами. При одержанні білково-вітамінних концентратів за допомогою мікроорганізмів.
Контрольні питання
1. Які речовини називають вітамінами? 2. На які групи поділяються вітаміни. 3. Які вітаміни відносяться до водорозчинних і жиророзчинних? 4. Яка хімічна природа вітаміну А. Де він зустрічається? Як впливає переробка харчових продуктів на збереження вітаміну „С". Які фактори прискорюють його руйнування? 5. Які вітаміни відносяться до групи В? Що загального складі і будові? Які продукти багата вітамінами В1, В2, РР? 6. До якої групи органічних сполук відноситься вітамін А? В яких харчових продуктах він зустрічається? Яким шляхом можна одержувати вітамін а із каротину? 7. Яка хімічна природа вітаміну Д? Які харчові продукти відрізняються високим вмістом вітаміну Д? 8. Як випиває переробка харчових продуктів на зберігання вітамінів А і Д? 9.-Які вітаміни можна одержати синтетичним шляхом за допомогою мікроорганізмів? Самостійна робота № 29
|
|||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 226; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.216 (0.014 с.) |

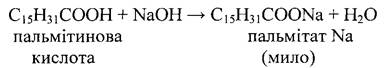
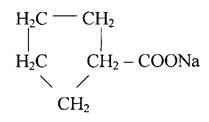 Нафтоневі кислоти - похідні аліциклічних вуглеводнів (нафтенів) циклогексана С6Н12 і циклопентана С5Н10. Найбільший практичний інтерес представляють солі нафтенових кислот, називаємі - милонафтами. Вони мають гарну миючу здібність. Одна із таких сполук є натрієва сіль циклопентан-карбонової кислоти.
Нафтоневі кислоти - похідні аліциклічних вуглеводнів (нафтенів) циклогексана С6Н12 і циклопентана С5Н10. Найбільший практичний інтерес представляють солі нафтенових кислот, називаємі - милонафтами. Вони мають гарну миючу здібність. Одна із таких сполук є натрієва сіль циклопентан-карбонової кислоти.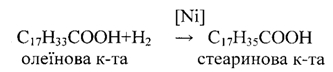
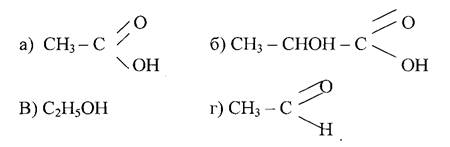
 СН3NH2 + НОН [СНз- NНз]ОН
СН3NH2 + НОН [СНз- NНз]ОН (СНз)2NH + НОН [(СНз)2 NH2]ОН
(СНз)2NH + НОН [(СНз)2 NH2]ОН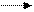 СНзNН2 + НС1 [СНзNH3]СІ або СНзNH2 HС1
СНзNН2 + НС1 [СНзNH3]СІ або СНзNH2 HС1 [(СНз)2NH2]С1 [(СНз)2NH2]+ + СГ
[(СНз)2NH2]С1 [(СНз)2NH2]+ + СГ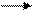 СНзNH2 + НОNО2 СНзОН + N2 + Н2О
СНзNH2 + НОNО2 СНзОН + N2 + Н2О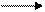 СНзСІ + NНз СНзNН2 HСІ
СНзСІ + NНз СНзNН2 HСІ СНзNН2 НС1 + NаОН СНз NH2 + NаСІ + Н2О
СНзNН2 НС1 + NаОН СНз NH2 + NаСІ + Н2О СНзNН2 + СНзСІ (СНз)2 NН HСl
СНзNН2 + СНзСІ (СНз)2 NН HСl (СНз)2NН НС1 + NаОН (СНз)2NH + NаСІ + Н2О
(СНз)2NН НС1 + NаОН (СНз)2NH + NаСІ + Н2О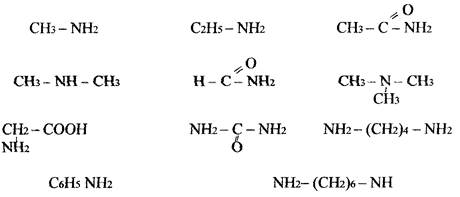

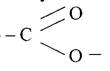 Складними естерами називаються сполуки молекули яких складаються із двох вуглеводневих радикалів, з'єднаних групою -
Складними естерами називаються сполуки молекули яких складаються із двох вуглеводневих радикалів, з'єднаних групою -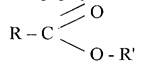
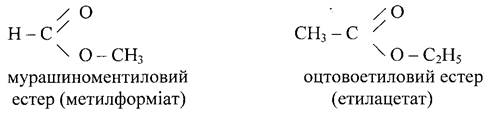

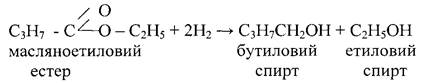
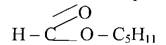 Складні естери, що мають запах плодів, ягід застосовуються в виробництві синтетичних фруктових есенцій. Наприклад, мурашиноаміловий естер – аромат вишні, оцтовоізоаміловий – запах груши, масляно етиловий – запах абрикос, ізовалеріаноетиловий – запах яблук
Складні естери, що мають запах плодів, ягід застосовуються в виробництві синтетичних фруктових есенцій. Наприклад, мурашиноаміловий естер – аромат вишні, оцтовоізоаміловий – запах груши, масляно етиловий – запах абрикос, ізовалеріаноетиловий – запах яблук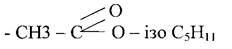
 -
-