Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хімічні властивості амінокислотСодержание книги
Поиск на нашем сайте
І. реакції по групі NH2-групу (як орг.основа) 1. реакція з кислотами NH2 – CH2 –COOH + HCl → [NH3 – CH2 –COOH]+ Cl-
ІІ. реакції по групі СООН (як орг.кислоти) 1. реакція дисоціації На відміну від карбонових кислот реакція дисоціації амінокислот відбувається одночасно і дисоціація амінокислот, і внутрішньо молекулярна нейтралізація, внаслідок якої утворюється диполярний йон (цвіттер-йон) NH2 – CH2 –COOH ↔ NH2 – CH2 –COO- + Н+ ↔ +NH3 – CH2 –COO- диполярний йон Реакція нейтралізації (реакція з лугами) NH2 – CH2 –COOH + NaOH → NH2 – CH2 –COONa + H2O
Реакції амінокислот з кислотами і лугами одночасно підтверджує їх амфотерність. Реакція етерифікації NH2 – CH2 –COOH + С2Н5ОН → NH2 – CH2 –COOС2Н5 + Н2О ІІІ. реакція амінокислот між собою (тільки для амінокислот) Амінокислоти взаємодіють між собою утворюючи пептиди. NH2 – CH2 –COOH + NH2 – CH –COOH → │ СН3 NH2 – CH2 – CO - NH – CH –COOH + Н2О │ СН3 дипептид Цією реакцією амінокислоти як амфотерні орг.сполуки відрізняються від амфотерних неорг.сполук (ZnO, Al2O3, Zn(OH)2, Al(OH)3).
Добування амінокислот. 1. реакція амінування моногалогензаміщених карбонових кислот ( для всіх амінокислот) CH2 –COOH + NH3 → NH2 – CH2 –COOH + HCl │ Сl 2. реакція гідролізу білків ( тільки для α--амінокислот ).
Застосування амінокислот 1. як будівельний матеріал для синтезу білків живих організмів; 2. для виготовлення лікарських речовин (штучні амінокислоти); 3. для підгодовлювання тварин. 4. із амінокапронової кислоти одержують синтетичне волокно - капрон
Білки (Протеїни) Білки – це природні полімери ( біополімери), які складаються з великої кількості залишків α-амінокислот, що зв’язані між собою пептидним СО-NH зв’язком (пептидною групою). До складу більшості білків входять 200-500 амінокислотних залишків(можливо і з 1500 і більше) Одержують білки реакцією поліконденсації α-амінокислот – це сполучення великої кількості α-амінокислот з утворенням молекули білка і води.
n NH2 – CH –COOH → (- NH – CH –CO-)n + (n-1)H2O │ │ R R α-амінокислоти білок
Загальна формула білків: (- NH – CH –CO-)n │ R Білки – це біологічно активні речовини («живі речовини» бо входять до складу живих організмів і можуть породжувати собі подібних). Білки за своєю природою є складні речовини і для них характерні такі структури:
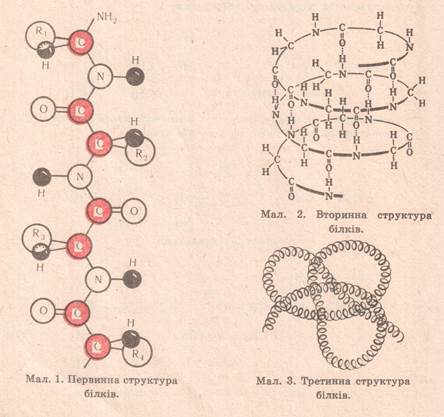
1. первинна структура – це послідовність розміщення залишків (20) α-амінокислот у молекулі білка. Вона існує за рахунок пептидного зв’язку (-СО – NH-). 2. вторинна структура – це скручування молекули білка у спіраль. Вона існує за рахунок водневих зв’язків, які утворюється між СО і NH групами двох паралельних витків цієї спіралі. 3. третинна структура – це скручування спіралі у глобулу (протомер). Вона існує за рахунок різних зв’язків: йонних, складноефірних(естерних), дисульфідних, гідрофобних. 4.четвертинна структура – це об’єднання кількох глобулу систему (мультимер). Вона існує за рахунок різних зв’язків, подібно як вторинні і третинні, тільки крім пептидного.
Починаючи з вторинної стуктури білки є біологічноактивні речовини («живі речовини»).
Хімічні властивості білків 1. денатурація білків – це руйнування аж до вторинної структури білка під дією таких факторів: температура, радіація, дія кислот і лугів, дія солей важких металів. Денатурація білка є оборотній процес при нетривалій дії цих факторів, а при тривалій дії – необоротній(з елементструкції) 2. ренатурація білків – це втрати вторинної структури білка при наявності деяких факторів: солей легких металів (KCl, NaCl, NH4Cl), апри відсутності цих факторів знову поновлюється вторинна структура білків. 3. реакція гідролізу білків – це взаємодія білка з водою внаслідок реакціїутворюються амінокислоти. Каталізатором реакції гідролізу є розчини кислот або лугів, а в організмі людини – під дією ферментів. Н+ або ОН-
(- NH – CH –CO-)n + (n-1)H2O → n NH2 – CH2–COOН │ ферменти │ R R Білок Амінокислоти Гідроліз білків є процес деструкції, бо утворюються амінокислоти і немає вже білка. Кольорові реакції на білки. А) ксантопротеїнова реакція – це дія на білок конц. HNO3, при цьому білок жовтіє. Цією реакцією визначають наявність у білка фенільного радикалу(С6Н5). Б) біуретова реакція – це дія на білок голубим осадом Cu(OH)2 при цьому білок одержує фіолетове забарвлення. Цією реакцією визначають наявність в білках пептидної групи (СО-NH-). В) цистеїнові реакція – це дія на білок Pb(NO3)2 при цьому білок чорніє. Цією реакцією визначають наявність в білках сульфідної групи (S).
Застосування білків 1. як будівельний матеріал живих організмів; 2. як харчовий продукт (штучна їжа); 3. як ліки (інсулін); 4. як добавки до кормів тварин.
|
||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 381; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.134.77 (0.008 с.) |