Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакція дегідрування(дегідрогенізації)Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Це реакція відщеплення молекули водню від алканів (починаючи з етану) і при цьому утворюється алкен і водень. Каталізатор – платина. С2Н6 → Н2 + С2Н4 етен ІІІ. реакція ізомеризації Починаючи з бутану нормальні (лінійні) алкани перетворюються в розгалужені алкани і навпаки. Каталізатор – сполуки Алюмінію.
С4Н10 С4Н10 1 2 3 4 1 2 3 СН3─СН2─СН2─СН3 → СН3─СН─СН3 Н.-бутан | 4СН3 ізобутан н. – бутан ізо бутан (2-метилпропан)
IV. реакція окиснення 1. реакція горіння (повне і неповне): Внаслідок реакції повного горіння вуглеводнів утворюється завжди СО2 і Н2О. C3H8 + 5О2 → 3CО2 + 4H2О повне окиснення (2C3H8 + 7О2 → 6CО + 8H2О) неповне окиснення (C3H8 + 2О2 → 3C + 4H2О) неповне окиснення 2C6H14 + 19О2 → 12CО2 + 14H2О 2. реакція окиснення розчином KMnO4 Алкани не окислюються розчином KMnO4 і не знебарвлюють його. Добування алканів І. СН4 1. У промисловості одержують метан із природніх родовищ і реакцією: С + 2Н2 → СН4 2. У лабораторії: А) реакцією алюміній карбіду з водою або кислотами Al4C3 +12H-OH → 3CH4 ↑ + 4Al(OH)3↓ або HCl Б) реакцією натрій етаноату(ацетату) з NaOH: CH3COONa +NaOH → CH4↑ + Na2CO3 ІІ. Загальні методи добування 1. Реакція В’юрца Це реакція двох! однакових або різних моногалогеналканів з лужними металами при цьому утворюється алкан із більшою кількістю атомів Карбону і сіль. 2СН3Cl + 2Na → C2H6 + 2NaCl C2H5Cl + 2Na + ClCH3 → C3H8 + 2NаСl Реакція «водяного газу» Суміш алканів можна одержати на основі «водяного газу»(суміш карбон(ІІ) оксиду і водню). Каталізатор Fe, Co і тиск. nCO + (2n + 1)H2 → CnH2n + 2 + H2O
Застосування алканів І. СН4 (рудниковий чи болотний газ) 1. як газоподібне паливо у промисловості та побуті і як газ-пальне для автомобілів; 2. для одержання розчинників, сажі, різних орг.сполук; 3. для різання та зварювання металів. ІІ. Інші алкани 1. етан, пропан, бутан використовується для одержання пластмас, канчуків. (пропан і бутан - у вигляді скрапленого газу в балонах і запальничках) 2. рідкі алкани (від пентану) використовуються як пальне для автомобілів – бензин і ДП; 3. тверді алкани використовуються для виготовлення парафінових свічок, а також в медицині; 4. суміш рідких і твердих алканів використовується для одержання мазей у лікувальних цілях.
Циклоалкани
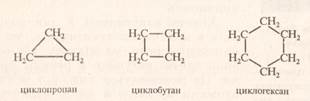
Циклоалкани(циклопарафіни) – це насичені вуглеводні, які мають замкнутий ланцюг із атомів Карбону. Загальна формула циклоаканів:: СnH2n де: n = 3,4,5,6 і т.д. Назви циклоалканів походять від відповідних назв алканів, які мають таку ж кількість атомів Карбону, із додаванням префікса –цикло-
C3H6 C4H8 C6H12 Циклопропан циклобутан циклогексан
C5H10 циклопентан
Фізичні властивості циклоалканів
Циклопропан і циклобутан- гази, Циклопентан і циклогексан- рідини
Хімічні властивості циклоалканів
Для циклоалканів як і для алканів найбільш характерні реакції типу заміщення, однак в циклоалканах гібридизований кут не відповідає 109028', в циклопропані - 600 , циклобутані – 900, циклогексані – 1200.Тому в циклоалканах є напруження у циклі, яке може привести до розриву циклу. Для циклоалканів ще характерними будуть реакції типу приєднання із розривом циклу. І. Реакції заміщення 1. реакція галогенування (подібно як алкани)
C5H10 + Cl2 → C5H9Cl + HCl хлороциклопентан Виняток: циклопропан і циклобутан вступає в реакцію галогенування не як заміщення, а як приєднання і при цьому відбувається розрив циклу і по місцях розриву відбувається приєднання двох атомів галогенів. C3H6 + Cl2 → ClСН2-СН2-СН2Cl 1,3-дихлоропропан C4H8 + Cl2 → ClСН2-СН2-СН2-СН2Cl 1,4-дихлоробутан (Циклоалкани не знебарвлюють«бромну воду» подібно як алкани) 2. реакція нітрування або реакція Коновалова( подібно як алкани)
k. H2SO4 С3Н6 + HO-NO2 → C3H5NO2 + H2O нітроциклопропан ІІ. Реакція розкладу 1. реакція термічного розкладу (подібно як алкани) С3Н6 → 3С + 3Н2↑ 2. реакція дегідрування(дегідрогенізації) (подібно як алкани)
С3Н6 → Н2 + С3Н4 циклопропен Виняток: тільки циклогексан вступає реакцію дегідрування з утворенням бензену: С6Н12 → С6Н6 + 3Н2 циклогексан бензен ІІІ. реакція ізомеризації (починаючи з циклобутану)
Циклогексан → метилциклопентан
IV. реакція окиснення 1. реакція горіння (повне і неповне): Внаслідок реакції повного горіння вуглеводнів утворюється завжди СО2 і Н2О. 2C3H6 + 9О2 → 6CО2 + 6H2О повне окиснення (C3H6 + 3О2 → 3CО + 3H2О) неповне окиснення (2C3H6 + 3О2 → 6C + 6H2О) неповне окиснення 2C5H10 + 15О2 → 10CО2 + 10H2О
2. реакція окиснення розчином KMnO4 Циклоалкани не окислюються розчином KMnO4 і не знебарвлюють його. V. Реакція приєднання 1. реакція гідрування(гідрогенізації) Це реакція приєднання водню до циклоалканів і при цьому розривається цикл і по місцях розриву приєднуються два атоми Гідрогену і утворюється алкан C3H6 + Н2 → СН3-СН2-СН3 Циклопропан пропан
Добування циклоалканів
І. Загальні методи добування 1. Реакція В’юрца Це реакція ди галогеналканів (галогени знаходяться по двох крайніх атомах С) з лужними металами при цьому утворюється циклоалкан і сіль.
ClСН2-СН2-СН2Cl + 2Na → C3H6 + 2NaCl 1,3-дихлоропропан Са циклопропан 2. Циклогексан одержують гідруванням бензену С6Н6 + 3Н2 → С6Н12 Бензен циклогексан
Застосування циклоалканів 1. циклопропан як засіб для наркозу; 2. циклогексан і циклопентан як розчинники і як сировина для одержання різних орг. речовин.
|
||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 1941; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.008 с.) |