Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Номенклатура карбонових кислотСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
За міжнародною(систематичною або номенклатурою ІЮПАК) назви карбонових кислот походять від відповідних назв алканів, включаючи атом Карбону карбоксильної групи, із додаванням закінчення [ова] і слово [кислота]. Нумерацію атомів Карбону проводять цифрами, включаючи атом С карбосильної групи. Для карбонових кислот характерні і історичні назви. Нумерацію атомів Карбону проводять грецькими буквами(α,β,γ,δ,ε,ζ,η,θ…ω), починаючи з атома С, що стоїть поряд з атомом Карбону карбоксильної групи. НСООН - метанова кислота, мурашина кислота,форміатна кислота СН3 СООН - етанова кислота, оцтова кислота, ацетатна кислота С2Н5 СООН - пропанова кислота, пропіонова кислота С3Н7 СООН - бутанова кислота, масляна кислота С4Н9 СООН - пентанова кислота, валеріанова кислота С5Н11 СООН - гексанова кислота, капронова кислота
СН3 5 4 3 2| 1 СН3─СН─СН2-С─СООН міжнародна назва || Сl СН3 2,2-диметил-4-хлоропентанова кислота
СН3 δ γ β α| СН3─СН─СН─С ─СООН історична назва || Сl СН3 α,α-диметил-γ-хлоровалеріанова кислота
Цифри або літери (грецькі чи латинські), які стоять у назвах карбонових кислот перед замісниками називаються локантами.
Назви кислотних залишків карбонових кислот НСОО - метаноат, форміат СН3 СОО - етаноат, ацетат С2Н5 СОО - пропаноат, пропіонат С3Н7 СОО - бутаноат, маслянат, бутират Фізичні властивості карбонових кислот Перші представники карбонових кислот є рідини тому, що між молекулами існує водневий зв’язок( за рахунок поляризації карбоксильної групи), добре розчинні у воді, мають різкий запах.. Вищі карбонові кислоти – тверді воскоподібні речовини, нерозчинні у воді. З підвищенням відносної молекулярної маси розчинність карбонових кислот зменшується, а температура кипіння - підвищується. Oδ- R - С δ-O= C -OHδ+ ∙ ∙ ∙ δ-O= C -OHδ+ ∙ ∙ ∙ δ-O= C -OHδ+ ОНδ+ │ │ │ R R R
Хімічні властивості карбонових кислот Всі хімічні властивості карбонових кислот відбуваються по характеристичній (функціональній) групі - -СООН. І. Загальні властвості як кислоти (реакції по атомі Н групи СООН) 1. реакція дисоціація: СН3СООH ↔ СН3СОО- + Н+ Карбонові кислоти є слабкі електроліти (в реакціях йонного обміну записуються в молекулярному винляді), але сильніші за слабкі неорганічні кислоти. 2. реакція з металами до Н: Zn + 2СН3СООH = (СН3СОО)2 Zn + H2↑ Цинк етаноат Zn + 2СН3СООH = 2СН3СОО- + Zn2+ + H2↑ З. реакція з оксидами металів: Fe O + 2НСООH = (НСОО)2 Fе + H2O Ферум (ІІ) метаноат(форміат) 4. реакція з основами (реакція нейтралізації): Na OH + С2Н5СООН= С2Н5СОО Na + H2O Натрій пропаноат(пропіонат) Na+ + OH- + С2Н5СООН= С2Н5СОО- + Na+ + H2O 5. реакція з солями, утвореними неорг. слабкими кислотами: Na2 С O3 + 2H СООН = 2НСОО Na + H2O + СО2↑(Н2СО3) Натрій метаноат(форміат) І. Реакції по ОН карбоксильної групи. 1. реакція естерифікації (характерна для тільки органічних кислот) Це реакція карбонових кислот з спиртами (при цьому атом Н карбоксильної групи карбонової кислоти заміщується на вуглеводневий радикал спирту) і утворюється естер і вода. Каталізатором реакції етерифікації є конц. H2SO4. СН3 СООН + С2Н5 ОН → СН3 СООС2Н5 + Н2О Естер (етилетаноат або етилацетат) ІІІ. реакція заміщення атомів Н у вуглеводневому радикалі карбонової кислоти(починаючи з етанової кислоти) 1. реакція галогенування ( каталізатор – світло, як в алканах) СН3 СООН + Cl2 → СН2 СОOH + НCl 2-хлороетанова кислота | Cl IV. реакція приєднання до карбонільної групи (– С=О) карбоксильної групи кислот Реакція гідрування –(відновлення) СН3 СООН + Н2 → СН3 С(O)H + Н2О етаналь При повному відновленні карбонових кислот утворюється спирт СН3 СООН + 2 Н2 → СН3 СН2ОH + Н2О етанол Добування карбонових кислот ІІ. Загальні методи добування 1.реакція окиснення спиртів за схемою: R-OH → R-C(O)H → RCOOH C2H5 ОН + [О] → CH3- С(О)H + Н2О або CuO + Cu CH3- С(О)H + [О] → CH3- СООH + Н2О або зразу C2H5 ОН + [О] → CH3- СООH + Н2О 2. реакція окиснення алканів киснем повітря в присутності каталізатора – солей Mn. Mn2+ 2С4Н10 + 5O2 → 4CH3 СООН + 2Н2О 3. реакція натрієвих солей карбонових кислот з сильними неорганічними кислотами СН3 СООNa + Н Cl → СН3 СОOH + NaCl
Застосування карбонових кислот І. НСООН(найсильніша із всіх органічних кислот ) Метанова кислота на відміну від інших карбонових кислот містить дві характеристичні групи: альдегідну і карбоксильну О О Н – С або НО- С ОН Н Тільки для метанової (мурашиної) кислоти характерна реакція «срібного дзеркала» і «мідного дзеркала» подібно як для альдегідів О О НО- С + Ag2O → НО- С + 2Ag↓ Н ↓ ↑ ОН СО2↑ + Н2О Карбонатна кислота!!! – Н2СО3 1. в медицині 1,25% розчин її використовується як «мурашиний спирт» (входить до складу мурашок, кропиви, хвої ялини); 2. як засіб для боротьби з кліщами бджіл; 3. для одержання естерів, які використовуються як розчинники і пахучі речовини. ІІ. СН3 СООН 1. для одержання барвників(наприклад,індиго), медикаментів(наприклад, аспірину), естерів, ацетатного волокна, гербіцидів.; 2. 3-9% розчин оцтової кислоти – оцет - використовується як смаковий і консервуючий засіб, 70-80% розчин – оцтова есенція. Представники різних класів карбонових кислот І. Вищі насичені одноосновні карбонові кислоти (нерозчинні у воді!) - С15Н31СООН - пальмітинова кислота! - С17Н35СООН - стеаринова кислота! Найбільш характерною реакцією для них є реакція нейтралізації, внаслідок якої утворюються солі, які називають милами. С15Н31СООН + NaOH → С15Н31СООNa + H2O Натрій пальміат
С17Н35СООН + NaOH → С17Н35СООNa + H2O Натрій стеарат Мило – це тільки натрієві або калієві солі вищих карбонових кислот. Мило поділяється: 1. тверде; 2. рідке. Тверде мило – це натрієві солі: С15Н31СООNa, С17Н35СООNa Рідке мило – це калієві солі: С15Н31СООК, С17Н35СООК. ІІ. Ненасичені карбонові кислоти СН2=СН-СООН -пропенова кислота або акрилова кислота С17Н33СООН – олеїнова кислота (вища ненасичена кислота)! С17Н31СООН - лінолева кислота (вища ненасичена кислота) С17Н29СООН - ліноленова кислота (вища ненасичена кислота) ІІІ. Двоосновні карбонові кислоти ( містять дві СООН групи) НООС-СООН етандіова кислота, щавелева кислота Солі щавелевої кислоти називаються оксалатами. ІV. Окси кислоти (містять дві групи ОН і СООН) СН3-СН-СООН 2-оксипропанова кислота, молочна кислота. │ ОН Солі молочної кислоти називаються лактатами. V. Ароматичні кислоти. С6Н5СООН - бензойна кислота, бензоатна кислота
Естери Естери – це похідні від карбонових кислот, в яких атом Н карбоксильної групи СООН заміщений на вуглеводневий радикал. Загальна формула естерів: RCOOR′ де R – H, CH3, C2H5 і т.д., а R′ - тільки CH3, C2H5 і т.д. СnH2nO2 де: n = 1,2,3,4 і т.д. Одержують естери реакцією еcтерифікації карбонових кислот із спиртами в присутності конц. H2SO4: RCOOН + R′ ОН → RCOOR′ +Н2О СН3СООН + С2Н5 ОН → СН3СООС2Н5 + Н2О Назви естерів походять від назв радикалів спиртів і назви кислотного залишку карбонових кислот. RCOOR′ 2 ← 1 СН3СООС2Н5 - етилетаноат, етилацетат, етиловий естер оцтової кислоти НСООСН3 - метилметаноат, метилформіат, метиловий естер мурашиної кислоти. Естери є міжкласовими ізомерами до карбонових кислот: НСООСН3 - метилметаноат - С2Н4О2 СН3СООН – етанова кислота- С2Н4О2
За фізичними властивостями естери – це рідини, які мають квітково-фруктовий запах, легші від води. Наприклад: - бутиловий естер масляної кислоти – запах ананасів; - бутиловий естер мурашиної кислоти – запах вишень; - етиловий естер масляної кислоти – запах абрикосів
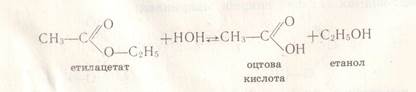
Хімічні властивості естерів Реакція гідролізу А). водний гідроліз або гідроліз: Це взаємодія естерів з водою внаслідок чого утворюється кислота і спирт. Реакція оборотна. СН3СООС2Н5 + Н2О ↔ СН3СООН + С2Н5 ОН
Б) лужний гідроліз або омилення: Це взаємодія естерів з лугами і при цьому утворюється сіль карбонової кислоти і спирт. Реакція необоротна. СН3СООС2Н5 + NaОH → СН3СООNa + С2Н5 ОН 2. реакція горіння. СН3СООС2Н5 + 5О2 → 4СО2 + 4Н2О С4Н8О2
Застосування естерів 1. як запашні речовини речовини при виробництві напоїв, цукерок (фруктові есенції), у парфумерії; 2. як розчинники лаків (рідина для зняття лаку з нігтів - етилацетат).
Жири (ліпіди)
Жири – це естери на основі тільки триатомного спирту гліцеролу і вищих насичених і ненасичених карбонових кислот. СН2 ОН С15Н31СООН - пальмітинова кислота (насичена)! | С17Н35СООН - стеаринова кислота (насичена)! СН ОН С17Н33СООН - олеїнова кислота (ненасичена)! | C17H31COOH - лінолева кислота (ненасичена) СН2 ОН C17H29COOH - ліноленова кислота (ненасичена)
Гліцерин, гліцерол Одержують жири реакцією естерифікації тільки гліцерину і вищих карбонових кислот (три молекули!)
СН2 ОН CH2OOC- R │ │ СН ОН + 3RCOOH → СН ОOC- R + 3Н2O │ │ СН2 ОН СН2 ОOC- R Загальна формула жирів (тригліцеридів – інша назва жирів): CH2OOC- R │ СН ОOC- R де R= С15Н31, С17Н35, С17Н33 │ СН2 ОOC- R
|
||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 777; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.126.33 (0.007 с.) |