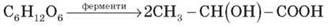Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Карбонові кислоти. Оцтова кислота.Содержание книги Поиск на нашем сайте
Карбоновими кислотами називаються органічні речовини, молекули яких містять одну або кілька карбоксильних груп Карбонові кислоти з однією карбоксильною групою називають одноосновними. Насичені одноосновні карбонові кислоти мають загальну формулу СnH2n + 1COOH. За систематичною номенклатурою, назву кислот утворюють із назв відповідних насичених вуглеводнів, додаючи до них суфікс і закінчення -ова і слово кислота. НСООН метанова (мурашина) кислота СН3СООН етанова (оцтова) кислота СН3СН2СООН пропанова (пропіонова) кислота СН3СН2СН2СООН бутанова (масляна) кислота Найважливішим представником насичених одноосновних кислот є оцтова кислота.
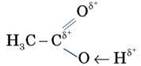
Структурна формула: Електронна формула: Зв’язок C - H — ковалентний слабко-полярний. Зв’язки C = O і O - H — ковалентні сильно-полярні.
У результаті зсуву електронної густини подвійного зв’язку до Оксигену атом Карбону одержує надлишковий позитивний заряд. через це електронна густина в гідроксильній групі значною мірою зміщена до атома Оксигену. Атом Гідрогену у зв’язку з цим легко відщеплюється у вигляді протона, зумовлюючи кислотні властивості. Фізичні властивості. Молекула оцтової кислоти полярна, тому між молекулами утворюються водневі зв’язки з утворенням димерів.
Оцтова кислота — це безбарвна рідина з різким запахом, температури кипіння й плавлення низькі (температура плавлення — 16,6 °С, температура кипіння — 118,1 °С, густина — 1,049 г/см3), добре розчинна у воді (розчин оцтової кислоти у воді називається оцтом). Хімічні властивості. Оцтова кислота проявляє всі хімічні властивості, притаманні кислотам: 1) електролітична дисоціація. У розчині частина молекул оцтової кислоти дисоціює з утворенням катіону Гідрогену Н+ та аніону кислотного залишку ацетату СН3СОО- СН3СООН ↔ СН3СОО- + Н+ ацетат -йон Утворені йони Н+ діють на індикатори, змінюючи їх колір: лакмусу – на червоний, метилоранжу – на рожевий, фенолфталеїн залишається безбарвним. Але необхідно враховувати, що оцтова кислота, як і більшість органічних кислот, належить до слабких кислот і дисоціює тільки невелика кількість її молекул. Тому при складанні рівнянь у йонній формі хімічну формулу оцтової кислоти як слабкого електроліту доцільно зберігати у молекулярному, недисоційованому вигляді. 2) взаємодія з металами. Оцтова кислота взаємодіє з металами, що розташовані у ряду активності металів перед воднем: 2 CH3COOH + Ca → (CH3COO)2Ca + H2 ↑ кальцій ацетат 2 CH3COOH + Ca → 2CH3COO- + Ca 2+ + H2 ↑ 3) взаємодія з основними оксидами: 2 CH3COOH + FeO → (CH3COO)2Fe + H2O ферум (ІІ) ацетат 2 CH3COOH + FeO → 2CH3COO- + Fe 2+ + H2O 4) взаємодія з основами: CH3COOH + NaOH → CH3COONa + H2O натрій ацетат CH3COOH + Na+ + OH- → CH3COO- + Na+ + H2O CH3COOH + OH- → CH3COO- + H2O
3 CH3COOH + Fe(OH)3 → (CH3COO)3Fe + 3 H2O ферум (ІІІ) ацетат 3 CH3COOH + Fe(OH)3 → 3 CH3COO- + Fe3+ + 3 H2O 5) взаємодія з солями: 2 CH3COOH + Na2СО3 → 2 CH3COONa + H2O + СО2 ↑ 2 CH3COOH + 2Na+ + СО32- → 2 CH3COO- + 2Na+ + H2O + СО2 ↑ 2 CH3COOH + СО32- → 2 CH3COO- + H2O + СО2 ↑ 6) взаємодія зі спиртами (реакція етерифікації): при нагріванні суміші карбонової кислоти зі спиртом у присутності концентрованої сульфатної кислоти відбувається утворення естерів (складних ефірів):
етилацетат (етиловий естер оцтової кислоти) Застосування оцтової кислоти: 1) виробництво барвників; 2) розчинник; 3) харчова промисловість; 4) виробництво ацетатного волокна; 5) виробництво лікарських препаратів (аспірин та ін.). Вищі карбонові кислоти Вищими називають кислоти, що містять у молекулі велику кількість атомів Карбону. З вищих одноосновних карбонових кислот найбільше значення мають С15Н31СООН пальмітинова (пентадеканова) кислота С17Н35СООН стеаринова (гептадеканова) кислота Вони являють собою безбарвні тверді речовини, нерозчинні у воді. Стеаринову й пальмітинову кислоти можна виділити з рослинних і тваринних жирів. У промисловості ці кислоти одержують шляхом окиснення парафіну, який виділяють із нафти. Пальмітинова і стеаринова кислоти проявляють властивості, характерні для карбонових кислот, наприклад взаємодіють з лугами: C17H35COOH + NaOH → C17H35COONa + H2O натрій стеарат Солі цих кислот – основні компоненти мила. Стеаринову й пальмітинову кислоти застосовують у виробництві мийних засобів, лаків, фарб, лінолеуму, гуми. Важливим представником ненасичених карбонових кислот є олеїнова кислота С17Н33СООН. СН3 – (СН2)7 – СН = СН – (СН2)7 – СООН Олеїнова кислота – масляниста рідина, що у формі естерів гліцерину входить до складу рослинних жирів. Вона має властивості кислот, зумовлені наявністю карбоксильної групи: С17Н33СООН + КОН → С17Н33СООК + Н2О калій олеат Також олеїнова кислота проявляє властивості ненасичених вуглеводнів, зумовлені наявністю подвійного зв’язку в карбоновому ланцюзі. Так, наприклад, олеїнова кислота знебарвлює бромну воду: СН3 – (СН2)7 – СН = СН – (СН2)7 – СООН + Br2 → → СН3 – (СН2)7 – СН - СН – (СН2)7 – СООН | | Br Br У результаті гідрування ненасичена олеїнова кислота перетворюється на насичену стеаринову кислоту: С17Н33СООН + Н2 → С17Н35СООН До вищих ненасичених карбонових кислот належать також лінолева С17Н31СООН та ліноленова С17Н29СООН кислоти.
Жири. Жири – це естери трьохатомного спирту гліцеролу та вищих карбонових кислот. Загальна назва таких сполук — тригліцериди. Склад і будову жирів можна зобразити загальною формулою естеру, в якому залишки карбонових кислот позначені радикалами R 1, R 2, R 3: CH2–O–CO– R 1 | CH–O–CO– R 2 | CH2–O–CO– R 3. Найчастіше до складу молекул жирів входять радикали таких вищих карбонових кислот: пальмітинової C15H31COOH, стеаринової C17H35COOH, олеїнової C17H33COOH. CH2–O–CO– С17Н35 | тристеарат, естер гліцеролу та стеаринової CH–O–CO– С17Н35 кислоти | CH2–O–CO– С17Н35 За походженням жири бувають: 1) рослинні (олії); 2) тваринні; 3) комбіновані. За консистенцією: 1) тверді (утворені насиченими вищими карбоновими кислотами); 2) рідкі (утворені ненасиченими вищими карбоновими кислотами). До складу природних жирів входять як правило вищі карбонові кислоти з парним числом атомів Карбону. Приклади природних жирів: CH2–O–CO– С17Н33 | Вершкове масло: олео-пальміно-бутират CH–O–CO– С17Н31 | CH2–O–CO– С3Н7 CH2–O–CO– С17Н33 | Свиняче сало: олео-пальміно-стеарат CH–O–CO– С17Н31 | CH2–O–CO– С17Н35 Лляна олія: 61,5% гліцеридів лінолевої кислоти. Соняшникова, горіхова олії: 30 – 50% гліцеридів лінолевої кислоти, решта – олеїнової кислоти. Утворюються жири під час реакцій етерифікації за участі гліцеролу та вищих карбонових кислот: CH2–OН CH2 – O – CO – C17H35 | | CH–OН + 3 С17Н35СООН → CH – O – CO – C17H35 + 3 H2O | | CH2–OН CH2 – O – CO – C17H35 тристеарат
Хімічні властивості жирів 1) Гідроліз – розкладання жирів під дією води. Протікає в присутності каталізаторів (кислоти, луги, оксиди металів). а) кислотний гідроліз: у присутності кислот гідроліз жирів призводить до утворення гліцеролу та відповідних карбонових кислот: CH2 – O – CO – C17H35 CH2 – OH | | CH – O – CO – C17H35 + 3 H2O → CH – OH + 3 C17H35COOH | | CH2 – O – CO – C17H35 CH2 – OH б) лужний гідроліз: у присутності лугів гідроліз жирів призводить до утворення гліцеролу та солей вищих карбонових кислот: CH2 – O – CO – C17H35 CH2 – OH | | CH – O – CO – C17H35 + 3 NaOH → CH – OH + 3 C17H35COONa | | CH2 – O – CO – C17H35 CH2 – OH Вищі солі карбонових кислот є основою мила. Натрієві солі (С17Н35СOONa, C15H31COONa) входять до складу твердого мила, а калієві солі ((С17Н35СOOК, C15H31COOК) входять до складу рідкого мила. 2) Гідрування ненасичених жирів. Жири, що утворені ненасиченими карбоновими кислотами (рідкі жири) можуть прєднувати молекули водню і перетворюватись на насичені (тверді) жири. Так. Наприклад рідкий жир три олеат при гідруванні перетворюється на твердий жир тристеарат: CH2 – O – CO – C17H33 СН2 – О – СО – С17Н35 | | CH – O – CO – C17H33 + 3 Н2 → CH - О – СО – С17Н35 | | CH2 – O – CO – C17H33 CH2 – O – СО – С17Н35 триолеат тристеарат Ця реакція має велике промислове значення. За її допомогою соняшникову олію перетворюють на твердий жир маргарин, що є замінником природних твердих жирів тваринного походження. Біологічна роль жирів. Жири є найважливішими продуктами харчування. В організмі людини основна функція жиру – бути джерелом енергії. Окиснення 1г жиру спричиняє виділенню 39 кДж енергії. Однак буде нерозумним, виходячи з цього, прагнути забезпечити свій організм виключно жирами, оскільки, незважаючи на те, що вони багаті на енергію, жири важко засвоюються. Добовий раціон людини має містити 60 – 70г жиру. Але не можна забувати, що надлишкова кількість жиру, навіть у раціоні здорової людини, дуже шкідлива. Жири не розчиняються ані водою, ані травними соками. В організмі вони розщеплюються й емульгуються за сприяння жовчі. Зайва кількість жиру не встигає проемульгуватися, порушує травні процеси та спричиняє неприємне відчуття печії. Жири є не тільки джерелом енергії в організмі, а й джерелом води. Завдяки цій воді живуть верблюди тривалий час без свіжої води. Для розвитку зародка курчати в інкубаційний період потрібна вода, а надходження її ззовні відсутнє. Зародок забезпечується водою окисленого жиру. Жири необхідні й мешканцям холодного клімату: тюленям, моржам. Підшкірний жир допомагає зберегти внутрішнє тепло. Будь – якій тварині жирові відкладення пом’якшують силу різних поштовхів і ударів. Крім того, жири для тварин – мастильний матеріал. Відомо, водоплавні птахи самі проводять змащення під час чищення пір’я. Також жири є джерелом вітамінів A, D, E. Застосування жирів. 1) харчова промисловість; 2) маргарин; 3) у домашніх умовах; 4) мило; 5) гліцерин; 6) медицина; 7) оліфа; 8) косметичні засоби.
Вуглеводи. Вуглеводи – найважливіші природні сполуки, що характеризуються біологічною активністю, відіграють важливу роль у житті рослин, тварин, людини. Свою назву одержали через початкові уявлення про склад вуглеводів як сполук Карбону з водою: Cn(H2O)m. Глюкоза: С6Н12О6 ↔ С6(Н2О)6 Сахароза: С12Н22О11 ↔ С12(Н2О)11 Назва «вуглеводи» збереглася дотепер, хоча й не виражає дійсної, досить складної будови цих речовин. У рослинах міститься до 80% вуглеводів. В організмі людини й тварин – до 20%. Їжа людини на 70% складається з вуглеводів. Утворюються вуглеводи у зелених рослинах під час процесу фотосинтезу: 6 СО2 + 6 Н2О → С6Н12О6 + 6 О2 глюкоза 12 СО2 + 11 Н2О → С12Н22О11 + 12 О2 сахароза 6n CO2 + 5n H2O → (C6H10O5)n + 6nO2 крохмаль
Класифікація вуглеводів. В основу класифікації вуглеводів покладено їх відношення до реакцій гідролізу. Вуглеводи ________________________________|_________________________________ ↓ ↓ ↓ Моносахариди Дисахариди Полісахариди Моносахариди – це вуглеводи, що не вступають у реакцію гідролізу (глюкоза, фруктоза). С6Н12О6 + Н2О Дисахариди – це вуглеводи, молекула яких під час гідролізу розпадається на дві молекули моносахаридів: С12Н22О11 + Н2О → С6Н12О6 + С6Н12О6 Полісахариди – це вуглеводи, молекула яких під час гідролізу розпадається на безліч молекул моносахаридів: (С6Н10О5)n + nH2O → n C6H12O6 Глюкоза Молекулярна формула - С6Н12О6. Молекула глюкози містить п’ять гідроксидних груп – ОН та альдегідну групу – СН = О Тобто за своїми функціями глюкоза є альдегідоспирт. Структурна формула глюкози має вигляд:
Як показали дослідження, у розчині глюкози є молекули лінійної й циклічної будови. Фізичні властивості і поширення у природі. Глюкоза - білий кристалічний порошок, добре розчинний у воді. Температура плавлення близько 150ºС. Солодка на смак. Глюкозудобув 1802 р. французький хімік Ж. Пруст з винограду, тому її дотепер часто називають виноградним цукром. У природі глюкоза трапляється не лише у виноградному соку, а й у соках багатьох інших фруктів і ягід та чи не в усіх органах зелених рослин. Бджолиний мед також містить глюкозу. Особливо багаті на глюкозу виноград, черешні, вишні, малина, суниці, сливи, кавуни. З овочів найбільше глюкози містить гарбуз, білоголовкова капуста та морква. Міститься глюкоза також у крові людини і тварин (близько 0,1%). Хімічні властивості. 1) Окиснення: С6Н12О6 + 6 О2 → 6 СО2 + 6 Н2О У результаті окисненя глюкози в тканинах організму вивільняється енергія, необхідна для нормальної життєдіяльності організмів. 2) Взаємодія з купрум (ІІ) гідроксидом. Як багатоатомний спирт глюкоза розчиняє свіжоотриманий Cu(OH)2 утворюючи яскраво-синій розчин. 3) Бродіння – розклад цукристих речовин під дією біологічно активних каталізаторів (ферментів). Спиртове бродіння – відбувається під дією ферменту дріжджів:
Молочнокисле бродіння – відбувається під дією молочнокислих бактерій:
Застосування глюкози. 1) як цінний харчовий продукт; 2) в кондитерському виробництві; 3) у медицині для приготування лікарських препаратів, консервування крові, внутрішньовенного вливання; 4) у виробництві дзеркал та іграшок (сріблення); 5) під час фарбування та обробки тканин і шкір. Сахароза Фізичні властивості та поширення у природі. Найважливішою сполукою з дисахаридів є сахароза. Її молекулярна формула C12H22O11. Сахароза – це безбарвна кристалічна речовина, солодка на смак (солодша за глюкозу), добре розчиняється у воді. При нагріванні до 190–200 °С її кристали плавляться, утворюючи карамель. У великих кількостях сахароза міститься у цукрових буряках, стеблах цукрової тростини, а також у березовому та кленовому соках, у багатьох плодах. У промисловості сахарозу виробляють із соку цукрової тростини (вміст 14 -16%), цукрового буряку (16 – 21%) та деяких інших рослин, наприклад, канадського клену, земляної груші. Хімічні властивості. Найважливішою властивістю сахарози є гідроліз. Як дисахарид сахароза розпадається на дві молекули моносахаридів. Одна з таких молекул – молекула глюкози,інша – фруктози: С12Н22О11 + Н2О → С6Н12О6 + С6Н12О6 глюкоза фруктоза Ця хімічна реакція використовується для одержання штучного меду.
|
||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 709; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.17.137 (0.009 с.) |

 (або - СООН), сполучених з вуглеводневим радикалом.
(або - СООН), сполучених з вуглеводневим радикалом.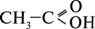


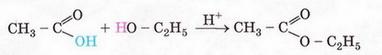 + Н2О
+ Н2О