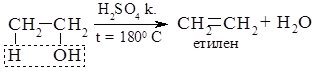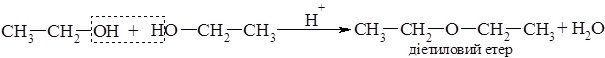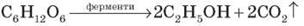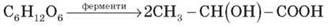Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Метан – найпростіша органічна речовина.Содержание книги Поиск на нашем сайте
Органічна хімія.
Органічні сполуки та їх особливості.
Ще у XVIII столітті усі відомі речовини було поділено на два види: органічні та неорганічні. Речовини _____________________│_____________________ ↓ ↓ Неорганічні Органічні
Є основою неживої природи, Входять до складу живих організмів, входять до складу мінералів та рослинних і тваринних (білки, жири, гірських порід (прості речовини вуглеводи, вітаміни) метали і неметали, складні речовини оксиди, основи, кислоти, солі)
Таким чином термін «органічні» походить від слова «організм», адже дійсно, спочатку до органічних речовин відносили тільки речовини, що утворюються в живих організмах. Тривалий час панувала теорія віталізму (від латинського «vis vitalis» - життєва сила), одним з провідників якої був видатний шведський вчений Йенс Якоб Берцеліус. Згідно цієї теорії органічні речовини можуть утворюватись тільки під дією особливої, недоступної для пізнання «життєвої сили», і не можуть бути отримані штучно. Але ряд синтезів на початку XIX століття спростував цю теорію: 1828 рік – Ф.Веллер (Німеччина) синтезував сечовину. 1842 рік – М.Зінін (Росія) синтезував анілін. 1845 рік – А.Кольбе (Німеччина) синтезував оцтову кислоту. 1854 рік – М.Бертло (Франція) синтезував один з жирів. 1861 рік – М.Бутлеров (Росія) синтезував одну з цукристих речовин.
Ці та ряд інших відкриттів спростували теорію віталізму. При подальшому дослідженні складу та будови органічних сполук, у середині XIX століття, німецькі хіміки А.Кекуле і А.Кольбе встановили, що основою будь-якої органічної речовини є атоми чотиривалентного Карбону, що здатні сполучатись у ланцюги різної форми та довжини: │ │ │ │ │ │ │ │ │ │ │ │ - С – С – С – С – С- - С – С – С – С – С – - С – С – │ │ │ │ │ │ │ │ │ │ │ │ - С - - С – С - │ │ │
лінійні розгалужені циклічні
Багато органічних речовин містять подвійні або потрійні хімічні зв’язки між атомами.Зображати зв’язки між атомами у молекулах рисками запропонував шотландський хімік А.Купер. В наш час поняття «органічні сполуки» суттєво змінилось. Оскільки основою будь-якої органічної речовини є атоми Карбону, прийнято відносити до органічних речовин усі сполуки Карбону. Виняток складають проста речовина вуглець С (алмаз, графіт, сажа), оксиди СО та СО2, карбонатна кислота Н2СО3 та солі карбонатної кислоти (СаСО3, NaHCO3 та ін.). Ці речовини відносять до неорганічних. Отже, органічні речовини – це сполуки Карбону.
Особливості органічних речовин: Всі без винятку органічні сполуки містять спільний хімічний елемент – Карбон. Крім Карбону органічні речовини можуть містити Гідроген Н, Оксиген О, Нітроген N (елементи-органогени) та деякі інші елементи. Наприклад, білок гемоглобін містить у своєму складі атоми Феруму, розчинник хлороформ атоми Хлору і т.д. Завдяки здатності атомів Карбону утворювати ланцюги різноманітної форми і довжини, число органічних речовин перевищує 20 мільйонів (неорганічних речовин приблизно 0,5 мільйона) і швидко зростає. Щороку синтезуються тисячі нових органічних речовин. У молекулах органічних речовин атоми мають сталу валентність: Карбон – чотиривалентний, Гідроген – одновалентний, Оксиген – двовалентний, Нітроген – тривалентний. Переважна більшість органічних речовин мають ковалентний тип зв’язку між атомами, в той час як серед неорганічних переважають речовини з йонним типом зв’язку. У твердому стані органічні речовини мають молекулярну кристалічну гратку, а отже, порівняно невисокі температури плавлення та кипіння, є крихкими. Переважна більшість органічних речовин є неелектролітами. Багато органічних речовин є складовими живих організмів (білки, жири, вуглеводи, вітаміни, гормони і т.д.). Для багатьох органічних речовин притаманне явище ізомерія – існування речовин, що мають однаковий кількісний та якісний склад, але різну будову. Так, наприклад загальну молекулярну формулу С2Н6О мають дві різні речовини:
Н Н Н Н │ │ │ │ Н –С -- С – О -- Н Н – С – О – С – Н │ │ │ │ Н Н Н Н етиловий спирт диметиловий етер
Метан – найпростіша органічна речовина.
Найпростіша органічна сполука – метан, утворена одним атомом Карбону і чотирма атомами Гідрогену. Молекулярна формула – СН4. Н | Структурна формула Н – С – Н | Н Н .. Електронна формула Н: С: Н .. Н Фізичні властивості: газ, без кольору, без запаху, майже вдвічі легший за повітря, практично нерозчинний у воді, tкип. = - 162 °С. Поширення у природі: - основна складова частина природного газу (до 98%); утворюється на дні водоймищ під час гниття рослинних решток (болотяний газ) міститься у кам’яновугільних пластах (рудничний газ).
Хімічні властивості метану. Повне окиснення (горіння): СН4 + 2 О2 → СО2 + 2 Н2О За умов нестачі кисню замість карбон (ІV) оксиду утворюється карбон (ІІ) оксид СО («чадний газ») – дуже небезпечна,отруйна речовина.
Реакції заміщення. Найбільш поширеними серед них є реакції галогенування – взаємодія метану з галогенами хлором Cl2 та бромом Br2. реакція відбувається під дією ультрафіолетового випромінювання:
Н H | | Н – С – Н + Cl – Cl → Н – C – Cl + H – Cl | | H H
У молекулярному вигляді:
CH4 + Cl2 → CH3Cl + HCl метан хлор хлорметан гідроген хлорид
За достатньої кількості хлору заміщення атомів Гідрогену на галоген може тривати далі: CH3Cl + Cl2 → CH2Cl2 + HCl дихлорметан CH2Cl2 + Cl2 → CHCl3 + HCl трихлорметан CHCl3 + Cl2 → CCl4 + HCl тетрахлорметан
Термічний розклад на прості речовини (без доступу повітря): CH4 → C + 2 H2
Застосування метану: Як паливо у промисловості, побуті, автомобільних двигунах; У органічному синтезі: є вихідною речовиною у виробництві пластмас, розчинників, лікарських препаратів та інших органічних речовин.
Гомологічний ряд метану.
Гомологія – це явище існування подібних за будовою та властивостями органічних речовин, що відрізняються на групу –СН2-. Група –СН2- називається гомологічною різницею. Речовини, що подібні забудовою й відрізняються одна від одної на одну або кілька груп –СН2- називаються гомологами. Гомологи об’єднуються у гомологічні ряди. Гомологічний ряд метану має вигляд:
Вуглеводні, що містять у молекулі тільки одинарні хімічні зв’язки, називають насиченими. Інші назви насичених вуглеводнів – алкани, парафіни. Загальна формула насичених вуглеводнів гомологічного ряду метану CnH2n+2.
Фізичні властивості насичених вуглеводнів
Перші чотири представники гомологічного ряду метану (С1 – С4) – газоподібні речовини, безбарвні, практично не розчинні у воді. Насичені вуглеводні складу С5 – С15 є рідинами, безбарвні. Мають характерний «бензиновий» запах, практично нерозчинні у воді (бензин, гас,дизельне пальне) Насичені вуглеводні складу С16 і більше – тверді речовини. Безбарвні. Практично нерозчинні у воді. Прикладами таких вуглеводнів є парафін, мазут.
Хімічні властивості насичених вуглеводнів
Хімічні властивості насичених вуглеводнів такі ж, як і у метану: Повне окиснення (горіння). Продуктами реакції є вуглекислий газ СО2 та вода Н2О:
С2Н6 + 3,5 О2 → 2 СО2 + 3 Н2О
2 С2Н6 + 7 О2 → 4 СО2 + 6 Н2О
С3Н8 + 5 О2 → 3 СО2 + 4 Н2О
За умов нестачі кисню відбувається неповне згоряння вуглеводнів з утворенням чадного газу СО:
С8Н18 + 8,5 О2 → 8 СО + 9 Н2О
2 С8Н18 + 17 О2 → 16 СО + 18 Н2О
Галогенування (реакція заміщення): С2Н6 + Br2 → C2H5Br + HBr брометан С2H5Br + Br2 → C2H4Br2 + HBr і т.д. диброметан Усі насичені вуглеводні стійкі до дії кислот, лугів та окисників (розчин «марганцівки» KMnO4 та ін.). Застосування насичених вуглеводнів. як паливо у промисловості та побуті; як паливо для двигунів автомобілів, тракторів, літаків, ракет; у виробництві розчинників; у медицині, парфумерії та косметиці (вазелінове масло); парафін – у виготовленні свічок, сірників, пакувального паперу; сировина для виробництва інших органічних речовин (пластмаси, каучуки, синтетичні волокна, мийні засоби та ін.).
Оксигеновмісні органічні сполуки.
Спирти.
Багато органічних сполук містять у своїх молекулах, крім атомів Карбону і Гідрогену, ще й атоми Оксигену. Такі сполуки називаються оксигеновмісними. Оксигеновмісні сполуки поділяються на класи – клас спиртів, клас карбонових кислот, клас естерів, клас жирів тощо.
Спирти – це органічні сполуки, які містять одну або більше гідроксильних груп, безпосередньо зв’язаних з насиченим атомом Карбону. Загальна формула спиртів R(OH)n, де R – вуглеводневий радикал. За природою вуглеводневого радикалу спирти поділяють на насичені, ненасичені та ароматичні. За кількістю гдроксидних груп спирти поділяють на одноатомні та багатоатомні.
Загальна формула одноатомних насичених спиртів – CnH2n+1OН. Типовими представниками насичених одноатомних спиртів є метанол CH3OH і етанол C2H5OH. Оскільки до складу молекул наведених спиртів входить одна гідроксильна група OH, такі спирти належать до одноатомних. Гідроксильна група OH є функціональною групою, тобто такою, що зумовлює хімічні властивості спиртів. За систематичною номенклатурою, назву спирту утворюють від назви відповідного насиченого вуглеводню, додаючи до неї суфікс - ол. Окремі представники. Метиловий спирт (метанол, деревний спирт) СН3ОН – родоначальник гомологічного ряду спиртів. Безбарвна рідина, легко змішується з водою, спиртами, іншими органічними розчинниками. Одержують метанол із синтез-газу при нагріванні за наявності каталізатора: СО2 + Н2 → СН3ОН + Н2О або з карбон (ІІ) оксиду та водню при нагріванні: СО + 2Н2 → СН3ОН До 1923 р. метанол одержували виключно сухою перегонкою деревини, тому його ще називають деревний спирт. Вперше метиловий спирт у чистому вигляді виділили Ж.Дюма та Е. Пеліго у 1834 р. і встановили його формулу (СН3ОН), а також сформували уявлення про спирти, як окремий клас органічних сполук. Вперше метанол синтезував П. Бертло у 1858 р.: CH3Cl + KOH → CH3OH + KCl хлорметан Метиловий спирт надзвичайно отруйний. Попадання в організм людини біля 30 г метанолу викликають смерть, а менші дози руйнують зоровий нерв і ведуть до втрати зору. Етиловий спирт (від гр. aether – повітря, етер, та hyle – дерево, речовина)(етанол, винний спирт) С2Н5ОН. Безбарвна легко рухлива рідина, з характерних запахом і пекучим смаком. Змішується у всіх співвідношеннях з водою, іншими спиртами. Входить до складу алкогольних напоїв. У невеликих кількостях викликає стан алкогольного сп’яніння, збільшення дози веде до наркотичного стану. У середні віки спирт вважали найкращими ліками і навіть називали “вода життя” (лат. aqua vitae). Інша назва етанолу – “вогняна вода” (лат. aqua ardens) вказувала на його властивості. Етиловий сприт широко застосовують як сировину в органічному синтезі, як розчинник, у фармації та медицині для виготовленні настоянок, екстрактів, як дезинфікуючий засіб. У промисловості етанол одержують бродінням вуглеводів рослинного походження та гідратацією етилену у присутності концентрованої H2SO4: C6H12O6
СН2=СН2 + Н2О Вперше цю реакцію здійснив французький хімік П. Бертло, який був не тільки чудовим хіміком, але й очолював Міністерство народної освіти та вишуканих мистецтв, а також був Міністром іноземних справ Французької республіки. Хімічні властивості спиртів 1) Повне окиснення (горіння). При горінні спиртів утворюється карбон (IV) оксид і вода: СН3ОН + 1,5О2 → СО2 + 2Н2О 2 СН3ОН + 3 О2 → 2 СО2 + 4 Н2О С2Н5ОН + 3О2 → 2СО2 + 3Н2О С3Н7ОН + 4,5О2 → 3СО2 + 4Н2О 2 С3Н7ОН + 9 О2 → 6СО2 + 8Н2О 2) Взаємодія з лужними металами. Спирти взаємодіють з лужними металлами, утворюючи алкоголяти: 2СН3СН2ОН + 2Na → 2СН3СН2ONa + Н2 натрій етилат
2 СН3ОН + 2 К → 2 СН3ОК + Н2 калій метилат 2 С3Н7ОН + 2 Li → 2 С3Н7ОLi + Н2 літій пропилат 3) Взаємодія з гідрогенгалогенами (HF, HCl, HBr, HI). При взаємодії спиртів з гідрогенгалогенами відбувається заміщення гідроксильної групи на атом галогену: СН3СН2ОН + HCl → СН3СН2Cl + Н2O хлоретан СН3ОН + НBr → СН3Br + Н2О бромметан 4) Дегідратація спиртів (відщеплення молекули води). а) внутрішньомолекулярна дегідратація спиртів відбувається за температури близько 1800 С у присутності концентрованих сульфатної або фосфатної кислот, алюміній оксиду. При цьому утворюються алкени.
б) міжмолекулярна дегідратація відбувається за температур нижче 180°С:
Застосування гліцеролу. За рахунок своєї гігроскопічності використовується для пом’якшування шкіри в шкіряній промисловості і фармації. Застосовується в паперовій, парфумерній і фармакологічній промисловості. Його естер з нітратною кислотою (нітрогліцерол) – надзвичайно вибухонебезпечна речовина, а його 1% -й розчин використовується як ліки при серцево-судинних захворюваннях.
Вищі карбонові кислоти Вищими називають кислоти, що містять у молекулі велику кількість атомів Карбону. З вищих одноосновних карбонових кислот найбільше значення мають С15Н31СООН пальмітинова (пентадеканова) кислота С17Н35СООН стеаринова (гептадеканова) кислота Вони являють собою безбарвні тверді речовини, нерозчинні у воді. Стеаринову й пальмітинову кислоти можна виділити з рослинних і тваринних жирів. У промисловості ці кислоти одержують шляхом окиснення парафіну, який виділяють із нафти. Пальмітинова і стеаринова кислоти проявляють властивості, характерні для карбонових кислот, наприклад взаємодіють з лугами: C17H35COOH + NaOH → C17H35COONa + H2O натрій стеарат Солі цих кислот – основні компоненти мила. Стеаринову й пальмітинову кислоти застосовують у виробництві мийних засобів, лаків, фарб, лінолеуму, гуми. Важливим представником ненасичених карбонових кислот є олеїнова кислота С17Н33СООН. СН3 – (СН2)7 – СН = СН – (СН2)7 – СООН Олеїнова кислота – масляниста рідина, що у формі естерів гліцерину входить до складу рослинних жирів. Вона має властивості кислот, зумовлені наявністю карбоксильної групи: С17Н33СООН + КОН → С17Н33СООК + Н2О калій олеат Також олеїнова кислота проявляє властивості ненасичених вуглеводнів, зумовлені наявністю подвійного зв’язку в карбоновому ланцюзі. Так, наприклад, олеїнова кислота знебарвлює бромну воду: СН3 – (СН2)7 – СН = СН – (СН2)7 – СООН + Br2 → → СН3 – (СН2)7 – СН - СН – (СН2)7 – СООН | | Br Br У результаті гідрування ненасичена олеїнова кислота перетворюється на насичену стеаринову кислоту: С17Н33СООН + Н2 → С17Н35СООН До вищих ненасичених карбонових кислот належать також лінолева С17Н31СООН та ліноленова С17Н29СООН кислоти.
Жири. Жири – це естери трьохатомного спирту гліцеролу та вищих карбонових кислот. Загальна назва таких сполук — тригліцериди. Склад і будову жирів можна зобразити загальною формулою естеру, в якому залишки карбонових кислот позначені радикалами R 1, R 2, R 3: CH2–O–CO– R 1 | CH–O–CO– R 2 | CH2–O–CO– R 3. Найчастіше до складу молекул жирів входять радикали таких вищих карбонових кислот: пальмітинової C15H31COOH, стеаринової C17H35COOH, олеїнової C17H33COOH. CH2–O–CO– С17Н35 | тристеарат, естер гліцеролу та стеаринової CH–O–CO– С17Н35 кислоти | CH2–O–CO– С17Н35 За походженням жири бувають: 1) рослинні (олії); 2) тваринні; 3) комбіновані. За консистенцією: 1) тверді (утворені насиченими вищими карбоновими кислотами); 2) рідкі (утворені ненасиченими вищими карбоновими кислотами). До складу природних жирів входять як правило вищі карбонові кислоти з парним числом атомів Карбону. Приклади природних жирів: CH2–O–CO– С17Н33 | Вершкове масло: олео-пальміно-бутират CH–O–CO– С17Н31 | CH2–O–CO– С3Н7 CH2–O–CO– С17Н33 | Свиняче сало: олео-пальміно-стеарат CH–O–CO– С17Н31 | CH2–O–CO– С17Н35 Лляна олія: 61,5% гліцеридів лінолевої кислоти. Соняшникова, горіхова олії: 30 – 50% гліцеридів лінолевої кислоти, решта – олеїнової кислоти. Утворюються жири під час реакцій етерифікації за участі гліцеролу та вищих карбонових кислот: CH2–OН CH2 – O – CO – C17H35 | | CH–OН + 3 С17Н35СООН → CH – O – CO – C17H35 + 3 H2O | | CH2–OН CH2 – O – CO – C17H35 тристеарат
Хімічні властивості жирів 1) Гідроліз – розкладання жирів під дією води. Протікає в присутності каталізаторів (кислоти, луги, оксиди металів). а) кислотний гідроліз: у присутності кислот гідроліз жирів призводить до утворення гліцеролу та відповідних карбонових кислот: CH2 – O – CO – C17H35 CH2 – OH | | CH – O – CO – C17H35 + 3 H2O → CH – OH + 3 C17H35COOH | | CH2 – O – CO – C17H35 CH2 – OH б) лужний гідроліз: у присутності лугів гідроліз жирів призводить до утворення гліцеролу та солей вищих карбонових кислот: CH2 – O – CO – C17H35 CH2 – OH | | CH – O – CO – C17H35 + 3 NaOH → CH – OH + 3 C17H35COONa | | CH2 – O – CO – C17H35 CH2 – OH Вищі солі карбонових кислот є основою мила. Натрієві солі (С17Н35СOONa, C15H31COONa) входять до складу твердого мила, а калієві солі ((С17Н35СOOК, C15H31COOК) входять до складу рідкого мила. 2) Гідрування ненасичених жирів. Жири, що утворені ненасиченими карбоновими кислотами (рідкі жири) можуть прєднувати молекули водню і перетворюватись на насичені (тверді) жири. Так. Наприклад рідкий жир три олеат при гідруванні перетворюється на твердий жир тристеарат: CH2 – O – CO – C17H33 СН2 – О – СО – С17Н35 | | CH – O – CO – C17H33 + 3 Н2 → CH - О – СО – С17Н35 | | CH2 – O – CO – C17H33 CH2 – O – СО – С17Н35 триолеат тристеарат Ця реакція має велике промислове значення. За її допомогою соняшникову олію перетворюють на твердий жир маргарин, що є замінником природних твердих жирів тваринного походження. Біологічна роль жирів. Жири є найважливішими продуктами харчування. В організмі людини основна функція жиру – бути джерелом енергії. Окиснення 1г жиру спричиняє виділенню 39 кДж енергії. Однак буде нерозумним, виходячи з цього, прагнути забезпечити свій організм виключно жирами, оскільки, незважаючи на те, що вони багаті на енергію, жири важко засвоюються. Добовий раціон людини має містити 60 – 70г жиру. Але не можна забувати, що надлишкова кількість жиру, навіть у раціоні здорової людини, дуже шкідлива. Жири не розчиняються ані водою, ані травними соками. В організмі вони розщеплюються й емульгуються за сприяння жовчі. Зайва кількість жиру не встигає проемульгуватися, порушує травні процеси та спричиняє неприємне відчуття печії. Жири є не тільки джерелом енергії в організмі, а й джерелом води. Завдяки цій воді живуть верблюди тривалий час без свіжої води. Для розвитку зародка курчати в інкубаційний період потрібна вода, а надходження її ззовні відсутнє. Зародок забезпечується водою окисленого жиру. Жири необхідні й мешканцям холодного клімату: тюленям, моржам. Підшкірний жир допомагає зберегти внутрішнє тепло. Будь – якій тварині жирові відкладення пом’якшують силу різних поштовхів і ударів. Крім того, жири для тварин – мастильний матеріал. Відомо, водоплавні птахи самі проводять змащення під час чищення пір’я. Також жири є джерелом вітамінів A, D, E. Застосування жирів. 1) харчова промисловість; 2) маргарин; 3) у домашніх умовах; 4) мило; 5) гліцерин; 6) медицина; 7) оліфа; 8) косметичні засоби.
Вуглеводи. Вуглеводи – найважливіші природні сполуки, що характеризуються біологічною активністю, відіграють важливу роль у житті рослин, тварин, людини. Свою назву одержали через початкові уявлення про склад вуглеводів як сполук Карбону з водою: Cn(H2O)m. Глюкоза: С6Н12О6 ↔ С6(Н2О)6 Сахароза: С12Н22О11 ↔ С12(Н2О)11 Назва «вуглеводи» збереглася дотепер, хоча й не виражає дійсної, досить складної будови цих речовин. У рослинах міститься до 80% вуглеводів. В організмі людини й тварин – до 20%. Їжа людини на 70% складається з вуглеводів. Утворюються вуглеводи у зелених рослинах під час процесу фотосинтезу: 6 СО2 + 6 Н2О → С6Н12О6 + 6 О2 глюкоза 12 СО2 + 11 Н2О → С12Н22О11 + 12 О2 сахароза 6n CO2 + 5n H2O → (C6H10O5)n + 6nO2 крохмаль
Класифікація вуглеводів. В основу класифікації вуглеводів покладено їх відношення до реакцій гідролізу. Вуглеводи ________________________________|_________________________________ ↓ ↓ ↓ Моносахариди Дисахариди Полісахариди Моносахариди – це вуглеводи, що не вступають у реакцію гідролізу (глюкоза, фруктоза). С6Н12О6 + Н2О Дисахариди – це вуглеводи, молекула яких під час гідролізу розпадається на дві молекули моносахаридів: С12Н22О11 + Н2О → С6Н12О6 + С6Н12О6 Полісахариди – це вуглеводи, молекула яких під час гідролізу розпадається на безліч молекул моносахаридів: (С6Н10О5)n + nH2O → n C6H12O6 Глюкоза Молекулярна формула - С6Н12О6. Молекула глюкози містить п’ять гідроксидних груп – ОН та альдегідну групу – СН = О Тобто за своїми функціями глюкоза є альдегідоспирт. Структурна формула глюкози має вигляд:
Як показали дослідження, у розчині глюкози є молекули лінійної й циклічної будови. Фізичні властивості і поширення у природі. Глюкоза - білий кристалічний порошок, добре розчинний у воді. Температура плавлення близько 150ºС. Солодка на смак. Глюкозудобув 1802 р. французький хімік Ж. Пруст з винограду, тому її дотепер часто називають виноградним цукром. У природі глюкоза трапляється не лише у виноградному соку, а й у соках багатьох інших фруктів і ягід та чи не в усіх органах зелених рослин. Бджолиний мед також містить глюкозу. Особливо багаті на глюкозу виноград, черешні, вишні, малина, суниці, сливи, кавуни. З овочів найбільше глюкози містить гарбуз, білоголовкова капуста та морква. Міститься глюкоза також у крові людини і тварин (близько 0,1%). Хімічні властивості. 1) Окиснення: С6Н12О6 + 6 О2 → 6 СО2 + 6 Н2О У результаті окисненя глюкози в тканинах організму вивільняється енергія, необхідна для нормальної життєдіяльності організмів. 2) Взаємодія з купрум (ІІ) гідроксидом. Як багатоатомний спирт глюкоза розчиняє свіжоотриманий Cu(OH)2 утворюючи яскраво-синій розчин. 3) Бродіння – розклад цукристих речовин під дією біологічно активних каталізаторів (ферментів). Спиртове бродіння – відбувається під дією ферменту дріжджів:
Молочнокисле бродіння – відбувається під дією молочнокислих бактерій:
Застосування глюкози. 1) як цінний харчовий продукт; 2) в кондитерському виробництві; 3) у медицині для приготування лікарських препаратів, консервування крові, внутрішньовенного вливання; 4) у виробництві дзеркал та іграшок (сріблення); 5) під час фарбування та обробки тканин і шкір. Сахароза Фізичні властивості та поширення у природі. Найважливішою сполукою з дисахаридів є сахароза. Її молекулярна формула C12H22O11. Сахароза – це безбарвна кристалічна речовина, солодка на смак (солодша за глюкозу), добре розчиняється у воді. При нагріванні до 190–200 °С її кристали плавляться, утворюючи карамель. У великих кількостях сахароза міститься у цукрових буряках, стеблах цукрової тростини, а також у березовому та кленовому соках, у багатьох плодах. У промисловості сахарозу виробляють із соку цукрової тростини (вміст 14 -16%), цукрового буряку (16 – 21%) та деяких інших рослин, наприклад, канадського клену, земляної груші. Хімічні властивості. Найважливішою властивістю сахарози є гідроліз. Як дисахарид сахароза розпадається на дві молекули моносахаридів. Одна з таких молекул – молекула глюкози,інша – фруктози: С12Н22О11 + Н2О → С6Н12О6 + С6Н12О6 глюкоза фруктоза Ця хімічна реакція використовується для одержання штучного меду. Застосування сахарози. 1) Харчова промисловість; 2) У медицині для виготовлення сиропів; 3) Як пластифікатор у виробництві пластмас.
Крохмаль і целюлоза. Крохмаль та целюлоза є природними полімерами, їх макромолекули складаються з великої кількості залишків глюкози і мають хімічну формулу (С6Н10О5)n. Але не зважаючи на подібність складу, властивості крохмалю та целюлози дуже відрізняються. Пояснюється це значними відмінностями у складі та будові молекул. Порівняльна характеристика крохмалю та целюлози.
Утворена у результаті фотосинтезу глюкоза накопичується в плодах, листі та стеблах рослин у формі крохмалю та целюлози. Найбільше крохмалю містять картопля (до 22%), зерна пшениці та кукурудзи (до 70%), зерна рису (до 80%). Целюлоза є основою клітинної оболонки вищих рослин, її масова частка у деревині складає 50%. Високий вміст целюлози у волокнах льону та конопель. Прикладами практично чистої целюлози є волокна бавовни, папір та медична вата. Наприклад волокна бавовни на 98% складаються з целюлози. Застосування крохмалю. 1) Крохмаль – основний вуглевод їжі людини; безпосередньо він, подібно до жирів, організмом не засвоюється. Гідроліз крохмалю під дією ферментів починається при пережовування їжі в роті, продовжується в результаті гідролізу, всмоктується в кров і надходити до печінки, а звідти – до всіх тканин організму. Надлишок глюкози відкладається в печінці у вигляді високомолекулярного вуглеводу глікогену, що знову гідролізується до глюкози в міру витрачання її в клітинах організму. 2) У харчовій промисловості реакцій гідролізу крохмалю використовується для одержання глюкози й патоки (також ця реакція застосується й у лікеро - горілчаній промисловості).
Якщо процес гідролізу не доводить до кінця, то в результаті виходить густа солодка маса – суміш декстринів і глюкози - патока, яка використовується в кондитерській справі. 3) Декстрини, які одержують з крохмалю, використовують як клей. 4) Крохмаль застосовується для накрохмалювання білизни: під дією нагрівання гарячого праскою він перетворюється на декстрини, що склеюють волокна тканини й утворюють щільну плівку, яка охороняє тканину від швидкого забруднення. Крім того, це полегшує наступне прання, оскільки часточки бруду, зв’язані з декстринами, значно легше змиваються водою. 5) Крохмаль іде на виробництво етилового спирту. У цьому випадку спочатку його піддають гідролізу під дією ферменту, що міститься в солоді, а продукт гідролізу потім зброджують у присутності дріжджів у спирт. Етиловий спирт, що йде на промислові потребі (синтез каучуку), одержують синтетичним шляхом з етилену й гідролізом целюлози.
Застосування целюлози. 1) Целюлоза в складі деревини завдяки своїй механічній міцності використовується в будівництві, з неї виробляють різного роду столярні вироби. 2) У вигляді волокнистих матеріалів (бавовни, льону, конопель) целюлоза використовується для виготовлення ниток, тканин, канатів. 3) Виділена з деревини (звільнена від супровідних речовин) целюлоза йде на виготовлення паперу. 4) З естерів целюлозі виготовляють нітролаки, кіноплівку, медичний колодій, штучне волокно й вибухові речовини. 5) Сучасні науки розглядають целюлозу як перспективну сировину для отримання вуглеводів та інших цінних органічних речовин. Це досягається методами біотехнології, яка розглядає використання ферментів (біохімічних каталізаторів). Отримані таким чином продукти, поки що, мають порівняно невисоку вартість, але у майбутньому до нафти, природного газу та кам’яного вугілля додасться ще й біомаса.
Амінокислоти.
Амінокислоти — нітрогеновмісні органічні речовини, у молекулах яких міститься аміногрупа -NH2 і карбоксильна група -СООН, з’єднані з вуглеводневим радикалом. Загальна формула амінокислот: H2N - R - СООН. За систематичною номенклатурою назви амінокислот утворюються з назв відповідних кислот з додаванням префікса аміно- і зазначенням місця розташування аміногрупи відносно карбоксильної групи. Наприклад:
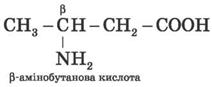
Часто використовується також інший спосіб побудови назв амінокислот, відповідно до якого до тривіальної назви карбонової кислоти додається префікс аміно - із зазначенням положення аміногрупи літерою грецького алфавіту. Наприклад:
Для α-амінокислот R-CH(NH2)COOH, які відіграють винятково важливу роль у процесах життєдіяльності тварин і рослин, застосовуються тривіальні назви. Найпростіший представник класу амінокислот має формулу: H2N-CH2-COOH — аміноетанова (або амінооцтова) кислота — перший член гомологічного ряду одноосновних насичених амінокислот.
Фізичні властивості. За фізичними властивостями амінокислоти — білі кристалічні речовини, добре розчинні у воді, багато які з них мають солодкий смак. Амінокислоти дуже поширені в природі. Це цеглинки, з яких побудовані всі рослинні й тваринні білки. Хімічні властивості.
Унаслідок наявності в молекулах амінокислот функціональних груп кислотного й основного характеру а-амінокислоти є амфотерними сполуками, тобто вони утворюють солі як з кислотами, так і з лугами. 1) Як основи амінокислоти взаємодіють з кислотами: H2N – CH2 – COOH + HCl → [H3N – CH2 COOH]+ Cl- хлоридна сіль амінооцтової кислоти 2) Як кислоти амінокислоти взаємодіють з лугами: H2N – CH2 – COOH + NaOH → H2N – CH2 – COONa + H2O натрієва сіль амінооцтової кислоти 3) Утворення пептидних зв’язків: аміногрупа однієї молекули амінокислоти може взаємодіяти з карбоксильною групою ін
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 627; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.42.25 (0.017 с.) |

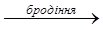 2СН3СН2OH + 2CO2
2СН3СН2OH + 2CO2 СН3СН2OH
СН3СН2OH