Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Загальна схема виробництва цукру.Содержание книги Поиск на нашем сайте Сировина для виробництва цукру: цукровий буряк, цукрова тростина. Проомислове виробництво цукру складається з таих етапів: 1) механічна обробка (миття, подрібнювання цукрового буряка на стружку); 2) дифузія (обробка гарячою водою). У результаті сахароза переходить у розчин; 3) дефекація (обробка «вапняним молоком» - розчином Са(ОН)2). У результаті домішки – органічні кислоти, білки, барвники, від яких необхідно очистити сахарозу, випадають в осад, а сахароза залишається в розчині у вигляді сахарату: С12Н22О11 + Са(ОН)2 → С12Н22О11 ∙ СаО + Н2О 4) сатурація (обробка розчину сахарату карбон (IV) оксидом для осадження кальцій карбонату). Сахароза залишається в розчині: С12Н22О11 ∙ СаО + СО2 → С12Н22О11 + СаСО3 ↓ 5) випарювання розчину у вакуумних апаратах і центрифугування (кристалізація розчину сахарози). 6) додаткове очищення цукру (рафінування). Застосування сахарози. 1) Харчова промисловість; 2) У медицині для виготовлення сиропів; 3) Як пластифікатор у виробництві пластмас.
Крохмаль і целюлоза. Крохмаль та целюлоза є природними полімерами, їх макромолекули складаються з великої кількості залишків глюкози і мають хімічну формулу (С6Н10О5)n. Але не зважаючи на подібність складу, властивості крохмалю та целюлози дуже відрізняються. Пояснюється це значними відмінностями у складі та будові молекул. Порівняльна характеристика крохмалю та целюлози.
Утворена у результаті фотосинтезу глюкоза накопичується в плодах, листі та стеблах рослин у формі крохмалю та целюлози. Найбільше крохмалю містять картопля (до 22%), зерна пшениці та кукурудзи (до 70%), зерна рису (до 80%). Целюлоза є основою клітинної оболонки вищих рослин, її масова частка у деревині складає 50%. Високий вміст целюлози у волокнах льону та конопель. Прикладами практично чистої целюлози є волокна бавовни, папір та медична вата. Наприклад волокна бавовни на 98% складаються з целюлози. Хімічні властивості крохмалю та целюлози. 1) Крохмаль та целюлоза як полісахариди під час гідролізу утворюють моносахарид глюкозу: (С6Н10О5)n + nH2O → nC6H12O6 Гідроліз крохмалю відбувається ступінчато: (С6Н10О5)n + nH2O → (C6H10O5)m → m C12H22O11 → n C6H12O6 крохмаль декстрини мальтоза глюкоза Крім того крохмаль та целюлоза проявляють специфічні, тільки їм притаманні властивості. 2) Взаємодія крохмалю з йодом. Під час дії спиртового розчину йоду на крохмаль виникає характерне темно-синє забарвлення. Ця реакція є якісною на крохмаль, тобто дозволяє його виявити серед інших речовин або у продуктах харчування (картопля, хліб і т.д.).
3) Горіння целюлози. Целюлоза, на відміну від крохмалю, дуже добре горить: (С6Н10О5)n + 6nO2 → 6nСО2 + 5nН2О 4) Термічний розклад целюлози. При нагріванні целюлози без доступу повітря утворюються метиловий спирт, ацетон, оцтова кислота та інші органічні речовини. Застосування крохмалю та целюлози. Застосування крохмалю. 1) Крохмаль – основний вуглевод їжі людини; безпосередньо він, подібно до жирів, організмом не засвоюється. Гідроліз крохмалю під дією ферментів починається при пережовування їжі в роті, продовжується в результаті гідролізу, всмоктується в кров і надходити до печінки, а звідти – до всіх тканин організму. Надлишок глюкози відкладається в печінці у вигляді високомолекулярного вуглеводу глікогену, що знову гідролізується до глюкози в міру витрачання її в клітинах організму. 2) У харчовій промисловості реакцій гідролізу крохмалю використовується для одержання глюкози й патоки (також ця реакція застосується й у лікеро - горілчаній промисловості).
Якщо процес гідролізу не доводить до кінця, то в результаті виходить густа солодка маса – суміш декстринів і глюкози - патока, яка використовується в кондитерській справі. 3) Декстрини, які одержують з крохмалю, використовують як клей. 4) Крохмаль застосовується для накрохмалювання білизни: під дією нагрівання гарячого праскою він перетворюється на декстрини, що склеюють волокна тканини й утворюють щільну плівку, яка охороняє тканину від швидкого забруднення. Крім того, це полегшує наступне прання, оскільки часточки бруду, зв’язані з декстринами, значно легше змиваються водою. 5) Крохмаль іде на виробництво етилового спирту. У цьому випадку спочатку його піддають гідролізу під дією ферменту, що міститься в солоді, а продукт гідролізу потім зброджують у присутності дріжджів у спирт. Етиловий спирт, що йде на промислові потребі (синтез каучуку), одержують синтетичним шляхом з етилену й гідролізом целюлози.
Застосування целюлози. 1) Целюлоза в складі деревини завдяки своїй механічній міцності використовується в будівництві, з неї виробляють різного роду столярні вироби. 2) У вигляді волокнистих матеріалів (бавовни, льону, конопель) целюлоза використовується для виготовлення ниток, тканин, канатів. 3) Виділена з деревини (звільнена від супровідних речовин) целюлоза йде на виготовлення паперу. 4) З естерів целюлозі виготовляють нітролаки, кіноплівку, медичний колодій, штучне волокно й вибухові речовини. 5) Сучасні науки розглядають целюлозу як перспективну сировину для отримання вуглеводів та інших цінних органічних речовин. Це досягається методами біотехнології, яка розглядає використання ферментів (біохімічних каталізаторів). Отримані таким чином продукти, поки що, мають порівняно невисоку вартість, але у майбутньому до нафти, природного газу та кам’яного вугілля додасться ще й біомаса.
Нітрогеновмісні органічні сполуки. Амінокислоти.
Амінокислоти — нітрогеновмісні органічні речовини, у молекулах яких міститься аміногрупа -NH2 і карбоксильна група -СООН, з’єднані з вуглеводневим радикалом. Загальна формула амінокислот: H2N - R - СООН. За систематичною номенклатурою назви амінокислот утворюються з назв відповідних кислот з додаванням префікса аміно- і зазначенням місця розташування аміногрупи відносно карбоксильної групи. Наприклад:
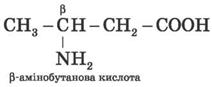
Часто використовується також інший спосіб побудови назв амінокислот, відповідно до якого до тривіальної назви карбонової кислоти додається префікс аміно - із зазначенням положення аміногрупи літерою грецького алфавіту. Наприклад:
Для α-амінокислот R-CH(NH2)COOH, які відіграють винятково важливу роль у процесах життєдіяльності тварин і рослин, застосовуються тривіальні назви. Найпростіший представник класу амінокислот має формулу: H2N-CH2-COOH — аміноетанова (або амінооцтова) кислота — перший член гомологічного ряду одноосновних насичених амінокислот.
Фізичні властивості. За фізичними властивостями амінокислоти — білі кристалічні речовини, добре розчинні у воді, багато які з них мають солодкий смак. Амінокислоти дуже поширені в природі. Це цеглинки, з яких побудовані всі рослинні й тваринні білки. Хімічні властивості.
Унаслідок наявності в молекулах амінокислот функціональних груп кислотного й основного характеру а-амінокислоти є амфотерними сполуками, тобто вони утворюють солі як з кислотами, так і з лугами. 1) Як основи амінокислоти взаємодіють з кислотами: H2N – CH2 – COOH + HCl → [H3N – CH2 COOH]+ Cl- хлоридна сіль амінооцтової кислоти 2) Як кислоти амінокислоти взаємодіють з лугами: H2N – CH2 – COOH + NaOH → H2N – CH2 – COONa + H2O натрієва сіль амінооцтової кислоти 3) Утворення пептидних зв’язків: аміногрупа однієї молекули амінокислоти може взаємодіяти з карбоксильною групою іншої молекули амінокислоти: О Н O H || | || | H2N – CH2 – С - OH + H - N – CH2 – COOH → H2N –CH2– C – N –CH2-COOH + H2O дипептид Оскільки на кінцях молекули дипептиду зберігаються аміно- та карбоксильна групи, можливе приєднаня наступних молекул амінокислот з утворенням поліпептиду. Пептидний зв’язок - СО – NH - є ознакою білкових молекул. А реакція взаємодії амінокислот між собою лежить в основі синтезу білків.
Білки. Білки – це природні полімери, що складаються зі з’єднаних у певній послідовності залишків α-амінокислот. Вміст білків в організмі людини: у м’язах – 80%, у шкірі, в печінці 57%, в кістках 28%. До складу живих організмів входять Хімічний склад білків. У 1810 вчені Ж.Гей–Люссак і Д.Бісноз встановили елементарний склад білків. Вони з’ясували, що до їх складу входять такі елементи як Карбон (50 – 55%), Гідроген (близько 7%), Оксигену (21,5 – 23,5%), Нітрогену (15 – 17%), Сульфуру (0,3 – 2,5%). Крім того, в білках може міститись невелика кількість Фосфору, галогенів, металічних елементів. Наприклад, формула гемоглобіну, білка крові С759H1208N210S2O204Fe4. Класифікація. Через наявність різноманітних функціональних груп білки не можна віднести до якогось певного класу органічних сполук. Вони поєднують ознаки різних класів, що дає нову якість. За хімічним складом: 1) Прості (протеїни) – гідролізуються з утворенням тільки амінокислот. 2) Складні (протеїди) – в результаті гідролізу утворюють крім амінокислот ще вуглеводи, ортофосфатну кислоту, нуклеїнові кислоти тощо. За фізіологічними функціями: 1) Фібрилярні – з них побудовані волокна живих тканин (шкіра, волосся, нігті, роги, пір’я, м’язи). 2) Глобулярні – підтримують і регулюють життєві процеси. До них належать ферменти, гормони. Будова молекул. Білок – вища форма розвитку речовин. Величезна різноманітність білків, що містяться в органах і тканинах тварин, рослин, мікроорганізмів, обумовлена безмежним числом комбінацій амінокислот, які різняться поєднанням різної кількості неоднакових амінокислот, порядком їх чергування в поліпептидних ланцюгах і просторовою структурою ланцюгів. Відомо чотири рівні структурної організації білків: первинна, вторинна, третинна і четвертинна. ^ Первинна структура – це послідовність амінокислотних залишків у поліпептидному ланцюгу. Різноманітність білкових молекул зумовлена різними комбінаціями залишків лише 20 ά-амінокислот. Їх кількість у молекулах окремих білків коливається у великих межах. Приміром в інсуліні їх 51, у міоглобіні – близько 140. Тому й відносна молекулярна маса білків різноманітна. Наприклад, в інсуліні вона становить близько 6500, а в білка вірусу грипу – 320 000 000. Таким чином первинна структура білка виникає внаслідок утворення пептидних зв’язків між амінокислотними залишками, а певна послідовність амінокислот зумовлює специфічні функції білка в організмі.
^ Вторинна структура характеризує просторове розміщення молекули білка внаслідок утворення водневих зв’язків між групами N-Н і С=О. Якщо полярні групи фрагментів первинної структури віддалені одна від одної, то при цьому утворюються складчасті шари з кількох зигзагуватих поліпептидних ланцюгів. Якщо ж полярні групи фрагментів первинної структури розташовані близько, то утворюється так звана α-спіраль, один виток якої містить чотири амінокислотні залишки.
^ Третинна структура зумовлена здатністю поліпептидної спіралі закручуватись певним чином утворюючи грудку, або глобулу (кульку). Така структура підтримується ковалентними зв’язками, що виникають між функціональними групами різної хімічної природи.
^ Четвертинна структура білків виникає внаслідок об’єднання окремих глобул, які разом утворюють функціональну одиницю. Наприклад: четвертинна структура гемоглобіну складається з чотирьох макромолекул. Вони утворюють надмолекулярну структуру сферичної форми.
Фізичні властивості. Фібрилярні білки нерозчинні у воді, глобулярні – розчинні у воді та водних розчинах кислот, лугів, солей. Деякі білки можна виділити в кристалічному стані (гемоглобін крові, білок курячого яйця). Хімічні властивості. 1) Гідроліз. Під дією ферментів або внаслідок нагрівання з розчином кислоти чи лугу білки гідролізуються утворюючи суміш відповідних амінокислот
Н2N – CH2 – C – N – CH – COOH + Н2О →Н2N–CH2–C–ОН + Н2N-CH-C-OH ІІ | I || | || О Н CH3 О CH3 O Дипептид (гліцил-аланін)
2) Денатурація. Це процес руйнування структури білка (вторинної та третинної) під дією різних чинників: нагрівання, радіації, лугів, кислот, солей важких металів, сильного струшування тощо. Причина денатурації полягає в порушенні зв’язків, які обумовлюють вторинну та третинну структури. Денатурацію ми спостерігаємо, коли готуємо їжу, наприклад, варимо м’ясо чи яйця. 3) Кольорові реакції білків.
а) Біуретова реакція: під дією на білок лугу та кількох крапель купрум (ІІ) сульфату утворюється фіолетове забарвлення.
б) Ксантопротеїнова реакція: при дії на білок концентрованою нітратною кислотою виникає жовте забарвлення, яке при додаванні нашатирного спирту NH4OH перетворюється на помаранчеве.
4)Термічний розклад. Під час сильного нагрівання відбувається розклад білків з виділенням летких речовин, які мають характерний запах паленого пір’я. Це явище використовують для виявлення білків.
|
|||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 1042; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.113 (0.011 с.) |





 видів білків, з них 5 млн. – до складу людини і тварини.
видів білків, з них 5 млн. – до складу людини і тварини.