Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Це сполучення великої кількості алкенів з утворенням однієї макромолекули полімеруСодержание книги
Поиск на нашем сайте
nСН2 = СН2 → (-СН2-СН2-)n етилен поліетилен nСН2 = СН – СН3 → (-СН2 - СН -) пропілен | CН3 поліпропілен
IІ. реакція окиснення 1. реакція горіння (повне і неповне): Внаслідок реакції повного горіння вуглеводнів утворюється завжди СО2 і Н2О.(а при неповному окисненні - СО і Н2О або С і Н2О) 2C3H6 + 9О2 → 6CО2 + 6H2О
2. реакція окиснення розчином KMnO4 Алкени окиснюються розчином KMnO4 і знебарвлюють його(із фіолетового на безбарвний) – це якісна реакція на ненасичені вуглеводні.
СН2 = СН2 + Н2О + [О] → СН2 – СН2 розчин KMnO4 | | ОН ОН етиленгліколь Добування алкенів І. С2Н4 1. У промисловості одержуютьреакцією дегідрування етану: С2Н6 → С2Н4 + Н2 2. У лабораторії реакцією дегідратації етилового спирту в присутності конц. сульфатної кислоти: C2H5 -OH → C2H4 ↑ + H2О
ІІ. Загальні методи добування 1. Реакція реакція дегідрогалогенування моногалогеналканів в присутності спиртового розчину лугу! ( відщеплення HCl, HBr, HI) Спирт.р-н лугу C2H5Cl → C2H4 + HCl або C2H5Cl + NaOH → C2H4 ↑ + NaCl + Н2О
Застосування алкенів І. С2Н4 1. для виробництва пластмас (поліетилену, поліпропілен); 2. для дозрівання овочів та фруктів; 3. для одержання розчинників, спиртів.
Алкіни Алкіни – це ненасичені вуглеводні в молекулах яких є тільки один потрійний зв’язок між атомами Карбону. Загальна формула алкенів: СnH2n-2 де: n = 2,3,4 і т.д.
Номенклатура алкінів
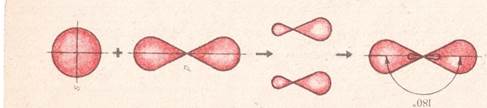
За міжнародною (систематичною або номенклатурою ІЮПАК) назви алкінів походять від відповідних назв алканів із заміною закінчення ан на ін або ин. Історичну номенклатуру має тільки перший представник - С2Н2 – етин(ацетилен). С2Н2 С3Н4 С4Н6 СН ≡ СН СН ≡ С – СН3 СН ≡ С - СН2 - СН3 Етин пропін бут-1-ин ацетилен 5 С2Н5 СН3 1 2 3| 4 5 |6 СН≡С─СН─СН2─С─СН3 | СН3 3-етил-5,5-диметилгекс-1-ин Будова алкінів Для двох атомів Карбону при потрійному зв’язку в алкінах характерна sp-гібридизація – це означає, що із 4 електронів (1s і 3p) взаємодіє тільки одна s-електронна хмаринка і 1р-електронні хмаринки атома Карбону і утворюються дві гібридизовані (одинакові) хмаринки:
Ці електронні хмаринки відштовхуються і розміщуються на лінії! двох атомів Карбону і розміщуються під кутом 1800. Між атомами С – С і С -Н виникають – σ(сигма) - зв’язки.
Кожен із двох атомів Карбону при потрійному зв’язку ще має по два не гібридизованих р-електронів(гантель), які розміщені перпендикулярно до лінії. Р-електронні хмаринки перекриваючись над і під лінією, а також з тилу і фронту лінії утворюють два – π(пі)- зв’язки.
π- зв’язки є слабшими за σ - зв’язки і легко може розірватися бо вони розпорошені, утворюєься у двох точках простору. Отже, потрійний зв’язок містить 1 σ(сигма) - зв’язок і 2π(пі) - зв’язки.
Віддаль між атомами Карбону (С-С) в алкінах становить 0,120 нм.
Фізичні властивості алкінів Етин – бутин (С2Н2 – С4Н6) – гази, нерозчинні у воді. Працюючи з ацетиленом, його не можна подавати в реакційну суміш металічними трубками, а тільки трубками, виготовленими з гуми або скла, бо буде вибух.
Хімічні властивості алкінів Для алкінів найбільш характерними будуть реакції приєднання, які відбуваються із розривом потрійного, а саме поступовим розривом двох π - зв’язків. На відміну від алкенів до молекул алкінів приєднуються по дві молекули Н2, Cl2, HCl. І. Реакції приєднання 1. реакція гідрування СН ≡ СН + 2Н2 → СН3-СН3 С2 Н2 + 2Н2 → С2Н6 2. реакція галогенування . 1. C3H4 + 2Cl2 → C3H4Cl4 СН ≡ С – СН3 + 2Cl2 → СНCl2 – СCl2 – СН3
1,1,2,2-тетрахлоропропан (Алкіни знебарвлюють«бромну воду» - це якісна реакція на ненасичені вуглеводні) 3. реакція гідрогалогенування Це реакція приєднання до алкенів галогеноводнів (HCl, HBr, HI) СН ≡ СН + 2HBr → СН3-СН Br2
А гомологи ацетилену вступають в реакцію гідро галогенування за правилом Марковникова. СН ≡ С – СН3 + 2НCl → СН3 - СCl2 – СН3
2,2-дихлоропропан 4. реакція гідратації або реакція Кучерова (тільки для ацетилену) О СН ≡ СН + HОН → СН3-С оцтовий альдегід Н Реакція полімеризації Тільки для ацетилену характерна реакція тримеризації: 3 С2Н2 → С6Н6 етин бензен IІ. реакція окиснення 1. реакція горіння (повне і неповне): Внаслідок реакції повного горіння вуглеводнів утворюється завжди СО2 і Н2О. C3H4 + 4О2 → 3CО2 + 2H2О 2C3H4 + 5О2 → 6CО + 4H2О C3H4 + О2 → 3C + 2H2О 2. реакція окиснення розчином KMnO4 Алкіни окислюються розчином KMnO4 і знебарвлюють його – це якісна реакція на ненасичені вуглеводні.
IІІ. Реакція заміщення (тільки для алкінів) – це якісна реакція на алкіни. 1. реакція алкінів з AgNO3 і Cu+1NO3: Під час реакції тільки атоми Гідрогену при потрійному зв´язку заміщуються на одновалентні метали Ag, Cu і утворюються ацетиленіди металів (вибухові речовини). Вона характерна тільки для алкінів як ненасичених вуглеводнів (збільшується віддаль між С-Н, а віддаль між С≡С зменшується у порівнянні з (С=С) зв’язком) СН ≡ СН + 2AgNO3 → СAg ≡ СAg ↓ + 2HNO3 Аргентум (І) ацетиленід
Добування алкінів І. С2Н2 1. У промисловості одержуютьреакцією розкладу метану: 2СН4 → С2Н2 + 3Н2
2. У лабораторії реакцією кальцій карбіду з водою або кислотами СаC2 +2H-OH → C2H2 ↑ + Са(OH)2↓ або HCl (CaO +3C = CaC2 + CO - добування СаС 2)
ІІ. Загальні методи добування 1. Реакція реакція дегідрогалогенування дигалогеналканів ( два галогени можуть знаходитися біля одного атома Карбону або біля двох сусідніх атомів Карбону ) в присутності спиртового розчину лугу ( відщеплення HCl, HBr, HI) Спирт.р-н лугу СН2Cl- CH2Cl → CH≡CH + 2HCl 1,2-дихлороетан СНCl2- CH3 → CH≡CH + 2HCl 1,1-дихлороетан
Застосування алкінів І. С2Н2 1. для автогенного різання і зварювання металів (при згорянні ацетилену в кисні утворюється температура 28000С); 2. для одержання різних орг.сполук (розчинників, бензену, оцтового альдегіду). 3. для одержання вибухових речовин (ацетиленіди важких металів)
|
||||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 354; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.139.119 (0.011 с.) |