Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 18. Гідроген і галогени та їх сполуки.Содержание книги
Поиск на нашем сайте
Гідроген та його сполуки.
Атоми Гідрогену найбільш розповсюджені у Всесвіті і входять до складу Сонця, зірок, а на Землі є тільки 1%. Атом Гідрогену у періодичній системі знаходиться у двох групах одночасно: І-А група (лужні метали) і VІІ-А група(галогени). На одному (першому) електронному шарі він містить 1 електрон, якщо він віддасть, то матиме С.О. +1 (як лужні метали), він може також і прийняти електрони і одержить С.О. -1 (як галогени). Атом Н у формулах речовин має такі С.О.: -1, 0, +1. (найбільш характерна С.О. +1, крім гідридів металів -1.) Атом Гідрогену (Н) утворює тільки одну просту речовину – Н2 – водень. За фізичними властивостями водень - це газ, найлегший із всіх відомих (Мr(H2) = 2), нерозчинний у воді(1: 0,019), але розчиняється у металі Платина (Pt) (1: 850). При високих тисках(тисячах атмосфер) водень проходить через металічну обшивку приладів як повітря через губку (вибухонебезпечний!), а також, коли вдихати водень, то голос змінюється.
Хімічні властивості водню
1. реакція горіння: 2Н02 + О2 = 2Н+12О Суміш 2V Н2 + 1V O2 - «гримучий газ» Н02 - відновник 2. реакція з неметалами: Н02 + Cl2 = 2Н+1Cl Н02 + S = Н2+1S 3Н02 + N2 = 2NН3+1 Н02 – відновник 3. реакція з деякими металами (лужними, лужно-земельними і алюмінієм): 2Na + H20 = 2NaН -1 Н02 – окисник NaH + H2O = NaOH + H2↑ CaH2 + H2O = Ca(OH)2 + 2H2↑
4. реакція з оксидами малоактивних металів: Fe2O3 + 3Н2 = 2Fe + 3H2O
5. реакція гідрування – це приєднання водню до атомів Карбону при подвійному чи потрійному зв’язку ворнанічних речовинах: СН2 = СН2 + Н2 → СН3− СН3 етен етан
Добування водню
1. У промисловості водень одержують: - при розкладі метану: 2СН4 → С2Н2 + 3Н2 або СН4 = С + 2Н2 - С + Н2О = Н2 + СО - при електролізі води: ел.струм Н2О → 2Н2 + О2 2. У лабораторії водень одержують при взаємодії металів, що стоять у ряду металів до Н з кислотами: Fe + 2HCl → FeCl2 + H2 ↑
Застосування водню 1. як екологічно чисте пальне; 2. синтез хлороводню і хлоридної кислоти; амоніаку, метанолу; 3. відновлення металів із руд; 4. одержання твердих жирів із олії (реакціях гідрування органічних речовин); 5. для наповнення стратостатів і метеорологічних шарів.
Галогени та їх сполуки
До галогенів відносяться елементи VII-А групи: F, Cl, Br, I, (At – це метал). Галогени – це родина найактивніших неметалів і серед них «король» всіх неметалів – F. Для галогенів найбільш характерні такі С.О.: -1, 0, +1, +4, +6, +7. (тільки F має: -1, 0) Галогени як найактивніші неметали будуть приймати електрони і виступаючи переважно як окисники, тому найбільш характерна С.О.: -1. Електронна формула атома Хлору: +1735,5Cl 1s22s22p63s23р5
Електронна формула аніону Хлору: Cl- Cl0 + 1e → Cl- 1s22s22p63s23р6 Атоми галогенів утворюють тільки одну просту речовину формулами: F2 , Cl2 , Br2 , I2 . За фізичними властивостями галогени: F2 - блідо-жовтого кольору газ; Cl2 - жовтувато-зеленого кольору газ; Br2 - темно-червоного кольору рідина; I2 - фіолетово-чорного кольору кристали. (явище сублімації – перехід з твердого стану до газоподібного, минаючи рідкий) Найбільше практичне значення серед галогенів має Хлор і його сполуки.
Хлор
За фізичними властивостями хлор – це газ з різким запахом, трохи розчинний у воді(1:2,5) – розчин хлору у воді називається «хлорною водою». Він важчий за повітря (Мr(Cl2) = 71), дуже отруйний. Хімічні властивості хлору 1. реакція з всіма металами, навіть благородними: 2Na + Cl20 = 2NaCl-1 «галогени» з грецької 2Au + 3Cl2 = 2AuCl3 «ті, що утворюють солі» Cl02 – окисник 2. реакція з неметалами (крім С,O2): Н2 + Cl20 = 2НCl-1 2Cl20 + 2P = 2PCl5-1 Cl20 - окисник 3. реакція з водою: А) на початку реакції (свіжо приготовлена «хлорна вода») Н2О + Cl20 = НCl-1 + НCl+1 O Н-ОН гіпохлоритна кислота HClO = HCl + O (атомарний Оксисен) Cl20 - і окисник, і відновник Б) в кінці реакції (при тривалому стоянні) 2Н2О + 2Cl20 = 4НCl-1 + O2↑ Cl20 – окисник
4. реакція з лугами: А) при звичайних умовах 2NaОH + Cl20 = NaCl-1 + NaCl+1O + H2O Na-OH натрій гіпохлорит Cl20 - і окисник, і відновник Б) при нагріванні 6NaОH + 3Cl20 = NaCl-1 + NaCl+5O3 +3H2O Cl20 - і окисник, і відновник натрій хлорат 5. реакція з солями, утвореними менш активними галогенами NaF + Cl20 ≠ 2NaBr + Cl20 = 2NaCl-1 + Br2 Cl20 - окисник,
Добування хлору 1. У промисловості хлор одержують електролізом розплаву або розчину кухонної солі: NaCl ↔ Na+ + Cl- (-) K: Na+ + 1e → Na0 (+) A: Cl- - 1e → Cl0; 2Cl0 → Cl2 Загальне рівняння: 2NaCl → 2Na + Cl2↑ 2. У лабораторії сполук Мангану і хлоридної кислоти: 2K Mn O4 + 16H Cl = 2 Mn Cl2 + 2KCl + 5 Cl2↑ + 8H2O Mn O2 + 4H Cl = Mn Cl2 + Cl2 + 2H2O
Застосування хлору 1. одержання хлороводню і хлоридної кислоти; 2. для відбілювання тканин і паперу; 3. для знезараження питної води як дезінфектант; 4. добування синтетичного каучуку, волокон, пластмас.
Гідрогенові сполуки Хлору
Атом Хлору утворює дві такі сполуки: ( явище неорганічної ізомерії) HCl – хлороводень, гідроген хлорид HCl – хлоридна кислота, соляна кислота.
Хлороводень
Хлороводень – газ з різким звапахом, добре розчинний (1:500), розчин хлороводню у воді називається хлоридна кислота, отруйний. Для хлороводню характерна тільки реакція з лугами і амоніаком: Na OH + H Cl = Na Cl + H2O (спільна властивість з HCl-кислотою) N H3 + H Cl = NH4Cl Хлоридна кислота HCl – сильна кислота. Хімічні властивості хлоридної кислоти І. Загальні властивості як кислоти: 1. реакція дисоціація: HCl ↔ Н+ + Cl- 2. реакція з металами до Н: Zn + 2H Cl = Zn Cl2 + H2↑ З. реакція з оксидами металів: Fe O + 2H Cl = Fe Cl2 + H2O 4. реакція з основами (реакція нейтралізації): Na OH + H Cl = Na Cl + H2O 5. реакція з солями, утвореними слабкими кислотами: Na2 С O3 + 2H Cl = 2 Na Cl + H2O + СО2↑(Н2СО3) ІІ. Якісна реакція: 1. якісною реакцією на хлоридну кислоту і її солі є AgNO3, при цьому утворюється білий сирнистий осад AgCl: Ag N O3 + H Cl = Ag Cl↓ + HNO3 Добування HCl 1. У промисловості одержують реакцією: H2 + Cl2 = 2 Н Cl ↑ 2. У лабораторії реакцією кристалічної кухонної солі з концентрованою сульфатною кислотою: 2 Na Cl(кр.) + H2SO4 = Na2SO4 + 2HCl↑
Застосування хлоридної кислоти 1. для одержання солей; 2. для очищення поверхні металів від іржі; 3. 0,5%-розчин використовують при пониженні кислотності в шлунку; 4. добування пластмас. Оксиди Хлору
Атом Хлору утворює такі оксиди: 1. Cl2+1O - кислотний оксид 2. Cl+4O2 - подвійний оксид 3. Cl+6O3 - подвійний оксид 4. Cl2+7O7 - кислотний оксид. Ці о ксиди утворюють такі кислоти: Cl2+1O → НCl+1O – гіпохлоритна кислота → НСl+3O2 - хлоритна кислота Cl+4O2 → → НСl+5O3 - хлоратна кислота → НСl+5O3 - хлоратна кислота Cl+6O3→ → НСl+7O4 - перхлоратна кислота Cl2+7O7 → НСl+7O4 - перхлоратна кислота
Природні сполуки галогенів 1. NaCl – кухонна сіль, галіт; 2. NaCl∙KCl – сильвініт; 3. KCl - сильвін; 4. KClO3 - бертолетова сіль; 5. СаСl(ClO) або CaOCl2 – хлорне вапно.
Тема 19. Оксиген і Сульфур та їх сполуки. Оксиген та його сполуки. Оксиген – найпоширеніший хімічний елемент у земній корі – 49%. Оксиген знаходиться у VI-А групі і має такі С.О.: -2, 0, +2 (О+2F2-1). Атом Оксигену на відміну від галогенів утворює кілька простих речовин і це явище називається алотропією, а ці прості речовини називають алотропними видозмінами. → O2 - кисень O → → O3 - озон
Кисень Фізичні властивості кисню Кисень - це газ, без запаху і смаку, малорозчинний у воді (1: 0,03), підтримує дихання живих організмів і горіння речовин (у повітрі кисню – 21%, азоту – 78% і 1% - інертні гази). Рідкий кисень(-183оС) та інші гази у рідкому стані зберігають у посудині Дюара(термос).
Хімічні властивості кисню 1. Кисень взаємодіє з простими і складними речовинами і внаслідок реакції утворюються оксиди цих елементів і ця реакція називається Окиснення. C + O2 = CO2; 4Р + 5О2 = 2Р2О5 CH4 + 2O2 = CO2 + 2H2O Для всіх складних речовин реакція окиснення поділяється: А) повне окиснення (кожний із елементів окислюється до відповідних оксидів): 4NH3 + 5O2 = 4NO + 6H2O CH4 + 2O2 = CO2 + 2H2O Б) неповне окиснення (один із елементів не окислюється до оксиду, а утворюється проста речовина): 4NH3 + 3O2 = 2N2 + 6H2O CH4 + O2 = C + 2H2O
Якісна реакція на кисень – тліюча дерев´яна скіпка в атмосфері кисню яскраво спалахує. Виняток: 2С + O2 = 2CO; 4Р + 3О2 = 2Р2О3 2CH4 + 3O2 = 2CO + 4H2O
Добування кисню 1. У промисловості кисень одержують: - із повітря, його розділенням на складники. - Електроліз води 2H2O = 2H 2↑ + + O2 ↑.
2. У лабораторії кисень одержують при розкладі деяких речовин: - 2KMnO4 = MnO2 + K2MnO4 + O2 ↑ Калій перманганат (марганцівка) - 2K Cl O3 = 2KCl + 3 O2 ↑. Калій хлорат (бертолетова сіль) - 2H2O2 = 2H 2O + + O2 ↑. Гідроген пероксид (перекис водню, пергідроль) - 2KNO3 = 2KNO2 + O2↑ Калійна селітра (всі нітрати металів) Застосування кисню 1. В медицині (кисневі подушки); 2. для різання і зварювання металів; 3. в авіації для дихання; 4. в металургії для покращення виробництва; 5. як вибухівка (рідкий кисень) Озон використовується як сильний окисник і для очищення питної води (дезінфектант, подібно як хлор), а також для очищення стічних промислових вод. За фізичними властивостями озон – це газ голубого кольору, краще за кисень розчинний у воді(1:0,5), дуже отруйний. Одержують озон із кисню при високих температурах(електричний розряд чи блискавка у природі чи космічна радіація): 3O2 = 2O3 (у лабораторії в озонаторах) При звичайних умовах озон розкладається: O3 = O2 + О (атомарний Оксиген)- сильний окисник В кінцевому результаті утворюється кисень: 2O3 = 3O2
Сульфур і його сполуки.
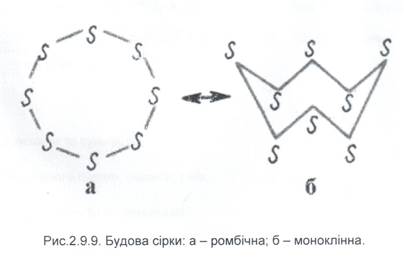
Атом Сульфуру знаходиться у VI-А групі і входить до родини –«халькогени» з грецької «ті, що утворюють руди» (O, S, Se, Te). Для Сульфуру характерні такі С.О.: -2, 0, +4, +6. Для нього як і для Окисгену характерна алотропія. → S8 - кристалічна сірка (моноклінна і ромбічна) S → → Sn - пластична
У хімічних реакціях кристалічна і пластична сірка позначається - S.
Сірка
За фізичними властивостями Сірка – жовта кристалічна речовина, (ρ(S)=2,08 г/мл), нерозчинна у воді, температура плавлення більше 1000С, у порошкоподібному стані не змочується водою і плаває по воді(явище флотації).
Хімічні властивості сірки 1. реакція з металами (крім благородних: Pt, Au): Fe + S0 = FeS-2 2Na + S0 = Na2S-2 2. реакція з неметалами: S0 + O2 = S+4O2 (горіння сірки) S0 + H2 = H2S-2 3. реакція з лугами: 3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
Добування сірки Одержують сірку тільки у промисловості з родовищ.
Застосування сірки 1. Виробництва сульфатної кислоти; 2. одержання гуми; 3. у медицині для виготовлення мазей; 4. у виробництві сірників; 5. у боротьбі з шкідниками та хворобами рослин. 6. Для демеркуризації приміщень(забирає ртуть)
|
||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 798; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.172.250 (0.009 с.) |