Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
ІІ. За зміною ступеня окиснення елементів.Содержание книги
Поиск на нашем сайте
1. Реакція окисно-відновна – це реакція, яка відбувається із зміною ступенів окиснення одних і тих самих елементів у вихідних речовинах і продуктах реакцій 4Р0 + 5О20 = 2Р2+5О5-2 Р0 - 5е = Р+5 4 - реакція окиснення О20 + 4е = 2О-2 5 – реакція відновлення Р0 - відновник; О20 - окисник. 2. Реакція йонного обміну - це реакція між йонами в розчинах електролітів, яка відбувається в напрямку зв’язування йонів з утворенням: А) осаду; Б) газу; В) малодисоційовану речовину (Н2О). NaOH + HCl = NaCl + H2O Na+ + OH- + H+ + Cl- = Na+ + Cl- + H2O H+ + OH- = H2O
ІІІ. За використанням каталізатора. 1. Реакція каталітична – це реакція, яка відбувається тільки в присутності каталізатора.
Fe V2O5 MnO2 N2 + 3H2 ↔ 2NH3 2SO2 + O2 ↔ 2SO3 2H2O2 === 2H2O + O2 Pt H2O 4NH3 + 5O2 ==== 4NO + 6H2O 2Al + 3I2 === 2AlI3
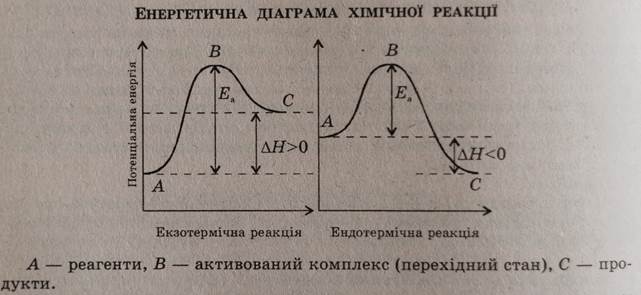
2. Реакція некаталітична – це реакція, яка відбувається без каталізатора С + O2 = CO2 IV. За тепловим ефектом реакції: Тепловий ефект реакції – це кількість виділеної або поглинутої теплоти (різниця між енергіями продуктів реакції і енергіями вихідних речовин).
Він завжди записується у правій частині хімічного рівняння із знаком «+» чи «-«і вимірюється у кДж, а також у кДж/моль(при цьому необхідно враховувати коефіцієнт перед формулою у рівннянні реакції). Наприклад:Тепловий ефект реакції горіння фосфору становить: 3200 кДж чи 800кДж/моль 4Р + 5О2 = 2Р2О5 + 3200кДж або ∆Н= -3200кДж 4 Р + 5О2 = 2Р2О5 + 4 ∙ 800кДж/моль або ∆Н= -3200кДж 1. Реакція екзотермічна – це реакція, що відбувається з виділенням тепла. C + O2 = CO2 + 240 кДж; або С + О2 = СО2; ∆Н= -240кДж 2. Реакція ендотермічна - це реакція, що відбувається з поглинанням тепла. СаСО3 = СаО + СО2 – 180кДж; або СаСО3 = СаО + СО2; ∆Н= +180кДж V. За оборотністю реакції: 1. Реакція оборотна – це реакція, яка відбувається у двох взаємно протилежних напрямках одночасно. пряма 2SO2 + O2 ↔ 2SO3 зворотна Оборотна реакція поділяється на: 1. пряма 2. зворотна. 2. Реакція необоротна – це реакція, яка відбувається тільки в одному напрямку зліва направо. С + О2 = СО2; або С + О2 → СО2 або С + О2 → СО2 VI. За агрегатним станом вихідних речовин: 1. Реакція гомогенна – це реакція, в якій вихідні речовини є в однакових агрегатних станах. Fe(тв.) + S(тв.) = FeS; 2Н2(г.) + О2(г.) = 2Н2О. 2. Реакція гетерогенна – це реакція, в якій вихідні речовини є в різних агрегатних станах. С(тв.) + О2(г.) = СО2; 2Na(тв.) + 2Н2О(рід.) = 2NaOH + H2↑
Виняток: Тільки в каталітичній реакції, якщо вихідні речовини є в однакових агрегатних станах, а каталізатор в іншому, то це тільки гетерогенна реакція. Fe(тв.) N2(г.) + 3Н2(г.) ↔ 2NH3
Швидкість хімічних реакцій Швидкість хімічних реакцій – це відношення зміни концентрації однієї з вихідних речовин до зміни часу. ∆С Формула: ύ(х.р.) = -----; Одиниці: моль/л·с ∆t ν де: ∆С = Споч. - Скінц., а Сm – молярна концентрація; Сm = -------; моль/л (тільки для газів і розчинів) V(р-ну) ∆ t = tкінц. – tпоч. Фактори, що впливають на швидкість хімічної реакції: 1. від природи реагуючих речовин (чим активніша речовина, тим швидкість реакції є більшою). 2. від подрібненості (тільки для твердих речовин) (чим більш подрібнена речовина тим швидкість гетерогенної реакції є більшою). 3. від каталізатора (каталізатори – це речовини, які прискорюють швидкість хімічної реакції, але при цьому не витрачаються; інгібітори – це речовини, які сповільнюють швидкість хімічної реакції). 4. від концентрації (тільки для газів та розчинів). Від концентрації швидкість хімічної реакції залежить за законом діючих мас: « Швидкість хімічної реакції прямо пропорційна добутку концентрацій вихідних речовин у степенях коефіцієнтів» N2(г.) + 3Н2(г.) ↔ 2NH3 · ύ(х.р.) = k·С(N2) C3(H2), де k – константа хім.реакції, постійна величина для даної реакції. С(тв.) + О2(г.) = СО2; · ύ(х.р.) = k·С(О2) 5. від температури. Від температури швидкість хім..реакції залежить за правилом Вант-Гоффа: «При збільшенні температури на кожні 100 швидкість хім..реакції зростає в 2-4 рази». t(кінц.) – t(поч.) ύ(кінцева) ------------------------- ----------- == γ 10 ύ(початкова)
де: γ – температурний коефіцієнт, що дорівнює 2-4. Задача. Як зміниться швидкість хім..реакції при збільшенні температури від 600 до 900, якщо температурний коефіцієнт дорівнює 2.
t(кінц.) – t(поч.) ύ(кінцева) ------------------------- ύ(кінцева) 90-60 ----------- == γ 10 ----------------- == 2 10 = 23 = 8. ύ(початкова) ύ(початкова)
Хімічна рівновага
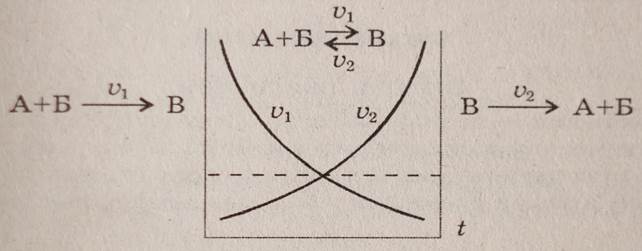
Хімічна рівновага характерна тільки для оборотніх реакцій. Хімічна рівновага – це стан оборотної реакції, коли швидкість прямої реакції дорівнює швидкості зворотної реакції.
Хім..рівновага для практичної діяльності людини є не вигідною тому, що утворюються і продукти реакції і вихідні речовини. Хім..рівновагу необхідно змістити або в бік прямої реакції, або в бік зворотної реакції. ЇЇ можна змістити користуючись принципом Ле Шательє. Фактори, що впливають на зміщення хім..рівноваги: І. від концентрації. При збільшенні концентрації вихідних речовин хім..рівновага зміщується в бік прямої реакції, а при підвищенні концентрації продуктів реакції – в бік зворотної реакції і навпаки. Наприклад: 2SO2 + O2 ↔ 2SO3 С(SO2) або C(O2) > то хім..рівновага зміщується в бік прямої реакції С(SO3) > то хім..рівновага зміщується в бік зворотньої реакції і навпаки. ІІ. Від температури. При підвищенні температури хім..рівноваги зміщується в бік ендотермічної реакції, а при пониженні температури – в бік екзотермічної реакції. Наприклад: N2(г.) + 3Н2(г.) ↔ 2NH3 + QкДж Температуру >, то хім.рівновага зміщується в бік зворотньої реакції. Температуру <, то хім..рівновага зміщується в бік прямої реакції. ІІІ. Від тиску (тільки для газів). При підвищенні тиску хім..рівновага зміщується в бік зменшення об’ємів газоподібних продуктів і навпаки. N2(г) + 3H2(г) ↔ 2NH3(г) 1 моль N2 + 3моль H2 ↔ 2 моль NH3 , 1 V N2 + 3 V H2 ↔ 2 V NH3 4V ↔ 2V Тиск >, то хім.рівновага зміщується в бік прямої реакції. Тиск <, то хім.рівновага зміщується в бік зворотньої реакції. Виняток: N2(г) + О2(г) ↔ 2NО(г) 1 V N2 + 1 V О2 ↔ 2 V NО 2V ↔ 2V Якщо об’єми вихідних речовин і продуктів реакції є однаковими, то тиск невпливає на зміщення хім..рівноваги.
|
||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 310; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.44.207 (0.006 с.) |