Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 24. Ароматичні вуглеводні (арени)Содержание книги
Поиск на нашем сайте
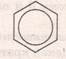
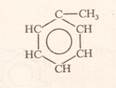
Ароматичні вуглеводні – це вуглеводні в молекулах яких є цикл, який складається із 6(шести) атомів Карбону (бензенове ядро) Найпростішим представником аренів є бензен, його формула – С6Н6. Вперше структурну формулу запропонував Кекуле
Формула Кекуле
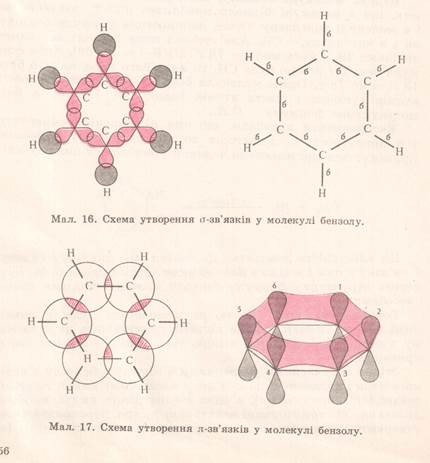
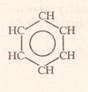
Із формули видно, що кожен із 6 атомів Карбону перебуває в sp2-гібридизації.
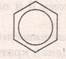
Кожен із 6 атомів С містить по одному не гібридизованому р-електрону, які розміщуються перпендикулярно до площини гібридизованих. Всі вони перекриваються над і під площиною шестикутника(бензенового ядра) і утворюють єдиний π-зв’язок, який складається із 6 електронів,що називається спряженням (вирівнювання). Доказом цього є те, що віддаль між атомами Карбону в бензеновому ядрі є одинакова і становить 0,140 нм. Сучасна формула бензену,яка відповідає його будові: або
Номенклатура аренів
За міжнародною номенклатурою назви аренів походять від відповідних назв радикалів (замісників) з додаванням слова – бензен. С6Н6 бензен
С6Н5-СН3 метилбензен (толуен)
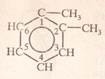
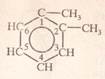
С6Н4(СН3)2 1,2-диметил бензен (ксилен)
Якщо в аренах є тільки два одинакові радикали (замісники), то до їхніх назв додається префікс: орто, пара, мета. 1. Орто - це коли один радикал знаходиться біля 1 атома С у бензеновому ядрі, а другий – біля 2 або 6 атома С;
2.Мета - це коли один радикал(замісник) знаходиться біля 1 атома С у бензеновому ядрі, а другий – біля 3 або 5 атома С;
3. Пара - це коли один радикал знаходиться біля 1 атома С у бензеновому ядрі, а другий – біля 4 атома С;
1.2-диметилбензен орто-диметилбензен о.ксилен
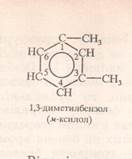
1,3-диметилбензен мета-диметилбензен м.ксилен
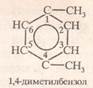
1,4-диметилбензен пара-диметилбензен п.ксилен
Фізичні властивості бензену Бензен - це рідина, нерозчинна у воді, отруйна.
Хімічні властивості бензену Для бензену характерними будуть реакції як типу заміщення атомів Н у бензеновому ядрі, так і типу приєднання із розривом π-зв’язку. Легше будуть відбуватися реакції типу заміщення. І. Реакції заміщення 1. реакція галогенування (каталізатор сіль – FeCl3) Реакція відбувається подібно як в алканах, тільки каталізатор інший. FeCl3 C6H6 + Cl2 → C6H5Cl + HCl
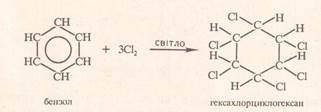
Хлоробензен C6H6 + 6Cl2 → C6Cl6 + 6HCl гексахлоробензен (Бензен не знебарвлює«бромну воду» подібно як алкани) 2. реакція нітрування ( подібно як алкани) Це якісна реакція на бензен при цьому утворюється нітробензен жовтого кольору із запахом «гіркого мигдалю» k. H2SO4 С6Н6 + HO-NO2 → C6H5NO2 + H2O нітробензен ІІ. Реакції приєднання 1. реакція гідрування ( подібно як алкенів ) С6Н6 + 3Н2 → С6Н12 циклогексан 2. реакція галогенування ( каталізатором є світло )
C6H6 + 3Cl2 → C6H6Cl6 Гексахлорциклогексан (гексахлоран)
(Бензен не знебарвлює «бромну воду»)
ІІІ. реакція окиснення 1. реакція горіння (повне і неповне): Внаслідок реакції повного горіння вуглеводнів утворюється завжди СО2 і Н2О. 2C6H6 + 15О2 → 12CО2 + 6H2О 2C6H6 + 9О2 → 12CО + 6H2О 2C6H6 + 3О2 → 12C + 6H2О 2. реакція окиснення розчином KMnO4 Бензен не окислюються розчином KMnO4 і не знебарвлює його.
Гомологи бензену
Загальна формула аренів: СnH2n-6 де: n = 6,7,8 і т.д.
Радикали аренів
Назви аренів Назви радикалів аренів
С6Н6 - бензен С6Н5 - феніл С6Н5-СН3 - толуен С6Н5-СН2- бензил Толуен С6Н5-СН3 - толуен, метилбензен, фенілметан У молекулі толуені відбувається взаємний вплив груп атомів (С6Н5- феніл і СН3- метил) одна на одну і цей вплив відбивається на хімічних властивостей. Группа СН3 так впливає на С6Н5, що атоми Н в положеннях 2,4,6 (орто і пара) бензенового ядра стають більш рухливим і можуть заміщуватися на інші атоми або групи атомів. Група С6Н5 так впливає на СН3 (феніл має властивість відтягувати пари електронів), що атоми Н в ній стають більш рухливим і можуть окиснюватися.
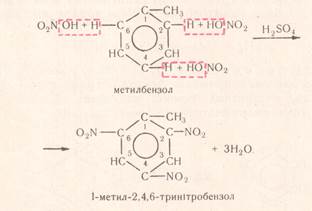
Хімічні властивості толуену І. Реакції заміщення( по групі С6Н5) 1. реакція галогенування (з «хлорною» чи «бромною водою») При цьому утворюється білий осад. С6Н5-СН3 + 3Cl2 → С6Н2(Cl3) -СН3 ↓ + 3HCl 2,4,6-трихлоротолуен (толуен знебарвлює«бромну воду») 2. реакція нітрування
k. H2SO4 С6Н5-СН3 + 3HO-NO2 → C6H2(NO2)3СН3 + 3H2O 2,4,6-тринітротолуен (тротил)
ІІ. Реакції приєднання ( по групі С6Н5) 1. реакція гідрування ( подібно як алкенів )(важче ніж для бензену із-за порушення рівномірності розміщення π- зв′язку у бензеновому ядрі) С6Н5-СН3 + 3Н2 → С6Н11-СН3 метилциклогексан
ІІІ. Реакції окиснення.
1. реакція горіння: Внаслідок реакції повного горіння вуглеводнів утворюється завжди СО2 і Н2О. C7H8 + 9О2 → 7CО2 + 4H2О 2. реакція окиснення розчином KMnO4 (по групі СН3, а вплив групи С6Н5) Толуен на відміну від бензену окислюються розчином KMnO4 і знебарвлює його.
С6Н5-СН3 + 3[O] → C6H5СООН + H2O Бензойна кислота
Добування аренів І. С6Н6 1. У промисловості бензен одержують реакцією тримеризації ацетилену: 3 С2Н2 → С6Н6 (каталізатор – вугілля і температура) етин бензен або дегідруванням циклогексану або гексану С6Н12 → С6Н6 + 3Н2 циклогексан С6Н14 → С6Н6 + 4Н2 гексан ІІ. С6Н5-СН3
1. У промисловості толуен одержують за схемою: С6Н6 → С6Н5Сl → С6Н5-СН3 1. С6Н6 + Cl2 → С6Н5Сl + HCl 2. С6Н5Сl + CH3Cl + 2Na → С6Н5-СН3 + 2NaCl
|
||||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 865; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.19.120.100 (0.01 с.) |