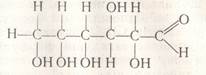Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Назви жирів походять від назв карбонових кислотСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
CH2OOC- С15Н31 │ СН ОOC- С15Н31 трипальмітин (твердий) │ тригліцерид пальмітинової кислоти СН2 ОOC- С15Н31 (трипальмітиноат)
CH2OOC- С17Н35 │ СН ОOC- С17Н35 тристеарин ( твердий) │ тригліцерид стеаринової кислоти СН2 ОOC- С17Н35 (тристеариноат)
CH2OOC- С17Н33 │ СН ОOC- С17Н33 триолеїн ( рідкий – олія) │ тригліцерид олеїнової кислоти СН2 ОOC- С17Н33 (триолеїноат)
За фізичними властивостями жири бувають: І. за походженням: - тваринні (переважно тверді, крім риб’ячого жиру - рідкий); - рослинні(рідкі, крім кокосове і какао масла - тверді). ІІ. За агрегатним станом: - тверді; - рідкі (олії) До складу твердих жирів входять залишки вищих насичених! карбонових кислот. До складу рідких жирів (олій) входять залишки вищих ненасичених! карбонових кислот. Хімічні властивості жирів
Реакція гідролізу А) водний гідроліз (подібно як естерів). Внаслідок реакції утворюється гліцерин і вищі карбонові кислоти. CH2OOC- С17Н35 СН2 ОН │ │ СН ОOC- С17Н35 + 3Н-ОН ↔ СН ОН + 3 С17Н35СООН │ │ СН2 ОOC- С17Н35 СН2 ОН Б) лужний гідроліз або омилення (подібно як естерів) Внаслідок реакції утворюється гліцерин і сіль вищої карбонової кислоти – мило. CH2OOC- С17Н35 СН2 ОН │ │ СН ОOC- С17Н35 + 3Na-ОН → СН ОН + 3 С17Н35СООNa │ │ тверде мило СН2 ОOC- С17Н35 СН2 ОН 2. реакція гідрування(гідрогенізації) тільки для рідких жирів – олій:
CH2OOC- С17Н33 СН2 ООС- С17Н35 │ │ СН ОOC- С17Н33 + 3Н2 → СН ООС-С17Н35 │ │ СН2 ОOC- С17Н33 СН2 ООС- С17Н35- олія твердий жир (маргарин)
Реакція горіння жирів
Жир + 165О2 → 116СО2 + 110Н2О 2С58Н110О6 (тристеарин)
Застосування жирів 1. як харчовий продукт; 2. для одержання мила і гліцерину і маргарину або рослинного жиру; 3. для одержання оліф з нехарчових олій(бавовняна). Тема 28. Вуглеводи.
Вуглеводи – це орг.сполуки, яким відповідає загальна формула – Сn(H2O)m Глюкоза - С6Н12О6 - С6 (Н2О)6 n ≥ m Сахароза - С12Н22О11 - С12 (Н2О)11 Крохмаль - (С6Н10О5)n - С6 (Н2О)5 Назва вуглеводи не цілком підходить до тих функцій, які виконують ці речовини в організмах рослин і тварин. Деякі речовини, які не є вуглеводами, можна записати загальною формулою вуглеводів, наприклад: Формальдегід - Н-С(О)Н - С (Н2О)
Оцтова кислота - СН3СООН - С2 (Н2О)2 Молочна кислота - С3Н6О3 - С3 (Н2О)3 Вуглеводи ще називають сахаридами(цукриди). Вуглеводи поділяються на: 1. моносахариди (глюкоза, фруктоза, рибоза, дезоксирибоза); прості 2. дисахариди (сахароза, мальтоза, лактоза); складні 3. полісахариди (крохмаль, целюлоза). складні
Глюкоза Формула глюкози - С6Н12О6. Доказано, що до складу глюкози входять 5 груп ОН і одна альдегідна група (п′ятиатомний спиртоальдегід):
або
У водному розчині глюкоза може перебувати у вигляді: однієї лінійної альдегідної форми і двох циклічних форм – α і β глюкози. (відмінність)
У лінійній і двох циклічних формах є по 5 груп ОН ( подібність ). За фізичними властивостями глюкоза – це біла кристалічна речовина, солодка на смак, добре розчинна у воді. У крові людини близько 0,1% глюкози. Хімічні властивості глюкози І. Ракції як багатоатомного спирту по групах ОН: Реакція з купрум(ІІ) гідроксидом
ОН │ СН2- СН- СН- СН- СН- С(О)Н + 2Cu(OH)2 → │ │ │ │ ОН ОН ОН ОН
ОН │ СН2- СН- СН- СН- СН- С(О)Н + 4H2O │ │ │ │ О О О О Cu Cu купрум (ІІ) глюконат (синій прозорий розчин) 3. реакція естерифікації: ОН │ СН2- СН- СН- СН- СН- С(О)Н + 5 СН3СООН → │ │ │ │ ОН ОН ОН ОН ООС-СН3 │ СН2 ─ СН ─ СН - СН ─ СН- С(О)Н + 4H2О │ │ │ │ ООС-СН3 ООС-СН3 ООС-СН3 ООС-СН3 Пентаацетилглюкоза, пентаацетатглюкози ІІ. реакції як альдегіду ( по групі С(О)Н): 1. реакція «срібного дзеркала» СН2- (СН-)4- С(О)Н + Ag2О → СН2- (СН-)4- СООН + 2Ag↓ │ │ │ │ ОН ОН ОН ОН глюконова ки слота
2.реакція «мідного дзеркала»:
СН2- (СН-)4- С(О)Н + 2Cu(OH)2 → СН2- (СН-)4- СООН + Сu2O + 2H2O │ │ │ │ │ ОН ОН ОН ОН ОН
3. реакція з воднем (гідрування по С=О групі) – відновлення: СН2- (СН-)4- С(О)Н + Н2 → СН2- (СН-)4- СН2 (сорбіт) │ │ │ │ │ ОН ОН ОН ОН OH
ІІІ.реакція горіння (повне окиснення в організмі і виділяється тепло для біохімічних процесів): С6Н12О6 + 6О2 → 6СО2 + 6Н2О + ǪкДж = 17,6 кДж ІІІ. реакція як моносахариди (тільки для глюкози) 1. реакції бродіння А) спиртове бродіння С6Н12О6 → 2С2Н5ОН + 2СО2↑
Б) молочно-кисле бродіння:
С6Н12О6 → 2СН3-СН-СООН молочна кислота.
│ ОН Добування глюкози 1. реакція гідролізу крохмалю або целюлози: (С6Н10О5)n + nH-OH → n С6Н12О6 2. реакція фотосинтезу: 6СО2 + 6Н2О → С6Н12О6 + 6О2↑ 3. реакція гексамеризації формальдегіду в присутності Са(ОН)2 –реакція Бутлерова: 6НС(О)Н → С6Н12О6 Застосування глюкози 1. як харчовий продукт; 2. в медицині як зміцнювальний лікувальний засіб; 3. в кондитерській справі (виготовлення мармеладу, карамелі, пряників); 4. процеси бродіння використовуються для одержання етилового спирту(спиртове бродіння), при квашенні капусти, огірків, молока (молочнокисле бродіння). 5. одержують лікарські препарати (аскорбінову кислоту, кальцій глюконат) Глюкозу ще називають «виноградним цукром»(багато її у винограді), у спілих фруктах та ягодах, а у крові людини знаходиться 0,1%.
Дисахариди(дицукриди) Сахароза(буряковий або тростинний цукор, цукроза) Формула сахарози(цукроза) -С12Н22О11 – і складається із одного залишку глюкози і одного залишку фруктози (тільки у циклічних формах!). С6Н12О6 Сахароза входить до складу: + С6Н12О6 - соку цукрових буряків – 16 -20% - Н2О - соку цукрової тростини – 14 -26% С12Н22О11
|
||||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 748; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.226.195 (0.011 с.) |