
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 27. Альдегіди, карбонові кислоти, естери.Содержание книги
Поиск на нашем сайте
Альдегіди, карбонові кислоти, естери (жири) всі містять функціональну (характеристичну) групу – карбонільну - ─С=О │ Альдегіди Альдегіди – це органічні сполуки, що містять функціональну (характеристичну) – альдегідну групу, зв’язану з вуглеводневим радикалом(може бути і атом Н).
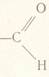
Група –СНО або - С(О)Н або - альдегідна група
Загальна формула альдегідів: СnH2n+1 С(О)Н де: n = 0,1,2,3,4 і т.д. або R-СHО або R-С(O)H, де R – Н, СН3, С2Н5, С3Н7 і т.д. aбо CnH2nO де: n = 1,2,3,4 і т.д.
Номенклатура альдегідів За міжнародною(систематичною або номенклатурою ІЮПАК) назви альдегідів походять від відповідних назв алканів, включаючи атом Карбону альдегідної групи, із додаванням закінчення аль. (Особливість альдегідної групи у порівняння з гідрокси-групою) За історичною номенклатурою назви альдегідів походять від відповідних назв карбонових кислот НС(О)Н - метаналь, мурашиний альдегід, формальдегід СН3 С(О)Н - етаналь, оцтовий альдегід, ацетальдегід С2Н5 С(О)Н - пропаналь, пропіоновий альдегід С3Н7 С(О)Н - бутаналь, масляний альдегід С4Н9 С(О)Н - пентаналь, валеріановий альдегід С5Н11 С(О)Н - гексаналь, капроновий альдегід
СН3 5 4 3 2| 1О СН3─СН─СН2─С ─С ||Н СН3 СН3 2,2,4-триметилпентаналь
Цифри, які стоять у назвах альдегідів перед замісниками називаються локантами.
Фізичні властивості альдегідів Перший представник альдегідів (формальдегід) є газом тому, що на відміну від спиртів між молекулами не існує водневого зв’язку. Всі інші альдегіди є рідинами, добре розчинні у воді, мають різкий запах.
Хімічні властивості альдегідів Всі хімічні властивості альдегідів відбуваються по характеристичній (функціональній) групі - -С(О)Н. І. Реакції приєднання по С=О (подібно як алкени С=С) 1. реакція гідрування СН3 С(О)Н + Н2 → СН3 СН2ОН Реакція гідрогалогенування СН3 С(О)Н + НCl → СН3 СНOH 1-хлороетан-1-ол | Cl ІІ. Реакції по атомі Н альдегідної групи Реакція «срібного дзеркала» Це взаємодія альдегідів з Ag2O (аміачний розчин) – реактив Толленса і при цьому окислюється С-Н зв’язок і утворюється карбонова кислота і срібло – це якісна реакція на альдегіди НС(О)Н + Ag2O → HCOOH + 2Ag↓ сріблястий наліт
2. реакція «мідного дзеркала» Це взаємодія альдегідів з голубим осадом Cu(OH)2 при нагріванні і при цьому відбувається зміна кольорів: голубий→жовтий → червоний, утворюється карбонова кислота – якісна реакція на альдегіди СН3 С(О)Н + Cu(OH)2 → СН3 СОOH + Cu+1OH + H2O голубий жовтий 2CuOH → Cu2O + H2O Червоний Загальне рівняння: СН3 С(О)Н + 2Cu(OH)2 → СН3 СОOH + Cu2O + 2H2O голубий червоний
IІІ. реакція окиснення 1. реакція горіння: Внаслідок реакції повного горіння альдегідів утворюється завжди СО2 і Н2О. 2С2Н4 О + 5О2 → 4CО2 + 4H2О
2. реакція окиснення розчином KMnO4 Альдегіди окислюються розчином KMnO4, знебарвлюючи його, і при цьому утворюються карбонові кислоти
О Н С(О)Н + [О] → Н- С + Н2О ОН Метанова кислота, мурашина кислота О СН3 С(О)Н + [О] → СН3 - С + Н2О ОН Етанова кислота, оцтова кислота
Добування альдегідів І. СН3 С(О)Н У промисловості одержують: - реакцією Кучерова:
С2Н2 + Н-ОН → СН3 С(О)Н ІІ. Загальні методи добування -реакція окиснення спиртів(переважно СuО): C3H7 ОН + [О] → C2H5- С(O)H Назва «Альдегід» означає «ал коголь дегід рогенізований». 1. Реакція лужного гідролізу дигалогеналканів (два галогени повинні знаходитись біля одного атома Карбону) в присутності водного! розчину лугу Водн.р-н лугу СН3 -CHCl2 + 2NaOH → CH3 С(О)Н + 2NaCl + Н2О
Застосування альдегідів І. НС(О)Н 1. для одержання формаліну (в медицині і шкіряній промисловості); 2. для одержання пластмас (фенолформальдегідна смола); 3. для протруювання і дезінфекції насіння ІІ. СН3 С(О)Н 1. для одержання оцтової кислоти. Карбонові кислоти
Карбонові кислоти – це орг.сполуки, що містять характеристичну (функціональну) групу – карбоксильну- зв’язану з вуглеводневим радикалом або атомом Н. Група - СООН або - Загальна формула карбонових кислот: СnH2n+1 СООН де: n = 0,1,2,3,4 і т.д. або R-СOОH, де R – Н, СН3, С2Н5, і т.д. aбо CnH2nO2 де: n = 1,2,3,4 і т.д. Карбонові кислоти поділяються за: І. вуглеводневим радикалом: - насичені; - ненасичені; - ароматичні ІІ. за кількістю груп СООН: - одноосновні - багатоосновні Відмінність між формулою орг.кислоти і неорг.кислоти полягає в тому, що в органічних кислотах кислотний залишок знаходиться першим,а другим атом Н. Наприклад: 1 2 [H] [NO3] Кислотний залишок 2 1 [СН3СОО] [Н] Кислотний залишок
|
||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 421; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.134.161 (0.009 с.) |


 - карбоксильна група. Її назва складається з назв двох груп: карбо нільна (С=О) і гідро ксильна (ОН).
- карбоксильна група. Її назва складається з назв двох груп: карбо нільна (С=О) і гідро ксильна (ОН).


