
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Галогенування насичених карбонових кислот та їх похiдних.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
ГЕТЕРОФУНКЦІОНАЛЬНІ СПОЛУКИ У попередніх розділах ми розглядали сполуки, які містять у молекулах одну або декілька однакових функціональних груп. Разом з тим існує величезна кількість сполук, що містять одночасно двi або бiльше рiзних за своєю природою функцiональних груп. Такі сполуки неможливо віднести до якогось певного класу і тому їх виділяють в особливий клас гетерофункціональних сполук або сполук зі змішаними функціями. До них вiдносять галогенозамiщенi кислоти, гiдроксикислоти, амiнокислоти, альдегiдо- i кетокислоти, гiдроксиальдегiди, гiдроксикетони та iншi.
ГАЛОГЕНОЗАМIЩЕНI КИСЛОТИ
Галогенозамiщенi кислоти, це карбонові кислоти, якi в алкільному залишку мiстять один або декілька атомів галогену.
Моногалогенозамiщена Полiгалогенозамiщена (хлороцтова кислота) (трихлороцтова кислота)
IЗОМЕРIЯ, НОМЕНКЛАТУРА
За систематичною (IUPАC) номенклатурою, назви галогенозаміщених кислот утворюють вiд назви вiдповiдної карбонової кислоти, додаючи префікс фторо-, хлоро-, бромо-, йодо-, а положення атома галогену вказується цифрою (локантом) (див.стор.). Нумерацiя головного ланцюга починається з атома вуглецю карбоксильної групи.
Якщо користуються тривіальними назвами кислот, то положення галогену вiдносно карбоксильної групи вказують буквами грецького алфавiту (a,b,g).
Iзомерiя галогенозаміщених кислот зумовлена будовою вуглецевого скелета та положенням у ньому атома галогену.
СПОСОБИ ОДЕРЖАННЯ
Галогенування насичених карбонових кислот та їх похiдних.
Пряме галогенування кислот вiдбувається важко. При фторуваннi утворюються перфторокарбоновi кислоти (перфторо - повнiстю фторованi). Фтор одержують безпосередньо у процесі фторування, шляхом електролізу рідкого фтороводню.
Фтороангiдрид трифтороцтової кислоти
Хлорування протiкає при освiтленнi або нагрiваннi з утворенням усiх можливих похiдних a,b,g тощо.
Оцтова Монохлороцтова Дихлороцтова Трихлороцтова кислота кислота кислота кислота
Бромування вiдбувається у присутностi червоного фосфору з утворенням a-похiдних (метод Гелля-Фольгарда-Зелiнського). Метод дозволяє одержувати також хлорозамiщенi карбоновi кислоти.
Пряме йодування насичених кислот не вiдбувається.
Приєднання галогеноводнiв до ненасичених кислот (одержання b-галогенопохiдних)
Приєднання галогеноводнiв до α-,β-ненасичених кислот протiкає проти правила Марковнiкова (див.стор.), у результаті чого атом галогену приєднується до β-вуглецевого атому.
Реакцiї нуклеофiльного-замiщення (обмін інших груп на галоген)
3-Гiдроксипропанова кислота 3-Хлоропропанова кислота
Реакцiї теломеризацiї (одержання w-галогенозаміщених кислот)
Реакцiя полiмеризацiї, що вiдбувається в присутностi передавача ланцюга-телогена (CCl4, CBr4 тощо) та пероксидних iнiцiаторiв, називається теломеризацiєю.
ФIЗИЧНI ТА ХIМIЧНI ВЛАСТИВОСТІ
Галогенозаміщені кислоти - це рiдини або твердi речовини, які виявляють властивостi, як карбонових кислот, так i галогенопохiдних. Вони сильнiшi, нiж вiдповiднi карбоновi кислоти, через вплив –I-еф. галогенiв. Найсильнiшою кислотою даного типу є трифтороцтова кислота CF3COOH. За карбоксильною групою галогенозаміщені кислоти утворюють усi вiдомi функцiональнi похiднi – солі, галогеноангiдриди, ангідриди, амiди, естери тощо. За участю атома галогену вони здатні вступати майже у всі реакції, що й галогенопохідні вуглеводнів. Так, a-галогенозаміщені карбоновi кислоти та їх похiднi легко вступають у реакцiю з рiзними нуклеофiльними реагентами, що пояснюється впливом –I-еф. карбоксильної групи:
Аналогiчнi реакцiї протiкають з b,g,d,w-галогенозаміщеними карбоновими кислотами, але ці реакції вимагають жорсткіших умов. B-Галогенозаміщені кислоти при нагрiваннi вiдщеплюють галогеноводень з утворенням ненасичених кислот.
Акрилова кислота Реакцiя декарбоксилування
a-Ди- i a-тригалогенокарбоновi кислоти при нагрiваннi відщеплюють СО2 (декарбоксилювання).
Промислове застосування знаходять хлороцтова, трихлороцтова, трифтороцтова кислоти.
ГIДРОКСИКИСЛОТИ
Гiдроксикислоти мiстять у молекулi одночасно гiдроксильну i карбоксильну групи. Їх класифiкують за основнiстю (кiлькiсть -СООН-груп) та атомнiстю (кiлькiсть -ОН-груп, включаючи ОН-групи в карбоксильних групах).
Глiколева Винна Яблучна (одноосновна, (двоосновна, (двоосновна, двоатомна) чотириатомна) триатомна)
НОМЕНКЛАТУРА
За номенклатурою (IUPAC) назви гiдроксикислот утворюють з назв вiдповiдних карбонових кислот додаванням префiкса гiдрокси -. Нумерацiя головного ланцюга починається з атома вуглецю карбоксильної групи.
3-Гiдроксипропанова 2,3-Дигiдроксибутандiова
Якщо користуються тривіальною назвою кислоти, то положення ОН-групи позначаються буквами грецького алфавiту a, b, g - тощо.
a-Гiдроксипропiонатна g-Гiдроксибутиратна
Крiм того, для гiдроксикислот часто застосовують тривiальні назви (глiколева, молочна, винна, яблучна тощо).
Методи одержання
Похідні карбонатної кислоти
Хлороангідриди Монохлороангідрид карбонатної кислоти – нестійка сполука, що розкладається під час утворення.
Дихлороангідрид (фосген) одержують за реакцією:
Фосген – отруйний газ (темп.кип. 8,3оС) зі специфічним запахом прілого сіна. Водою повністю гідролізується:
При взаємодії зі спиртами він утворює естери хлорокарбонатної та карбонатної кислот:
Етилхлорокарбонат
Диетилкарбонат
З гліколями утворює циклічні естери:
Етиленгліколькарбонат
Аміди Неповний амід карбонатної кислоти – карбамінова кислота нестійка і у вільному стані не існує.
Карбамінова кислота
Її естери називаються уретанами. Вони утворюються при взаємодії естерів хлорокарбонатної кислоти з аміаком.
Метилуретан
Деякі уретани застосовуються в медицині, як ефективні транквілізатори:
«Мепробамат»
В останні роки особливого значення набули поліуретани, які широко використовують для виробництва різноманітних пластмас. З поліуретану виготовляють конструкційні матеріали, синтетичну шкіру, герметики, клеї тощо. Вспінений поліуретан відомий під назвою «поролон». Одержують поліуретани взаємодією діізоціанатів з гліколями:
м-Фенілендіамін Фосген м-Фенілендіізоціанат
Поліуретан
Повний амід карбонатної кислотиназивається карбамідом або сечовиною. У промисловості карбамід одержують за схемою:
Амоній карбонат Карбамід
Раніше карбамід одержували ціанамідним методом:
Кальцій Кальцій ціанамід карбід
Ціанамід легко гідролізується з утворенням карбаміду:
Карбамід також можна одержати з фосгену, йому притаманні всі властивості амідів.
У лужному або кислому середовищі карбамід гідролізується:
Карбамід алкілується за атомами азоту, але важче, ніж аліфатичні аміни:
Алкілкарбамід
Ацильні похідні карбаміду називають уреїдами.
Ацетилкарбамід (уреїд)
Уреїд α-бромізовалеріанової кислоти використовують як снодійний препарат – «бромурал».
Двоосновні кислоти утворюють циклічні уреїди:
Малонова Барбітурова кислота кислота
Похідні барбітурової кислоти також використовують, як ефективні снодійні препарати:
Діетилбарбітурова кислота Етилфенілбарбітурова кислота «Веронал» «Фенобарбітал» або «Люмінал»
Карбамід використовується для одержання карбамідо-формальдегідних смол:
N,N-Дигідроксиметилкарбамід
Карбамідоформальдегідний полімер
Крім лінійних макромолекул, утворюються просторовозшиті полімери. З карбамідоформальдегідної смоли виготовляють посуд, товари широкого вжитку, оздоблювальні матеріали. Велику кількість карбаміду використовують як цінне азотне добриво, що чудово засвоюється рослинами.
ОКСоКИСЛОТИ
За взаємним розташуванням карбоксильної та карбонільної груп вони поділяються на α, β, γ і так далі, за аналогією до гідроксикислот. НОМЕНКЛАТУРА За замісниковою номенклатурою IUPAC назви оксокислот утворюються з назв відповідних карбонових кислот додаванням префікса оксо - (табл.1). За радикало-функціональною номенклатурою до назви карбонової кислоти додається назва ацила, що містить оксогрупу. Збережені також деякі тривіальні назви.
Таблиця 1 Назви деяких оксокислот
СПОСОБИ ОДЕРЖАННЯ ХІМІЧНІ ВЛАСТИВОСТІ
Оксокислоти сильніші кислоти, ніж відповідні їм незаміщені і, навіть, гідроксикислоти. Так, константа дисоціації піровиноградної кислоти 320 · 10-5 ; молочної 13,7·10-5 а пропіонової 1,35·10-5 . Для них характерні властивості, як карбонільних сполук, так і карбонових кислот. Причому, взаємний вплив цих груп за рахунок як індукційного, так і мезомерного ефектів збільшує їх реакційну здатність. 1. Реакції за участю карбонільної групи: 1.1. Реакція Канніццаро (в цю реакцію вступають тільки альдегідокислоти).
Калій оксалат Калієва сіль гліколевої кислоти Реакції енольної форми
Важливою властивістю АОЕ є його здатність розкладатися при нагріванні з водними розчинами лугів. Причому, напрям розкладання залежить від концентрації лугу. Концентрований лу г виступає як сильний нуклеофіл і атакує карбонільний атом вуглецю в молекулі АОЕ. Утворений у результаті приєднання аніон розщеплюється на ацетат-аніон і етилацетат.
Це т.з. кислотне розчеплення АОЕ, продуктом якого є натрійацетат і спирт. У присутності розведеного лугу спочатку відбувається гідроліз АОЕ і утворена сіль ацетооцтової кислоти декарбоксилює з утворенням ацетону:
Це кетонне розщеплення АОЕ. Отже схема лужного розщеплення АОЕ виглядає так:
Ще однією особливістю АОЕ є те, що атоми водню метиленової групи протонізовані за рахунок прояву -І-еф. двох сусідніх карбонільних груп і при дії на АОЕ алкоголятів лужних металів (наприклад етилату натрію) можуть обмінюватися на натрій з утворенням натрійацетооцтового естеру
Негативний заряд аніону натрійацетооцтового естеру за рахунок спряження делокалізується між атомом вуглецю і двома атомами кисню, що можна подати граничними структурами:
Надалі для спрощення зупинимося на формі:
Аніон АОЕ містить спряжену систему з вирівняними зв'язками і делокалізованим негативним зарядом. Отже, у реакціях він реагує як за киснем з утворенням О-похідних, так і за вуглецевим атомом з утворенням С-похідних. Тому для нього характерна подвійна реакційна здатність. Так, наприклад, алкілювання і ацилювання протікає, головним чином, у вуглецевого атома. Утворення О- або С-похідних можна показати на прикладі реакції алкілювання.
ГЕТЕРОФУНКЦІОНАЛЬНІ СПОЛУКИ У попередніх розділах ми розглядали сполуки, які містять у молекулах одну або декілька однакових функціональних груп. Разом з тим існує величезна кількість сполук, що містять одночасно двi або бiльше рiзних за своєю природою функцiональних груп. Такі сполуки неможливо віднести до якогось певного класу і тому їх виділяють в особливий клас гетерофункціональних сполук або сполук зі змішаними функціями. До них вiдносять галогенозамiщенi кислоти, гiдроксикислоти, амiнокислоти, альдегiдо- i кетокислоти, гiдроксиальдегiди, гiдроксикетони та iншi.
ГАЛОГЕНОЗАМIЩЕНI КИСЛОТИ
Галогенозамiщенi кислоти, це карбонові кислоти, якi в алкільному залишку мiстять один або декілька атомів галогену.
Моногалогенозамiщена Полiгалогенозамiщена (хлороцтова кислота) (трихлороцтова кислота)
IЗОМЕРIЯ, НОМЕНКЛАТУРА
За систематичною (IUPАC) номенклатурою, назви галогенозаміщених кислот утворюють вiд назви вiдповiдної карбонової кислоти, додаючи префікс фторо-, хлоро-, бромо-, йодо-, а положення атома галогену вказується цифрою (локантом) (див.стор.). Нумерацiя головного ланцюга починається з атома вуглецю карбоксильної групи.
Якщо користуються тривіальними назвами кислот, то положення галогену вiдносно карбоксильної групи вказують буквами грецького алфавiту (a,b,g).
Iзомерiя галогенозаміщених кислот зумовлена будовою вуглецевого скелета та положенням у ньому атома галогену.
СПОСОБИ ОДЕРЖАННЯ
Галогенування насичених карбонових кислот та їх похiдних.
Пряме галогенування кислот вiдбувається важко. При фторуваннi утворюються перфторокарбоновi кислоти (перфторо - повнiстю фторованi). Фтор одержують безпосередньо у процесі фторування, шляхом електролізу рідкого фтороводню.
Фтороангiдрид трифтороцтової кислоти
Хлорування протiкає при освiтленнi або нагрiваннi з утворенням усiх можливих похiдних a,b,g тощо.
Оцтова Монохлороцтова Дихлороцтова Трихлороцтова кислота кислота кислота кислота
Бромування вiдбувається у присутностi червоного фосфору з утворенням a-похiдних (метод Гелля-Фольгарда-Зелiнського). Метод дозволяє одержувати також хлорозамiщенi карбоновi кислоти.
Пряме йодування насичених кислот не вiдбувається.
|
|||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 1198; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.212.203 (0.012 с.) |





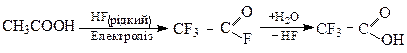








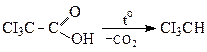
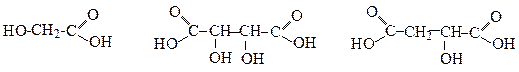


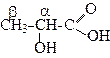










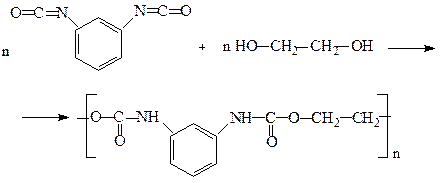













 Оксокислотами називають гетерофункціональні сполуки, що містять у молекулі одночасно карбоксильну і карбонільну групи. Інша назва карбонільної групи – оксогрупа, звідки стає зрозумілою назва цього класу сполук – оксокислоти.
Оксокислотами називають гетерофункціональні сполуки, що містять у молекулі одночасно карбоксильну і карбонільну групи. Інша назва карбонільної групи – оксогрупа, звідки стає зрозумілою назва цього класу сполук – оксокислоти.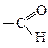 Оксогрупа може бути кетонною, якщо вона сполучена з двома радикалами, або входити до складу альдегідної групи. Тому оксокислоти поділяють на кетокислоти та альдегідокислоти.
Оксогрупа може бути кетонною, якщо вона сполучена з двома радикалами, або входити до складу альдегідної групи. Тому оксокислоти поділяють на кетокислоти та альдегідокислоти.
 Кетокислоти
Кетокислоти


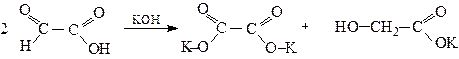

 Останній в лужному середовищі гідролізується до ацетату натрію і етанолу:
Останній в лужному середовищі гідролізується до ацетату натрію і етанолу:



 Тому натрійацетооцтовий естер інколи записують так:
Тому натрійацетооцтовий естер інколи записують так:

 Але слід зауважити, що алкілування і ацилювання протікає, головним чином, у вуглецевого атома. Здатність натрійацетооцтового естеру утворювати С-похідні, а також розщеплюватися під дією лугів використовують для синтезу на його основі карбонових кислот та метилкетонів.
Але слід зауважити, що алкілування і ацилювання протікає, головним чином, у вуглецевого атома. Здатність натрійацетооцтового естеру утворювати С-похідні, а також розщеплюватися під дією лугів використовують для синтезу на його основі карбонових кислот та метилкетонів.


