
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гідроліз гемінальних дигалогензаміщених карбонових кислотСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Окиснення спиртів, гліколів, гідроксикислот
Молочна кислота Піровиноградна кислота Взаємодія ацилгалогенідів з ціанідами з наступним гідролізом оксонітрилів
Ацетилхлорид Оксонітрил 2-Оксопропанова кислота ХІМІЧНІ ВЛАСТИВОСТІ
Оксокислоти сильніші кислоти, ніж відповідні їм незаміщені і, навіть, гідроксикислоти. Так, константа дисоціації піровиноградної кислоти 320 · 10-5 ; молочної 13,7·10-5 а пропіонової 1,35·10-5 . Для них характерні властивості, як карбонільних сполук, так і карбонових кислот. Причому, взаємний вплив цих груп за рахунок як індукційного, так і мезомерного ефектів збільшує їх реакційну здатність. 1. Реакції за участю карбонільної групи: 1.1. Реакція Канніццаро (в цю реакцію вступають тільки альдегідокислоти).
Калій оксалат Калієва сіль гліколевої кислоти Відновлення карбонільної групи
Окиснення за альдегідною групою
1.4. Реакції нуклеофільного приєднання:
2. Реакції за участю карбоксильної групи: оксокислоти утворюють солі, аміди, естери (див.стор.). α- і β-Оксокислоти при нагріванні, особливо в присутності сильних кислот, легко декарбоксилюють.
Ацетооцтова кислота та ацетооцтовий естер Особливої уваги заслуговує 3-оксобутанова або ацетооцтова кислота, у зв'язку з широким застосуванням її естерів в органічному синтезі. Її отримують із кетену за реакцією:
Ацетооцтова кислота легко декарбоксилюється; тому в синтезах використовують не саму кислоту, а її етиловий естер – ацетооцтовий естер. Ацетооцтовий етер (АОЕ) також отримують з дикетену
Ацетооцтовий естер Іншою реакцією одержання АОЕ може служити конденсація Кляйзена етилацетату. Ця реакція протікає за аналогією з альдольною конденсацією (див.стор.) у присутності алкоголятів лужних металів:
Механізм конденсації Кляйзена. Під впливом оксогрупи в молекулі етилацетату атом водню біля α-вуглецевого атома набуває підвищеної рухливості і в присутності етилату натрію відщеплюється у вигляді протону з утворенням карбаніону.
Карбаніон Карбаніон є сильним нуклеофілом і реагує з іншою молекулою етилацетату за карбонільною групою з утворенням комплексу (І), який відщеплює молекулу етилату натрію і перетворюється на АОЕ.
Кетонна форма Енольна форма 90% 10% Як правило, енольна форма енергетично менше вигідна, але в даному випадку за рахунок виникнення спряженої системи кратних зв'язків і внутрішньомолекулярного водневого зв'язку вона дещо стабілізується.
Кетоенольна таутомерія називається також прототропною ізомерією, тому що супроводжується перенесенням протона. Завдяки таутомерним перетворенням АОЕ здатний вступати в реакції, як в кетонній, так і в енольній формах. Реакції кетонної форми:
Реакції енольної форми
Важливою властивістю АОЕ є його здатність розкладатися при нагріванні з водними розчинами лугів. Причому, напрям розкладання залежить від концентрації лугу. Концентрований лу г виступає як сильний нуклеофіл і атакує карбонільний атом вуглецю в молекулі АОЕ. Утворений у результаті приєднання аніон розщеплюється на ацетат-аніон і етилацетат.
Це т.з. кислотне розчеплення АОЕ, продуктом якого є натрійацетат і спирт. У присутності розведеного лугу спочатку відбувається гідроліз АОЕ і утворена сіль ацетооцтової кислоти декарбоксилює з утворенням ацетону:
Це кетонне розщеплення АОЕ. Отже схема лужного розщеплення АОЕ виглядає так:
Ще однією особливістю АОЕ є те, що атоми водню метиленової групи протонізовані за рахунок прояву -І-еф. двох сусідніх карбонільних груп і при дії на АОЕ алкоголятів лужних металів (наприклад етилату натрію) можуть обмінюватися на натрій з утворенням натрійацетооцтового естеру
Негативний заряд аніону натрійацетооцтового естеру за рахунок спряження делокалізується між атомом вуглецю і двома атомами кисню, що можна подати граничними структурами:
Надалі для спрощення зупинимося на формі:
Аніон АОЕ містить спряжену систему з вирівняними зв'язками і делокалізованим негативним зарядом. Отже, у реакціях він реагує як за киснем з утворенням О-похідних, так і за вуглецевим атомом з утворенням С-похідних. Тому для нього характерна подвійна реакційна здатність. Так, наприклад, алкілювання і ацилювання протікає, головним чином, у вуглецевого атома. Утворення О- або С-похідних можна показати на прикладі реакції алкілювання.
|
||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 512; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.12.133 (0.01 с.) |

 Дихлороцтова Гліоксилова
Дихлороцтова Гліоксилова



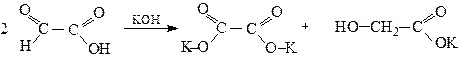
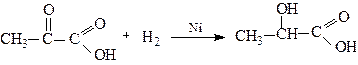



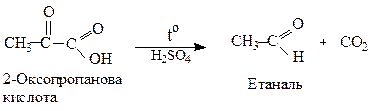





 Ацетооцтовий естер завдяки особливостям своєї будови виявляє кетоенольну таутомерію (див.стор.).
Ацетооцтовий естер завдяки особливостям своєї будови виявляє кетоенольну таутомерію (див.стор.).



 Останній в лужному середовищі гідролізується до ацетату натрію і етанолу:
Останній в лужному середовищі гідролізується до ацетату натрію і етанолу:



 Тому натрійацетооцтовий естер інколи записують так:
Тому натрійацетооцтовий естер інколи записують так:

 Але слід зауважити, що алкілування і ацилювання протікає, головним чином, у вуглецевого атома. Здатність натрійацетооцтового естеру утворювати С-похідні, а також розщеплюватися під дією лугів використовують для синтезу на його основі карбонових кислот та метилкетонів.
Але слід зауважити, що алкілування і ацилювання протікає, головним чином, у вуглецевого атома. Здатність натрійацетооцтового естеру утворювати С-похідні, а також розщеплюватися під дією лугів використовують для синтезу на його основі карбонових кислот та метилкетонів.


