
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Стереохімія Реакцiй замiщення при асиметричному атомi вуглецюСодержание книги
Поиск на нашем сайте
Детально вивченi реакцiї SN, (див.стор.), для яких К.Iнгольд сформулював такi правила: 1. Замiщення за механiзмом SN2 завжди супроводжується повною змiною конфiгурацї (див.стор.). 2. Замiщення за механiзмом SN1 супроводжується частковою зміною конфiгурацiї з утворенням рацемiчної сумiшi (рацемiзацiєю) (див.стор.). В окремих випадках реакція заміщення може протікати без зміни конфігурації. Так, при нагріванні галогенопохідних з вологим твердим аргентум оксидом відбувається заміна галогену гідроксильною групою
Дана реакція протікає за специфічним механізмом, який забезпечує збереження конфігурації вихідного галогенопохідного. Вищенаведені факти можна проілюструвати схемою взаємного перетворення хлоробурштинової та гідроксибурштинової кислот:
Ці стеричні закономірності протікання реакцій слід враховувати при синтезі сполук з певною просторовою конфігурацією. Карбонатна кислота та її похідні
Сама карбонатна кислота та її солі розглядаються у предметі «Неорганічна хімія». Однак, такі похідні, як галогеноангідриди, естери, аміди тощо – є органічними сполуками. Карбонатна кислота утворюється при розчиненні вуглекислого газу у воді.
Похідні карбонатної кислоти
Хлороангідриди Монохлороангідрид карбонатної кислоти – нестійка сполука, що розкладається під час утворення.
Дихлороангідрид (фосген) одержують за реакцією:
Фосген – отруйний газ (темп.кип. 8,3оС) зі специфічним запахом прілого сіна. Водою повністю гідролізується:
При взаємодії зі спиртами він утворює естери хлорокарбонатної та карбонатної кислот:
Етилхлорокарбонат
Диетилкарбонат
З гліколями утворює циклічні естери:
Етиленгліколькарбонат
Аміди Неповний амід карбонатної кислоти – карбамінова кислота нестійка і у вільному стані не існує.
Карбамінова кислота
Її естери називаються уретанами. Вони утворюються при взаємодії естерів хлорокарбонатної кислоти з аміаком.
Метилуретан
Деякі уретани застосовуються в медицині, як ефективні транквілізатори:
«Мепробамат»
В останні роки особливого значення набули поліуретани, які широко використовують для виробництва різноманітних пластмас. З поліуретану виготовляють конструкційні матеріали, синтетичну шкіру, герметики, клеї тощо. Вспінений поліуретан відомий під назвою «поролон». Одержують поліуретани взаємодією діізоціанатів з гліколями:
м-Фенілендіамін Фосген м-Фенілендіізоціанат
Поліуретан
Повний амід карбонатної кислотиназивається карбамідом або сечовиною. У промисловості карбамід одержують за схемою:
Амоній карбонат Карбамід
Раніше карбамід одержували ціанамідним методом:
Кальцій Кальцій ціанамід карбід
Ціанамід легко гідролізується з утворенням карбаміду:
Карбамід також можна одержати з фосгену, йому притаманні всі властивості амідів.
У лужному або кислому середовищі карбамід гідролізується:
Карбамід алкілується за атомами азоту, але важче, ніж аліфатичні аміни:
Алкілкарбамід
Ацильні похідні карбаміду називають уреїдами.
Ацетилкарбамід (уреїд)
Уреїд α-бромізовалеріанової кислоти використовують як снодійний препарат – «бромурал».
Двоосновні кислоти утворюють циклічні уреїди:
Малонова Барбітурова кислота кислота
Похідні барбітурової кислоти також використовують, як ефективні снодійні препарати:
Діетилбарбітурова кислота Етилфенілбарбітурова кислота «Веронал» «Фенобарбітал» або «Люмінал»
Карбамід використовується для одержання карбамідо-формальдегідних смол:
N,N-Дигідроксиметилкарбамід
Карбамідоформальдегідний полімер
Крім лінійних макромолекул, утворюються просторовозшиті полімери. З карбамідоформальдегідної смоли виготовляють посуд, товари широкого вжитку, оздоблювальні матеріали. Велику кількість карбаміду використовують як цінне азотне добриво, що чудово засвоюється рослинами.
ОКСоКИСЛОТИ
За взаємним розташуванням карбоксильної та карбонільної груп вони поділяються на α, β, γ і так далі, за аналогією до гідроксикислот. НОМЕНКЛАТУРА За замісниковою номенклатурою IUPAC назви оксокислот утворюються з назв відповідних карбонових кислот додаванням префікса оксо - (табл.1). За радикало-функціональною номенклатурою до назви карбонової кислоти додається назва ацила, що містить оксогрупу. Збережені також деякі тривіальні назви.
Таблиця 1 Назви деяких оксокислот
СПОСОБИ ОДЕРЖАННЯ
|
|||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 373; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.10.104 (0.01 с.) |

 Реакцiї замiщення при асиметричному атомi вуглецю можуть протiкати з частковою або повною змiною конфiгурацiї молекул. За iм’ям вченого, який вiдкрив таку змiну конфiгурацiї (П.I.Вальден, 1895), вона називається Вальденiвським обертанням i на схемi реакцiї позначається у виглядi петлi
Реакцiї замiщення при асиметричному атомi вуглецю можуть протiкати з частковою або повною змiною конфiгурацiї молекул. За iм’ям вченого, який вiдкрив таку змiну конфiгурацiї (П.I.Вальден, 1895), вона називається Вальденiвським обертанням i на схемi реакцiї позначається у виглядi петлi
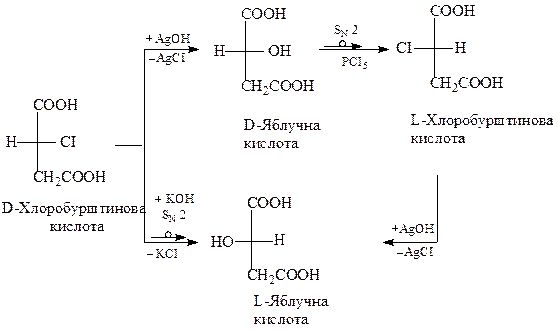
 На відміну від інших гідроксикислот, гідроксигрупа яких віддалена від карбоксильної і носить спиртовий характер, у карбонатної кислоти обидві гідроксильні групи зв’язані безпосередньо з карбонілом і не відрізняються між собою. Тому карбонатна кислота, хоч формально і відноситься до гідроксикислот, однак вона більше нагадує двоосновну кислоту.
На відміну від інших гідроксикислот, гідроксигрупа яких віддалена від карбоксильної і носить спиртовий характер, у карбонатної кислоти обидві гідроксильні групи зв’язані безпосередньо з карбонілом і не відрізняються між собою. Тому карбонатна кислота, хоч формально і відноситься до гідроксикислот, однак вона більше нагадує двоосновну кислоту.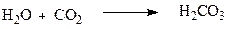










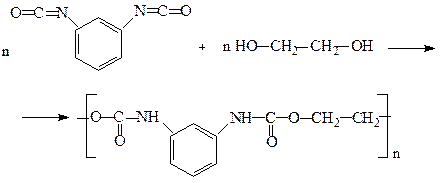













 Оксокислотами називають гетерофункціональні сполуки, що містять у молекулі одночасно карбоксильну і карбонільну групи. Інша назва карбонільної групи – оксогрупа, звідки стає зрозумілою назва цього класу сполук – оксокислоти.
Оксокислотами називають гетерофункціональні сполуки, що містять у молекулі одночасно карбоксильну і карбонільну групи. Інша назва карбонільної групи – оксогрупа, звідки стає зрозумілою назва цього класу сполук – оксокислоти.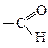 Оксогрупа може бути кетонною, якщо вона сполучена з двома радикалами, або входити до складу альдегідної групи. Тому оксокислоти поділяють на кетокислоти та альдегідокислоти.
Оксогрупа може бути кетонною, якщо вона сполучена з двома радикалами, або входити до складу альдегідної групи. Тому оксокислоти поділяють на кетокислоти та альдегідокислоти.
 Кетокислоти
Кетокислоти





