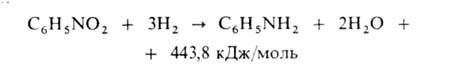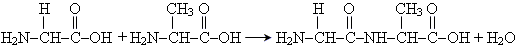Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Класифікація карбонових кислотСодержание книги
Поиск на нашем сайте
• класифікація за кількістю карбоксильних груп монокарбонові кислоти, наприклад: мурашина кислота, оцтова кислота, полікарбоннові кислоти, наприклад: щавлева кислота, янтарна кислота • класифікація за будовою вуглеводневого радикалу насичені карбонові кислоти, наприклад: мурашина кислота, оцтова кислота. ненасичені карбонові кислоти, наприклад: акрилова кислота ароматичні карбонові кислоти, наприклад: бензойна кислота Гомлогічний ряд Метанова кислота - Мурашина кислота Етанова кислота - Оцтова кислота Пропанова кислота - Пропіонова кислота Бутанова кислота - Масляна кислота Пентанова кислота - Валеріанова кислота Будова У молекулах карбонових кислот, як і в молекулах спиртів, містяться гідроксильні групи, унаслідок чого кислоти виявляють деяку схожість із спиртами. Але в кислотах гідроксильна група знаходиться під впливом групи атомів карбоксилу, в той час як в спиртах на неї впливає вуглеводневий радикал. Вплив карбонільної групи на гідроксил проявляється, зокрема, в тому, що атом водню гідроксильної групи в кислотах значно більш «кислотний», ніж у спиртах: легше заміщується металом і може відщеплюватися у вигляді катіона За систематичною номенклатурою, назву кислот утворюють із назв відповідних насичених вуглеводнів, додаючи до них суфікс і закінчення -ова і слово кислота. 25 Хімічні та сфізичні властивості одноосновних карбонових кислот Фізичні властивості Мурашина кислота — безбарвна рідина з різким запахом, температура плавлення Оцтова кислота — за кімнатної температури безбарвна рідина з різким характерним запахом. За температури нижчої за Хімічні властивості 1. карбонові кислоти проявляють всі властивості характерні для неорганічних кислот і є слабкими електролітами: 2СH3COOH + 2Na → 2CH3COONa + H2; 2СH3COOH + Na2O → 2CH3COONa + H2O; СH3COOH + NaOH → CH3COONa + H2O; 2СH3COOH + Na2CO3 → 2CH3COONa + H2O + CO2; СH3COOH + NaHCO3 → CH3COONa + H2O + CO2 СH3COONa + H2SO4 → CH3COOH + NaHSO4 2. утворення складних ефірів (реакція етерифікації) у присутності каталізатора – сульфатної кислоти:
Зворотна реакція називається омиленням або гідролізом складного ефіру. Добування 1. окислення спиртів або альдегідів
Отримання мурашиної кислоти 1. каталітичне окислення метану 2CH4 + 3O2 → 2H-COOH + 2H2O 3. Взаємодія оксиду Карбогену(ІІ) з гідроксидом Натрію при нагріванні CO + NaOH → H-COONa; H-COONa + H2SO4 → H-COOH + NaHSO4 Отримання оцтової кислоти 1. каталітичне окислення бутану 2CH3–CH2–CH2–CH3 + 5O2 → 4CH3COOH + 2H2O 2. Взаємодія оксиду Карбогену(ІІ) з метанолом CH3OH + CO → CH3COOH Отримання ароматичних кислот
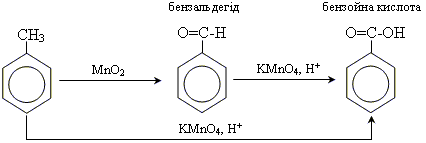
1. окислення гомологів бензолу
26 Естери Естери можна розглядати як похідні кислот, у яких Гідроген гідроксильної групи заміщений на вуглеводневий радикал спирту. Назви естерів утворюються від назв відповідних кислот і спиртів з додаванням слова естер. Наприклад, естер
можна назвати етиловий естер оцтової кислоти, за міжнародною систематичною номенклатурою — етилацетат (суфікс -ат). Загальна формула естерів:
де R1 — вуглеводневий радикал кислоти (у мурашиній кислоті це атом Гідрогену), R2 — вуглеводневий радикал спирту. Фізичні властивості естерів. Естери нижчих карбонових кислот і спиртів — леткі рідини, малорозчинні або нерозчинні у воді, добре розчинні у спирті та інших органічних розчинниках. Багато естерів мають приємний запах. Естери вищих кислот і спиртів — воскоподібні речовини, без запаху, нерозчинні у воді, добре розчинні в органічних розчинниках. Реакція утворення естеру з карбонової кислоти і спирту називається реакцією естерифікації. Наприклад: CH3– метилацетат Хімічні властивості естерів. Взаємодія естеру з водою, що призводить до утворення вихідних спирту і кислоти, називається реакцією гідролізу, або омилення. 1) Кислотний гідроліз (каталізатор — іони Гідрогену) оборотний:
2) Лужний гідроліз (каталізатор — іони гідроксигрупи) необоротний, оскільки утворюється сіль карбонової кислоти:
Застосування естерів. Складні естери застосовуються як розчинники та розріджувачі для лаків і фарб, як ароматизатори в харчовій промисловості. 27 Жири Жири — це естери, утворені вищими одноосновними карбоновими кислотами й триатомним спиртом гліцерином. Загальна назва таких сполук — тригліцериди. Природні жири — суміш різних тригліцеридів. Загальна формула тригліцеридів:
де Назви жирів визначаються назвами кислот, які входять до їхнього складу. Наприклад, жир
називається тригліцерид стеаринової кислоти,або тристеарин. Фізичні властивості жирів. За кімнатної температури жири бувають рідкими й твердими. Агрегатний стан жирів визначається жирними кислотами, які входять до їхнього складу. Тверді жири утворені насиченими кислотами, рідкі жири (олії) — ненасиченими. Температура плавлення жиру тим вища, чим більше в ньому насичених кислот і чим довший кислотний радикал. Тваринні жири частіше тверді, рослинні частіше рідкі. Жири розчинні в органічних розчинниках і нерозчинні у воді. Біологічне значення жирів. Жири входять до складу клітин рослинних і тваринних організмів, є джерелом енергії в клітині, будівельним матеріалом, беруть участь в обміні речовин, відкладаються в тканинах організму як запасна поживна речовина. Хімічні властивості жирів. 1) Рідкі жири можна перетворити на тверді шляхом їх гідрування:
Ця реакція лежить в основі виробництва маргарину, мила, стеарину й гліцерину. 2) Кислотний гідроліз жирів (оборотний):
→ 3) Лужний гідроліз жирів (необоротний):
натрій стеарат (мило) У результаті утворюються солі жирних кислот — мила. Застосування жирів. Жири застосовуються в харчовій промисловості, в косметології, для добування гліцерину і вищих карбонових кислот. Значення жирів У харчуванні Жири - важливий продукт харчування людини. Жири становлять головний компонент таких продуктів харчування, як вершкове масло, рослинні олії, маргарин, смалець. Багато жирів містится у свинячому салі та у сирі. Значення жирів у харчуванні різноманітне. Недостатнє надходження жирів у їжу негативно впливає на різні види обміну речовин, функціональний стан окремих органів і систем і, у підсумку, на працездатність і опірність організму несприятливим чинникам навколишнього середовища, у тому числі інфекційним агентам. У промисловості Деякі жири (здебільшого рослинного походження) використовуються для виробництва мила. 28 Мила Ми́ло — розчинна у воді мийна речовина; як хімічний продукт являє собою відносно складне з'єднання жирних кислот з лугами, а за своєю будовою відноситься до класу солей. Випускається в твердому стані, рідкому, а також у вигляді порошку і гранул. Мийними засобами називаються натуральні й синтетичні речовини з дією, що очищає, особливо мило й пральні порошки, застосовувані в побуті, промисловості й сфері обслуговування Мило одержують у результаті хімічної взаємодії жиру й луги. Швидше за все, воно було відкрито по чистій випадковості, коли над багаттям жарили м'ясо, і жир стік на золу, що володіє лужними властивостями Мило й синтетичні мийні засоби містять речовини, що підвищують змочувальні властивості води за рахунок зменшення сили поверхневого натягу. Ці речовини називаються активними-поверхнево-активними (УПАВШИ), оскільки діють на поверхні рідини (маються на увазі всі границі, не тільки верхня). Саме через поверхневий натяг вода сама по собі не має достатню дію, що чистить. Вступаючи в контакт із плямою, молекули води притягаються друг до друга замість того, щоб захоплювати частки бруду. Інакше кажучи, вони не змочують бруд. 29 Аміни Амі́ни — азотовмісні органічні хімічні сполуки, похідні амоніаку (NH3), в якому атоми гідрогену заміщені однією чи багатьма групами інших атомів — вуглеводневими радикалами. Класифікація • класифікація за кількістю вуглеводневих радикалів, що заміщують атоми Гідрогену у молекулі аміаку первинні аміни, наприклад, метиламін*; вторинні аміни, наприклад, диметиламін*; третинні аміни, наприклад, триметиламін*. • класифікація за будовою вуглеводневих радикалів аліфатичні аміни, наприклад: метиламін*; ароматичні аміни, наприклад, анілін (феніламін)*. Залежно від природи радикалів аміни називаються: аліфатичними, ароматичними та гетероциклічними. Нижчі аліфатичні аміни — гази, вищі — рідини й тверді речовини. Найважливішим ароматичним аміном є анілін. Аміни проявляють основи властивості через наявність у атома нітрогену неподіленої електронної пари. Однією з важливих реакцій аліфатичних амінів є взаємодія їх з HNO2: первинні аміни при цьому утворюють спирти, вторинні — нітрозаміни, третинні не реагують. Ароматичні первинні аміни з HNO2 утворюють діазосполуки. Аміни широко використовуються в анілофарбувальній та хімічно-фармацевтичній промисловості, наприклад, як складники реагентів при флотації та масляній агломерації (грануляції, флокуляції) вугілля. Анілі́н — C6H5NH2 (амінбензол, феніламін), найпростіший ароматичний амін. Безбарвна рідина, малорозчинна у воді, змішується з спиртом, ефіром, бензолом; Під впливом повітря швидко темніє, стає коричневою. Пара його отруйна. t° кип. 184,4°, t° плав. — 6°. Анілін — одна з найважливіших органічних речовин Амінобензол утворює солі з мінеральними кислотами. Під дією азотистої кислоти на солі аніліну утворюються діазосполуки, які широко застосовують у виробництві барвників. Застосовується також у виробництві фармацевтичних препаратів, вибухових речовин, полімерів, прискорювачів вулканізації каучуку. Синтезував амінобензол 1842 року видатний російський хімік М. М. Зінін відновленням нітробензолу сірчистим амонієм Реакція Зініна. Зараз анілін одержують відновленням нітробензолу шляхом нагрівання з чавунними стружками і соляною кислотою. Велику кількість аніліну синтезують на Рубіжанському хімічному комбінаті. Якісні реакції на анілін: 1. Взаємодія з хлорним вапном 2. окиснення хромовою сумішшю. Добування:
30 Амінокислоти Амінокислота — це азотовмісна карбонова кислота, тобто — це хімічна речовина, молекула якої одночасно містить аміногрупу –NH2 та карбоксильну групу –СООН, і вуглецевий скелет. За тим, до якого атому вуглецю приєднана аміно- (або іміно-) група, амінокислоти поділяються на α, β, γ і т. д При цьому α-амінокислотами називаються такі, в яких карбоксильна та аміногрупа приєднані до одного і того ж атому вуглецю; β-амінокислотами — такі, де аміногрупа приєднана до атому вуглецю, сусіднього з тим, до якого приєднана карбоксильна; γ-амінокислотами — такі, де аміногрупа приєднана через один атом вуглецю від карбоксильної, і так далі. Класифікація В залежності від положення аміногрупи розрізняють a-, b-, g-амінокислоти, тощо. Найбільш важливе значення мають a-амінокислоти, які входять до складу білків. В загальному вигляді формулу a-амінокислоти можна представити наступним чином: • класифікація за хімічною природоюбзамісника у a-положенні аліфатичні, наприклад: гліцин*, аланін* ароматичні, наприклад: фенілаланін* гетероциклічні, наприклад: триптофан* «R» представляє радикал, або «боковий ланцюг», що є специфічним для кожної окремої амінокислоти. За властивостями радикалу амінокислоти поділяються на 4 групи: кислотні, основні, гідрофільні (полярні), гідрофобні (неполярні). Оптична ізомерія Окрім гліцина, де R=Н, стандартні амінокислоти утворюють два оптично-активних ізомери, що позначаються літерами L та D. Ці ізомери не розрізняються за хімічними властивостями, але по-різномі обертають площину поляризації світла, що проходить через їхній розчин. До складу протеїнів входять практично лише L-ізомери. D-ізомери амінокислот знайдені в складі деяких протеїнів, що утворюються в організмі морських черевоногих молюсків конусів, та в складі клітинних стінок бактерій. Утворення пептидного зв*язку
Хімічні властивості 1. Кислотно-основні властивості Амінокислоти проявляють амфотерні властивості оскільки вміщують як основну групу -NH2, так і кислотну групу -СООН. Амфотерність амінокислот проявляється, наприклад, при утворенні внутрішніх солей, так званих біполярних іонів H2N-CH2-COOH → H3N+-CH2-COO- Амінокислоти реагують як з лугами, так і з кислотами
2. Реакції поліконденсації a-Амінокислоти при взаємодії між собою утворюють аміди, які називають пептидами. Зв'язок
називається пептидним Так, наприклад, при взаємодії гліцину і аланіну утворюється дипептид гліцилаланін
Реакції утворення пептидів з амінокислот відносяться до реакцій поліконденсації. Використання • виробництво лікарських препаратів • виробництво харчових і кормових добавок Отримання 1. гідроліз природних білків 2. синтез з використанням галогензаміщених карбонових кислот
3. мікробіологічний синтез 31 Білки Білки́ — складні високомолекулярні природні органічні речовини, що складаються з амінокислот, сполучених пептидними зв'язками. В однині (білок) термін найчастіше використовується для посилання на білок, як речовину, коли не важливий її конкретний склад, та на окремі молекули або типи білків, у множині (білки) — для посилання на деяку кількість білків, коли точний склад важливий. Зазвичай білки є лінійними полімерами — поліпептидами, хоча інколи мають складнішу структуру. Невеликі білкові молекули, тобто олігомери поліпептидів, називаються пептидами. Послідовність амінокислот у конкретному білку визначається відповідним геном і зашифрована генетичним кодом. Хоча генетичний код більшості організмів визначає лише 20 «стандартних» амінокислот, їхнє комбінування уможливлює створення великого різномаїття білків із різними властивостями. Крім того, амінокислоти у складі білка часто піддаються посттрансляційним модифікаціям, які можуть виникати і до того, як білок починає виконувати свою функцію, і під час його «роботи» в клітині. Для досягнення певної функції білки можуть діяти спільно, і часто зв'язуються, формуючи великі стабілізовані комплекси (наприклад, фотосинтетичний комплекс). Склад Молекули білків є лінійними полімерами, що складаються з α-L-амінокислот (які є мономерами цих полімерів) і, в деяких випадках, з модифікованих основних амінокислот (щоправда модифікації відбуваються вже після синтезу білка на рибосомі). Структура Первинна структура — пептидна або амінокислотна послідовність, тобто послідовність амінокислотних залишків у пептидному ланцюжку. Саме первинна структура кодується відповідним геном і найбільшою мірою визначає властивості сформованого білка. Вторинна структура — локальне впорядковування фрагменту поліпептидного ланцюжка, стабілізоване водневими зв'язками і гідрофобними взаємодіями. Найпоширеніші типи вторинної структури білків включають[9]: α-спіралі (спіраль, що має 4 залишки на виток, стабілізована водневими зв'язками між пептидними групами з кроком у 4 ланки) і β-листи (кілька зигзагоподібних поліпептидних низок, в яких водневі зв'язки утворюються між відносно віддаленими ділянками ланцюжка або між різними ланцюжками, а не між близько розташованими пептидними групами, як це має місце для α-спіралі). Інші елементи вторинної структури включають π-спіралі (спіралі з кроком водневих зв'язків у 3 ланки), -спіралі (спіралі з кроком водневих зв'язків у 5 ланок), повороти, невпорядковані фрагменти та інші. Найпоширеніша єдина класифікація таких структур — номенклатура DSSP. Третинна структура — повна просторова будова цілої білкової молекули, просторове взаємовідношення вторинних структур одна до одної. Третинна структура загалом стабілізується нелокальними взаємодіями, найчастіше формуванням гідрофобного ядра, а також завдяки утворенню водневих зв'язків, солевих містків, інших типів іонних взаємодій, дисульфідних зв'язків між залишками цистеїну. До третинної структури зазвичай відносять і проміжні рівні між основними елементами вторинної структури та повною структурою білка — «надвторинну» структуру, що складається із структурних мотивів та доменів. Структурні мотиви — невеликі усталені поєднання кількох елементів вторинної структури, що мають схожу структуру, важливу для виконання білком певних функцій. Схожі структурні мотиви зазвичай виконують схожі функції, завдяки чому за ними можна передбачити функцію невідомого білка. Хоча структурні мотиви можуть бути аналогічними, частіше за все вони зберігаються в процесі еволюції видів. Домени — дещо більші елементи структури білка, що характеризуються стабілізацією незалежною від решти поліпептидного ланцюжка, і що часто виконують окрему функцію. В процесі еволюції елементи надвторинної структури можуть передаватися між генами, надаючи їм нові функції, таким чином існує набагато менше різновидів цих елементів, ніж різних білків. Процес передачі доменів можна здійснити і штучними методами генної інженерії, створюючи химерні білки. Четвертинна структура — структура, що виникає в результаті взаємодії кількох білкових молекул, які в даному контексті називають субодиницями. Повна структура кількох поєднаних субодиниць, що разом виконують спільну функцію, називається білковим комплексом. Класифікація Прості і складні білки За складом виділяють прості і складні білки. Прості білки містять тільки амінокислоти, зв'язані в ланцюжки. На відміну від них складні білки мають також неамінокислотні групи. Ці додаткові групи у складі складних білків називаються простетичними групами. Деякі простетичні групи служать кофакторами, необхідними для роботи ферментів. Інші, такі як полісахаридні ланцюжки, допомагають білку приймати потрібну конформацію і додають додаткову стабільність. Прикладами органічних простетичних груп в складі білків служать гем (в складі гемоглобіну), тіамін, біотин та інші. Неорганічні простетичні групи найчастіше складаються з іонів металів, найпоширенішими з яких є цинк, магній і молібден[14]. За типом простетичної групи складні білки поділяють на глікопротеїни, ліпопротеїни, хромопротеїни, нуклеопротеїни, фосфопротеїни, металопротеїни та деякі інші. 32 Властивості білків. Успіхи науки у вивченні та синтезі білків. Хімічні властивості 1. Денатурація Руйнування третинної і третинної структури білків під дією хімічних реагентів, нагрівання або радіації 2. Гідроліз Руйнування первинної структури білків під дією хімічних реагентів (луги, кислоти, ферменти) з утворенням a-амінокислот 3. Якісні реакції білків • біуретова реакція При взаємодії білків з солями міді у лужному середовищі спостерігається поява фіолетового забарвлення. Дана реакція характеризує наявність пептидних зв'язків: -CO - NH- • ксантопротеїнова реакція При дії нітратної кислоти на білки спостерігається поява жовтого забарвлення. Дана реакція характеризує наявність бензольних ядер, що входять до складу деяких амінокислот, наприклад, фенілаланіну:
Рибосомний синтез Білки синтезуються живими організмами з амінокислот на основі інформації, закодованої в генах. Кожен білок складається з унікальної послідовності амінокислот, яка визначається нуклеотидною послідовністю гену, що кодує даний білок. Генетичний код складається з трибуквених «слів», які називаються кодонами. Кожен кодон відповідає за приєднання до білка однієї амінокислоти: наприклад, поєднання AUG (АУГ) відповідає метіоніну. Оскільки ДНК складається з чотирьох типів нуклеотидів, то загальне число можливих кодонів дорівнює 64; а оскільки в білках використовується 20 амінокислот, то багато амінокислот визначаються більш ніж одним кодоном. Гени, що кодують білки, спочатку транскрибуются в послідовність нуклеотидів матричної РНК (мРНК) білками РНК-полімеразами. У прокаріотів мРНК може зчитуватися рибосомами в амінокислотну послідовність білків відразу після транскрипції, проте в більшості випадків у еукаріотів та інколи у бактерій вона оброблюється в процесі сплайсингу. Після цього еукаріоти повинні також транспортувати зрілу мРНК з ядра в цитоплазму, де знаходяться рибосоми. Швидкість синтезу білків вища у прокаріотів і може досягати 20 амінокислот в секунду[16]. Процес синтезу білка з мРНК називається трансляцією. Під час початкової стадії трансляції — ініціації, кодон метионіну розпізнається малою субодиницею рибосоми, до якої за допомогою білкових факторів ініціації приєднана метионінова транспортна РНК (тРНК). Після розпізнавання стартового кодону до малої субодиниці приєднується велика субодиниця рибосоми, і починається друга стадія трансляції — елонгація. На кожному кроці рибосоми від 5' до 3' кінця мРНК прочитується один кодон шляхом утворення водневих зв'язків між трьома нуклеотидами (кодоном) мрРНК і комплементарним йому антикодоном транспортної РНК, до якої приєднана відповідна амінокислота. Синтез пептидного зв'язку каталізує рибосомна РНК (рРНК), що утворює пептиділтрансферазний центр рибосоми. Рибосомна РНК каталізує утворення пептидного зв'язку між останньою амінокислотою пептиду, і амінокислотою, приєднаною до тРНК, позиціонуючи атоми азоту і вуглецю в положенні, сприятливому для проходження реакції. Фермент аміноацил-тРНК-синтетаза приєднує амінокислоти до їхньої тРНК. Третя, і остання стадія трансляції, термінація, відбувається при досягненні рибосомою стоп-кодону, який не кодує амінокислот, після чого білкові фактори термінації гідролізують останню тРНК від білка, припиняючи синтез. В рибосомах білки завжди синтезуються від N- до C- кінця. Нерибосомний синтез У деяких грибів і деяких бактерій існує менш поширений спосіб біосинтезу білків, який не вимагає участі рибосом. Синтез пептидів, зазвичай вторинних метаболітів (так званих нерибосомних пептидів), проводиться високомолекулярним білковим комплексом, NRP-синтетазою (від англ. nonribosomal peptide synthetase — «нерибосомна синтетаза пептидів»). NRP-синтетаза зазвичай складається з декількох доменів або окремих білків, що здійснюють підбір амінокислот, утворення петидного зв'язку, вивільнення синтезованого пептиду й, іноді, домен, здатний ізомерізувати L-амінокислоти (нормальна форма) в D-форму 33 Вуглеводи. Глюкоза. Сахароза Вуглеводи — органічні сполуки з емпіричною формулою Cm(H2O)n, до складу яких входять тільки Вуглець, Кисень та Водень. Вуглеводи є складовою частиною клітин усіх живих організмів. Класифікація • класифікація за здатністю до гідролізу прості вуглеводи (моносахариди, монози) - не гідролізуються; складні вуглеводи (олігосахариди, полісахариди або поліози) - здатні гідролізуватися до простих вуглеводів олігосахариди - продукти поліконденсації невеликої кількості моносахаридів, наприклад, сахароза C12H22O11. Звичайно термін олігосахариди застосовують до вуглеводів, що вміщують від двох до п'яти моносахаридних одиниць. полісахариди - продукти поліконденсації великої кількості моносахаридів (C6H10О5)n, де n>1000. Прикладом полісахаридів можуть бути крохмаль, целюлоза та інші. класифікація моносахаридів • класифікація за характером розміщення карбонільної групи альдози - моносахариди, що вміщують альдегідну групу кетози - моносахариди, що вміщують кетонну групу • класифікація за кількістю атомів Карбогену тетрози, наприклад, треоза C4H8O4 пентози, наприклад, рибоза C5H10O5 гексози, наприклад, глюкоза, фруктоза C6H12O6 відомі також гептози, октози і т.д. Альдегідоспирти і кетоспирти, що вміщують ланцюги Карбогену менші за чотири атоми до вуглеводів не відносять класифікація полісахаридів • класифікація за біологічним походженням полісахариди рослинного походження - крохмаль, целюлоза полісахариди тваринного походження - глікоген Глюко́за С6Н12О6 — важливий моносахарид; білі кристали солодкі на смак, легко розчиняються у воді. Знаходиться в соку винограду, в багатьох фруктах, а також у крові тварин і людей. М'язова робота виконується головним чином за рахунок енергії, яка виділяється при окисленні глюкози. Глюкоза отримується при гідролізі полісахаридів крохмалю і целюлози (під дією ферментів або мінеральних кислот). Використовується як засіб посиленого харчування, або як лікарська речовина, при обробці тканини. Природна кристалічна глюкоза (виноградний цукор) представляє собою циклічну альфа-формулу. При розчиненні в воді вона переходить в ланцюгову, а через неї в бета-форму; при цьому установлюється динамічна рівновага між усіма формами. Бета-форма також може бути виділена в кристалічному вигляді; у водному розчині вона утворює рівноважну систему з іншими формами. Ланцюгова форма існує лише в розчинах, причому в дуже невеликій кількості, а в вільному вигляді не виділена. Ізомерні форми сполук, які здатні переходити одна в одну називають таутомерними формами, чи таутомерами. Явище таутомерії дуже розповсюджене серед органічних сполук. Фрукто́за (плодовий цукор), С6Н12О6 — органічна речовина – вуглевод із групи моносахаридів, що міститься в солодких плодах, меді[3]; безбарвні кристали солодкого смаку (солодше сахарози в 1,5 разу і глюкози в 3 рази), t пл 102—104°С; розчина у воді. 34 Полісахариди Полісахариди — вуглеводи, які багато в чому відрізняються від моносахаридів і дисахаридів, не мають солодкого смаку і майже не розчинні в воді. Це складні високомолекулярні сполуки, які під каталітичним впливом кислот чи ферментів піддаються гідролізу з утворенням простіших полісахаридів, потім дисахаридів, і врешті-решт багато (сотні і тисячі) молекул моносахаридів. Сахароза – це безбарвна кристалічна речовина, солодка на смак, добре розчиняється у воді. При нагріванні до 190–200 °С її кристали плавляться, утворюючи карамель. Сахарозу добувають з природної сировини – цукрового буряку, цукрової тростини. 35 Крохмаль і целюлоза Целюло́за (С6Н10О5)x — полісахарид, волокниста речовина, головна складова частина оболонки рослинних клітин. Величина Х у молекулах целюлози завжди складає приблизно 3 000, але може досягати від 6 000 до 12 000. Найбільш чиста природна целюлоза — бавовняне волокно — складає 85—90 % целюлози. В деревині хвойних дерев приблизно 50 % целюлози (в склад деревини поряд з целюлозою входять її супутники, серед них важливішим є лігнін — природний полімер, побудований із декількох ароматичних сполук ряду бензолу, і геміцелюлози — споріднені з целюлозою полісахариди).Зміст [сховати] Застосування Значення целюлози дуже велике, достатньо вказати, що велика кількість бавовняного волокна йде на виробництво бавовняно-паперових тканин. З целюлози виробляють папір і картон, а шляхом хімічної переробки — цілий ряд різноманітних продуктів: штучне волокно, пластичні маси, лаки, бездимний порох, етиловий спирт. У 2000 р. було вироблено 171 млн т целюлозної пульпи і 323 млн т паперових виробів.[2] Характеристики Целюлоза не розчиняється в воді і діетиловому ефірі і етиловому спирті. Вона не розчеплюється під дією розбавлених кислот, стійка до дії лугів і слабких окисників. При обробці на холоді концентрованою сірчаною кислотою целюлоза розчиняється в ній, утворюючи в'язкий розчин. Якщо цей розчин вилити в надлишок води, виділяється білий пластевидний продукт, так званий амілоїд, що являє собою частково гідролізовану целюлозу. Він схожий з крохмалем за реакцією з йодом (синє забарвлення; целюлоза не дає цієї реакції). Якщо непроклеєний папір опустити на короткий час в концентровану сірчану кислоту і потім терміново промити, то амілоїд, що утвориться, склеїть волокна паперу, роблячи його щільнішим та міцнішим. Так виготовлюється пергаментний папір. Під дією концентрованих розчинів мінеральних кислот і підігріву целюлоза піддається гідролізу, кінцевим продуктом якого є глюкоза. Крохма́ль, лат. amylum (С6Н10О5)n — високомолекулярний полісахарид рослинного походження, що нагромаджується в результаті фотосинтезу у плодах, зерні, коренях і бульбах деяких рослин як запасна форма вуглеводів[1]. Резервний гомополісахарид рослин. Білий, хрусткий, аморфний і дуже гігроскопічний порошок без смаку і запаху. Зазвичай містить 10-20% зв'язаної води, яку можна видалити висушуванням при 100-110оС. Під мікроскопом — зернистий порошок. Нерозчинний у холодній воді, ефірі, спирті; у гарячій воді набухає, і утворює колоїдний розчин — крохмальний клейстер; із розчином йоду дає синє забарвлення. Реакція з йодом дає змогу виявити навіть мільйонну частину крохмалю в розчині.[2] Молекули крохмалю неоднакові за розмірами Крохмаль сільськогосподарських культур є провідним компонентом раціону людини, важливою сировиною для харчової, фармацевтичної та технічних галузей промисловості. Крохмаль широко застосовується в харчовій галузі як загущувач (E1404), при виробництві патоки різного вуглеводного складу, для одержання декстринів, глюкози (кристалічної глюкози, глюкозного концентрату, глюкозно-фруктозного сиропу, етанолу, та інших продуктів бродіння; як клей, як мікробіологічне середовище при одержанні різних ензимів, антибіотиків, вітамінів, а також як основа штучних біодеградабельних біополімерів. Крохмаль зі ступенем гідролізу (по глюкозі) менше 5% - мальтодекстрин - використовується в якості стабілізатора у виробництві майонезу. 36 Синтетичні високомолекулярні речовини. Полімерні матеріали. Синтетичні волокна і синтетичні каучуки, утворення гуми. Застосування полімерних матеріалів ВИСОКОМОЛЕКУЛЯРНІ СПОЛУКИ (ВМС), або полімери — сполуки з мол м. від декількох тисяч до багатьох мільйонів. До складу молекул ВМС (макромолекул) входять тисячі атомів, з’єднаних хімічним зв’язком. Будь-який атом чи група атомів, які входять до складу ланцюга полімеру, називаються складовою ланкою. Найменша складова ланка, повторюванням якої можна описати будову полімеру, називається складовою повторюваною ланкою. Назву лінійного полімеру утворюють додаванням префікса «полі»: а) до назви складової повторюваної ланки, яку пишуть у дужках (систематичні назви); б) до назви мономера, з якого одержали полімер (напівсистематичні назви, які IUPAC рекомендує використовувати для найбільш поширених полімерів). Назву складової повторюваної ланки утворюють за правилами хімічної номенклатури. Класифікація. ВМС класифікують за низкою ознак. За походженням їх поділяють на природні, або біополімери (білки, нуклеїнові кислоти, полісахариди тощо), і синтетичні (поліетилен, полістирол, полівінілхлорид та ін.). За структурою полімерного ланцюга розрізняють: 1) лінійні ВМС, макромолекули яких є відкритими лінійними ланцюгами (напр. натуральний каучук) або витягнутою у лінію послідовністю циклів (напр. целюлоза) (рис. 1а); 2) розгалужені ВМС, макромолекули яких мають лінійний ланцюг з відгалуженнями (напр. Амілопектин.3) сітчасті ВМС — тривимірні сітки, утворені відрізками ланцюгів макромолекул (напр. вулканізований каучук). Одержання. Природні ВМС, які утворюються в клітинах живих організмів у результаті біосинтезу, можуть бути виділені з рослинної та тваринної сировини за допомогою екстрагування, фракційного осадження та ін. методів. Основні шляхи одержання синтетичних ВМС — полімеризація та поліконденсація. Карбоцепні полімери синтезують полімеризацією мономерів за кратними вуглець-вуглецевими зв’язками. Гетероцепні ВМС одержують поліконденсацією, а також полімеризацією мономерів за кратними гетероатомними зв’язками типу C = O, N = C = O, C ≡ N (напр. альдегіди, ізоціанати, нітрили) або з розкриттям гетероциклічних угруповань (напр. оксидів, олефінів, лактамів). Використання. ВМС відіграють велику роль у процесах життєдіяльності, а також у різних галузях науки і техніки. Біополімери є основою всіх живих організмів і беруть участь у всіх процесах життєдіяльності. ВМС — основа пластичних мас, хімічних волокон, лаків, фарб, клеїв, герметиків, іонообмінних смол. У медицині полімери застосовують для виготовлення виробів медичної техніки (інструменти, предмети догляду за хворими, матеріали і вироби для пакування ліків), у відновній хірургії для заміни втрачених органів (протези, корпуси і деталі штучних шлуночків та стимуляторів серця, протези кровоносних судин, деталі апаратів «штучна нирка», «серце–легені», замінники кісткових тканин). Для виготовлення гуми каучук слід переробити, додавши до нього сірку. Цей процес називають вулканізацією. Одержаний матеріал є міцнішим та еластичнішим за каучук-сирець. Для більшої тривкості до гуми додають тканини або металеві дроти (у виробництві автомобільних шин). 37 Генетичний зв*язок між органічними і неорганічними речовинами. Речовинний світ природи надзвичайно різноманітний, і разом з тим усі речовини взаємозв’язані. Генетичний зв’язок між органічними і неорганічними речовинами полягає, перш за все, у тому, що органічні речовини можна добути з неорганічних. Наприклад, при нагріванні неорганічної речовини ціанату амонію N º C–O–NH4 утворюються органічна речовина сечовина (NH2)2CO Яскравим доказом існування генетичного зв’язку між органічними та неоргані
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 1243; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.219.11 (0.015 с.) |

 , кипіння
, кипіння 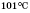 . Розчиняється у воді в будь-яких кількостях.
. Розчиняється у воді в будь-яких кількостях. (температура плавлення) кристалізується і стає схожою на лід, тому її називають«крижаною» оцтовою кислотою. Температура кипіння
(температура плавлення) кристалізується і стає схожою на лід, тому її називають«крижаною» оцтовою кислотою. Температура кипіння  . Розчиняється у воді в будь-яких кількостях: 3—9%-й розчин називається оцтом, 70—80%-й розчин — оцтовою есенцією.
. Розчиняється у воді в будь-яких кількостях: 3—9%-й розчин називається оцтом, 70—80%-й розчин — оцтовою есенцією.



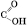 + CH3OH = CH3–
+ CH3OH = CH3–  ++ H2O
++ H2O


 ,
,  ,
,  — вуглеводневі радикали кислот.
— вуглеводневі радикали кислот.