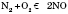Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Алотропні модифікації оксисенуСодержание книги
Поиск на нашем сайте
Застосування Застосування кисню. Кисень використовується для інтенсифікації процесів горіння (наприклад, при виплавці сталі), підвищення температури горіння (при зварюванні), як окисник в інших реакціях, у медицині. Озон має дезинфікуючу відбілюючу дію. Головне застосування озону — знезаражування водопровідної води. Застосування сірки. Сірка застосовується для одержання сульфатної кислоти, вулканізації каучуку, боротьби із сільськогосподарськими шкідниками, одержання сірників, пороху. У медицині виготовляють сірчані мазі для лікування шкірних хвороб.
24 Оксид Сульфуру (IV). Сульфур(IV) оксид (діоксид сірки, сірчистий газ, сірчистий ангідрид) — безбарвний газ із різким запахом, скраплюється при. Негорючий, легко розчиняється у воді. Водний розчин називають сульфідною кислотою. Міститься у вулканічних газах, виділяється при спалюванні природного вугілля. Є одним з основних забруднювачів повітря, викликає кислотні дощі. Отруйний, викликає кашель, задишку, бронхіт, запалення легень. Хімічні властивості
Взаємодія з основами:
Оборотна взаємодія з водою:
Взаємодія з основними оксидами:
Застосування сульфур(IV) оксиду. Основна маса сульфур(IV) оксиду витрачається на виробництво сульфатної кислоти та інших сполук Сульфуру. Використовується для відбілювання паперу, соломи і вовни. На відміну від необоротної дії білильного вапна, знебарвлення сульфур(IV) оксидом часто оборотне, і забарвлення повертається після промивання. Використовується як дезінфікуючий засіб, наприклад для обробки підвалів, овочесховищ.
25 Сульфур(VI) оксид Сульфур(VI) оксид (сірчаний газ, ангідрид сульфатної кислоти) при кімнатній температурі — безбарвна рідина, температура кипіння. Негорючий. Добре розчиняється у воді, взаємодіючи з нею. Гігроскопічний. Токсичний, уражає дихальні шляхи, викликає опіки шкіри.
Хімічні властивості сульфур(VI) оксиду З’єднуючись із водою, утворює сульфатну кислоту:
Добре розчиняється в сульфатній кислоті, утворюючи важку маслянисту рідину — олеум
Як типовий кислотний оксид взаємодіє з оксидами, утвореними металами:
з основами:
Застосування сульфур(VI) оксиду Сульфур(VI) оксид застосовується в основному у виробництві сульфатної кислоти; у лабораторії як водовід’ємний засіб. 26 Сульфатна кислота. Сульфатна кислота — сполука сірки з формулою H2SO4.Безбарвна масляниста,дуже в'язка і гігроскопічна рідина.Сірчана кислота одна з найсильніших неорганічних кислот і є дуже їдкою. Фізичні властивості Хімічно чиста сульфатна кислота являє собою важку безбарвну маслянисту рідину. Продається звичайно її 96,5% — ний водний розчин густиною 1,84 г/см3 або так званий «олеум», тобто розчин SO3 в H2SO4. У воді H2SO4 розчиняється дуже добре (змішується з водою в необмежених кількостях). Хімічні властивості Взаємодія з розчинними і нерозчинними основами
Взаємодія з металами, що розташовані в електрохімічному ряді напруг до Гідрогену:
Взаємодія з оксидами металів:
Взаємодія із солями, утвореними більш слабкими і/або леткими кислотами:
Застосування сульфатної кислоти Сульфатна кислота використовується у виробництві неорганічних кислот, лугів, солей, мінеральних добрив, вибухових речовин, штучних волокон, барвників, пластмас і багатьох інших речовин. Найбільша кількість її витрачається для одержання фосфатних і нітратних добрив. Сульфатну кислоту використовують для одержання інших кислот — хлоридної, флуороводневої, фосфатної, оцтової. Вона застосовується для очищення нафтопродуктів. Якісна реакція Реактивом для виявлення сульфат-іонів є розчини, що містять йони Барію:
27 Нітроген. Будова молекул Нітроге́н — хімічний елемент V групи періодичної системи з атомним порядковим номером 7 та атомною масою 14.008. Два атоми нітрогену, об'єднюючись складають молекулу хімічної речовини азоту. Фізичні властивості Азот — безбарвний газ без запаху і смаку. Кипить при температурі −195,8 °C, замерзає при −209,86 °C. Азот не підтримує ні дихання, ні горіння. У воді розчиняється мало. Його розчинність при 20 °C становить 1,54 см3 на 100 г води (кисню — 3,1 см3). Тому розчинене у воді повітря багатше на кисень, ніж атмосферне. Хімічні властивості Взаємодія з металами
Взаємодія з неметалами
За дуже високих температур азот реагує з киснем:
Добування У лабораторних умовах чистий азот зазвичай одержують шляхом розкладу при нагріванні розчину нітриту амонію за реакцією: NH4NO2 = N2↑ + 2H2O У промисловості азот у великих кількостях добувають з повітря за допомогою азотних станцій. Ще один з лабораторних способів — пропускання аміаку над оксидом міді (II) при температурі ~700°C: 2NH3 + 3CuO → N2↑ + 3H2O + 3Cu Будова молекули Застосування Рідкий азот застосовується як холодоагент і для кріотерапії. Промислові застосування газоподібного азоту обумовлені його інертними властивостями. Газоподібний азот пожежо- і вибухобезпечний, перешкоджає окисленню, гниттю. У нафтохімії азот застосовується для продування резервуарів і трубопроводів, перевірки роботи трубопроводів під тиском, збільшення вироблення родовищ. У гірничодобувній справі азот може використовуватися для створення в шахтах вибухобезпечного середовища, для розпирання пластів породи. У виробництві електроніки азот застосовується для продування областей, не допускають наявності окисляє кисню. Якщо в процесі, традиційно проходить з використанням повітря, окислення або гниття є негативними факторами — азот може успішно замістити повітря.Велика частина одержуваного в техніці азоту застосовується на виробництво аміаку.Останнього часу значного розповсюдження набуло використання азоту для створення інертного середовища при проведенні деяких хімічних реакцій, при перекачуванні горючих рідин тощо. Кругообіг нітрогену
28 Амоніак. Солі амонію. Якісна реакція. Амоніак – безбарвний газ з різким запахом. При температурі, нижчій за –33,4ОС, він переходить у рідкий стан. Добування У техніці головним способом добування аміаку є прямий синтез його з азоту і водню за реакцією:
Хімічні властивості Горіння аміаку 4NH3 + 302 ⇔ 2N2 + 6H20 Взаємодія з водою. H2O ⇔ H+ + OH- Взаємодія з кислотами. NH3 + НСl = NH4Cl Солі амонію - це кристалічні речовини з іонним типом зв'язку. До складу солей амонію входять один або кілька катіонів і аніон кислотного залишку. Солі амонію утворюються при взаємодії відповідних кислот з амоніаком або розчином гідроксиду амонію. Більшість солей амонію безбарвні. При взаємодії з сильними основами і нагріванні солі амонію легко розкладаються з утворенням амоніаку. В термічному відношенні солі амонію нестійкі і при нагріванні порівняно легко розкладаються. Якісна реакція на амоній NH4Cl + NaOH = NaCl + NH3 + H2O (виділення аміаку) 29 Оксиди нітрогену (II), (IV).
30 Нітратна кислота. Нітрати. Нітратні добрива. Якісна реакція. Фізичні властивості Нітратна кислота являє собою безбарвну димучу рідину з їдким запахом, легко розкладається, забарвлюючись у жовтий колір. Густина 1,53 г/см³. Кипить при 86°С, замерзає при — 41°С. На повітрі HNO3 «димить» внаслідок притягання її парами вологого повітря і утворення дрібненьких крапельок туману. Нітратна кислота нестійка і вже під впливом сонячного світла поступово розкладається: 4HNO3 = 4NO2 + O2 + 2H2O При нагріванні розклад її значно прискорюється. Утворюваний діоксид азоту розчиняється в HNO3 і надає їй жовтуватого кольору. У водних розчинах нітратна кислота значно стійкіша. З водою HNO3 змішується в будь-яких співвідношеннях. Нітратна кислота належить до сильних кислот, у водних розчинах вона практично повністю дисоціює:
У продаж нітратна кислота звичайно поступає у вигляді 68%-ного розчину з густиною 1,4 г/см³. Хімічні властивості Кислотні властивості (дія на індикатори) З кислотними оксидами Na 2O + HNO3 = NaNO3 + H 2O CuO + HNO3 = Cu(NO 3) 2 + H 2O З основами Na 2CO3 + HNO3 = NaNO3 + H 2CO3 при дії концентрованої нітратної кислоти на мідь утворюється нітрат міді, діоксид азоту і вода: Cu + 4HNO3 = Cu(NO3)2 + 2NO2↑ + 2H2O Застосування Нітратна кислота є одним з найважливіших продуктів хімічної промисловості. Вона виробляється у дуже великих кількостях, використовується для виробництва азотних добрив, у кольоровій металургії для розділення металів, а також хімічній промисловості для виробництва пластмас, вибухових речовин, целулоїду і фотокіноплівки, штучного волокна, органічних барвників, лікувальних речовин тощо. Нітрати — безбарвні кристалічні речовини, солі і ефіри азотної кислоти HNO3. Вони утворюються при взаємодії нітратної кислоти з відповідними металами, або їх оксидами та гідроксидами. У воді нітрати добре розчиняються. Природні солі мають кристалічну острівну будову. Виникають виключно при екзогенних процесах, часто внаслідок гниття органічних решток. Можливе також утворення азотистих сполук з азоту повітря під час громових розрядів. Застосовують як добрива, протрави при фарбуванні, компоненти вибухових речовин. Н. амонію, лужних та лужноземельних металів називають селітрами. Ефіри – безбарвні або світло-жовті, приємні на запах рідини. Містять у молекулі одну або декілька ONO2-груп, пов’язаних з органічним радикалом. Деякі ефіри (нітрогліцерин) застосовують як вибухові речовини (див. нітрогліцеринові ВР). При сильному нагріванні нітрати розкладаються, не плавлячись. Виняток становлять лише нітрат натрію і нітрат калію, які спочатку плавляться, а потім уже розкладаються. При цьому продукти розкладу нітратів залежать від активності металу, що входить до складу солі. Азо́тні до́брива — азотовмісні речовини, які вносять у ґрунт з метою підвищення врожайності с.-г. культур. Важливим джерелом азотних речовин для рослин є гній, сеча тварин, торф, пташиний послід, зелене добриво, компости, відходи сільського господарства і м'ясо-рибної промисловості та ін. (див. Органічні добрива). Особливо великого значення набули мінеральні азотні добрива. Вони містять азот в нітратній, аміачній, нітратно-аміачній і рідше в амідній формі. Аміачні добрива краще вбираються ґрунтом, через це вони більш придатні для завчасного внесення. Норми внесення А. д. залежать від ґрунтово-кліматич. умов, біологіч. особливостей культур і способу внесення добрив. Як мінеральні азотні добрива застосовують такі речовини: Нітрат калію KNO3 (калійна селітра) являє собою безбарвну кристалічну речовину. На вологому повітрі не мокріє і не злежується. Нітрат калію — дуже цінне мінеральне добриво, в якому міститься два поживних для рослин елементи — азот і калій. Однак за агрохімічними вимогами вміст азоту в азотнокалійових добривах повинен бути більшим, ніж в KNO3. Тому нітрат калію застосовують переважно в суміші з амонійними солями. Нітрат амонію NH4NO3 (амонійна селітра) дуже багате на азот добриво. Але нітрат амонію має істотний недолік — на вологому повітрі він мокріє, а при висиханні утворює тверді куски. Цілком сухий нітрат амонію може вибухати. Тому його застосовують як добриво в суміші з сульфатом амонію. Така суміш на повітрі не мокріє; не злежується і являє собою дуже цінне добриво, особливо під цукрові буряки, картоплю та інші культури. Нітрат кальцію Ca(NO3)2 (кальцієва, або норвезька, селітра) — теж цінне азотне добриво. Його виробляють у великих кількостях нейтралізацією нітратної кислоти вапном. Цінність нітрату кальцію як добрива полягає також у тому, що іони кальцію Ca2+ позитивно впливають на структуру ґрунту. Нітрат натрію NaNO3 (чилійська селітра) являє собою єдину сіль нітратної кислоти, яка утворює потужні природні родовища (в Чилі). В багатьох країнах чилійська селітра широко використовується як мінеральне добриво. Сульфат амонію (NH4)2SO4 — одне з найстаріших азотних добрив. Його добувають у великих кількостях нейтралізацією сульфатної кислоти аміаком. Сульфат амонію не гігроскопічний і не злежується. Він значно підвищує врожайність таких культур, як жито, пшениця, картопля і особливо чай і рис. Хлорид амонію NH4Cl одержують нейтралізацією хлоридної кислоти аміаком. Він теж не гігроскопічний і не злежується. Але на відміну від сульфату амонію його не вносять під такі культури, як цукрові буряки, тютюн тощо, оскільки іони хлору на ці культури впливають негативно. Рідкий аміак і аміачна вода є найбагатшими добривами за вмістом азоту. Рідкий аміак, як і аміачну воду, стали застосовувати як азотні добрива лише останнім часом, коли були розроблені методи внесення в ґрунт добрив у рідкому стані. Якісна реакція 31 Фосфор. Алотропні модифікації. Фо́сфор (P) - хімічний елемент 5-ї групи третього періоду періодичної системи; має атомний номер 15. Один з поширених елементів земної кори: його вміст становить 0,08-0,09% її маси. Концентрація в морській воді 0,07 мг / л. У вільному стані не зустрічається через високу хімічну активність. Утворює близько 190 мінералів, найважливішими з яких є апатит Ca 5 (PO 4) 3 (F, Cl, OH), фосфорит та інші. Фосфор міститься у всіх частинах зелених рослин, ще більше його в плодах і насінні (див. фосфоліпіди). Міститься в тваринних тканинах, входить до складу білків та інших найважливіших органічних сполук (АТФ, ДНК), є елементом життя. Хімічні властивості 1) Взаємодія з простими речовинами. Взаємодія з галогенами: 2 P + 3 Cl2 = 2 PCl3 PCl3 + Cl2 = PCl5 Взаємодія з нематаллами: 2P + 3S = P2 S3 Взаємодія з металами: 2 P + 3 Ca = Ca3 P2 Взаємодія з киснем: 4 P + 5 O2 = 2 P2 O5 2) Взаємодія зі складними речовинами. 3P + 5HNO3 + 2H2 O = 3H3 PO4 + 5NO ↑. Добування У вільному стані фосфор одержують шляхом відновлення фосфату кальцію вугіллям в присутності діоксиду кремнію Са3(PO4)2 + 3SiO2 = 3CaSiO3 + P2O5 P2O5 + 5C = 2P + 5CO↑ Процес відновлення проводять у спеціальних електричних печах при температурі близько 1500°С. Діоксид кремнію (пісок) додається для зниження температури реакції, витиснення фосфатного ангідриду з фосфату кальцію і видалення з печі твердих продуктів у вигляді розплавленого шлаку CaSiO3. Одержуваний фосфор виділяється в пароподібному стані, який потім охолоджують і збирають у приймачі з водою.
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 1371; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.141.201 (0.008 с.) |





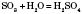







 (білий осад)
(білий осад)