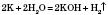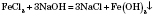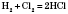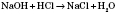Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Зв’язок хімії з іншими природничими наукамиСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Хімія тісно пов’язана з іншими природознавчими науками. Вна інтегрується з фізикою, біологією, геологією та іншими. На цій основі виникли біохімія та молекулярна біологія, геохімія, космохімія та інші. 2 Роль хімії в народному господарстві, медицині. Хімія та екологія. Роль хімії в народному господарстві, медицині Випускається широкий асортимент засобів особистої гігієни і парфумерно-косметичних препаратів, засобів боротьби з комахами та по догляду за автомобілем, плямовивідні засоби і багато іншого. У цієї галузі здійснюються науково дослідні роботи, і асортимент товарів побутової хімії постійно розширюється. У побуті ми практично щоденно зустрічаємося з продуктами хімічної промисловості та з хім. Процесами. Це прання білизни, миття посуду, готування їжі тощо Хімія і екологія Бурхливий розвиток промисловості, в тому числі хімічно, створив серйозну проблему: необхідність зменшити її негативний вплив на довкілля. Екологія тісно пов’язана з хімією. Джерела забруднення середовища можуть бути газуватими, рідкими і твердими. Газуваті відходи виробництва утворюються під час згоряння палива, виплавки металів та інших процесів. Газуваті відходи містять СО2 ,СО,SO2. Рідкими джерелами є промислові та побутові стічні води, вони містять іони таких металів, як меркурій, цинк, кадмій, купрум, нікол, хром та інші. Вони з’являються у питній воді та їжі людини і тварин. Можуть спричинити глибокі генетичні зміни в організмі призвести до отруєння і навіть смерті. Тверді відходи – різні відходи, що неможливо переробити, порожня порода – відходи гірничодобувної промисловості, будівельне і побутове сміття тощо. 3 Основні поняття і закони в хімії. Хімічні та фізичні явища. Атомна і молекулярна маса. Основні поняття і закони в хімії А́том — найменша частинка хімічного елемента, яка зберігає всі його хімічні властивості. Атом складається з щільного ядра з позитивно заряджених протонів та електрично нейтральних нейтронів, яке оточене набагато більшою хмарою негативно заряджених електронів. Моле́кула — здатна до самостійного існування частинка простої або складної речовини, що має її основні хімічні властивості, які визначаються її складом та будовою. Хімічний елемент — тип (вид, сорт) атомів з однаковим зарядом атомних ядер. Прості́ речови́ни — речовини, молекули яких складаються з атомів одного і того самого хімічного елементу. Складні речовини - речовини, молекули яких складаються з атомів різних хімічних елементів. Моль — одиниця кількості речовини в системі СІ Хімічні та фізичні явища Фізичні явища Явища, при яких речовини не перетворюються в інші, змінюється тільки їхній агрегатний стан. Приклади: плавлення парафіну, кипіння й випар води, танення снігу. Хімічні явища Явища, при яких з даних речовин утвориться одне або кілька нових речовин. Приклади: обвуглювання крохмалю, горіння деревини, іржавіння заліза, скисання молока, гниття листів. Атомна і молекулярна маса Це маса атомів і молекул виражене в атомних одиницях маси. Її обчислюють так само, як і відносну атомну масу, і чисельно ці величини рівні. 4 Хімічні формули, рівняння. Моль – одиниця кількості речовини. Хімі́чна фо́рмула — скорочене позначення складу молекул речовини за допомогою хімічних символів. Хімічне рівняння — це скорочений запис хімічної реакції хімічними символами елементів і хімічними формулами речовин. Моль — одиниця кількості речовини в системі СІ 5 Валентність та ступінь окиснення. Валентністю називають число одинарних зв’язків, які атом утворює з іншими атомами в молекулі. Ступінь окиснення елемента — це умовний заряд атома в речовині, обчислений із припущенням, що вона складається з іонів. Ступінь окиснення характеризує число умовно прийнятих або умовно відданих електронів. Ступінь окиснення може бути позитивним (якщо атом віддав електрони), негативним (якщо атом прийняв електрони) або дорівнювати нулю. 6 Закон Авогадро, закон збереження маси, закон сталості складу, закон еквівалентів, закон кратних відношень. Зако́н А́вогадро — однакові об'єми будь-яких газів при однаковому тиску і температурі містять однакову кількість молекул. Закон збереження маси речовини – маса речовин, що вступають у реакцію дорівнює масі речовин, що утворюються внаслідок цієї реакції. Зако́н ста́лості складу - кожна хімічна сполука завжди має один і той самий склад. Закон еквівалентів — маси речовин, які вступають у реакцію та утворюються після неї, пропорційні їхнім еквівалентам.
Закон кратних відношень – якщо два елементи, що реагують між собою, утворюють декілька сполук, то різні масові кількості одного елемента, що сполучаються з однією і тією ж масовою кількістю другого, відносяться як невеликі цілі числа. 7 Періодичний закон та періодична система елементів Д.І. Мендєлєєва, структура періодичного хімічних елементів. Значення періодичного закону. Формулювання Періодичного закону: Фізичні й хімічні властивості елементів, що виявляються у властивостях простих іскладних тіл, перебувають у періодичній залежності від їх атомної маси. Графічним зображенням Періодичного закону Д. І. Менделєєва є Періодична система хімічних елементів. Періоди — це горизонтальні ряди в таблиці Менделєєва. Періодів усього сім. Періоди поділяються на малі, що складаються з одного ряду (1—3 періоди), і великі, що складаються з двох рядів (4—7 періоди). У періодах добре помітна періодичність зміни властивостей елементів, простих речовин, утворених цими елементами, та їх сполук. У періодах із зростанням порядкового номера елементів їх металічні властивості слабшають, а неметалічні посилюються. Група — це вертикальний стовпчик у таблиці Менделєєва, у якому розміщені подібні за властивостями хімічні елементи. У короткоперіодному варіанті Періодичної системи кожна група поділяється на підгрупи — головну (або А) і побічну (або Б). До складу головної підгрупи входять елементи великих і малих періодів, а до складу побічних підгруп — тільки великих періодів і лише метали. У групах у головних підгрупах виявляється подібність елементів (наприклад однакова вища валентність) та їхніх сполук (наприклад загальні формули вищих оксидів і водневих сполук). У групах із зростанням порядкового номера металічні властивості елементів посилюються, а неметалічні послаблюються. Сучасне формулювання періодичного закону: Властивості хімічних елементів, а також форми й властивості сполук елементів перебувають у періодичній залежності від заряду ядер їхніх атомів. Значення періодичного закону: Періодичний закон Д. І. Менделєєва — один із найфундаментальніших і найзагальніших законів природи, якому підпорядковані всі хімічні елементи Всесвіту. Адже з хімічних елементів складається вся жива і нежива природа. Отже, періодичний закон — це не тільки основний закон хімії, а й основний закон природи. Його відкриття справило величезний вплив на розвиток хімії та фізики і не втратило свого значення й досі. Періодичний закон хімічних елементів — один з основних законів природи. Після його створення природознавство пережило наукову революцію, було розроблено нові теорії (будови речовини, відносності, квантової механіки), знайдено нові елементи, але ці відкриття не тільки не зруйнували періодичний закон і періодичну систему, а й розвинули їх, надали їм нового змісту, затвердили їх фундаментальність 8 Будова атома: ядро, енергетичні рівні. Електронні конфігурації атомів елементів в основному та збудженому стані. Атоми складаються із елементарних частинок (протонів, електронів, та нейтронів). Маса атома в основному зосереджена в ядрі, тому більша частина об'єму відносно порожня. Ядро оточене електронами. Кількість електронів дорівнює кількості протонів у ядрі, кількість протонів визначає порядковий номер елемента в періодичній системі. У нейтральному атомі сумарний негативний заряд електронів дорівнює позитивному зарядові протонів. Атоми одного елемента з різною кількістю нейтронів називаються ізотопами. Ядро оточене електронною хмарою, яка займає більшу частину його об'єму. В електронній хмарі можна виділити оболонки, для кожних з яких існує кілька можливих орбіталей. Заповнені орбіталі складають електронну конфігурацію, властиву для кожного хімічного елемента. Електро́нна конфігура́ція — формула розташування електронів на різних електронних оболонках атома хімічного елемента. Стан із найменшою енергією називається основним станом. Інші стани називаються збудженими. Атом перебуває в збудженому стані скінченний час, випромінюючи рано чи пізно квант електромагнітного поля (фотон) і переходячи в основний стан. В основному стані атом може перебувати довго. Щоб збудитися, йому потрібна зовнішня енергія, яка може надійти до нього тільки із зовнішнього середовища. Атом випромінює чи поглинає світло лише певних частот, які відповідають різниці енергій його станів. 9 Енергія іонізації. Енергія спорідненості до електрона. Електронегативність. Енéргія іонізáціі — найменша енергія потрібна для того, щоб вирвати електрон із фізичної системи й віднести його на нескінченну віддаль. Спорі́дненість до електро́на — енергія, необхідна для того, щоб забрати електрон у однократно від'ємно зарядженого іона. Така ж енергія виділяється при захопленні електрона нейтральним атомом чи молекулою. Здатність атома притягувати валентні електрони інших атомів називають електор негативністю. 10 Типи хімічних зв*язків. Типи хімічних зв’язків: Ковалентний зв'язок є формою хімічного зв'язку, характерною особливістю якого є те, що задіяні атоми поділяють одну чи більше спільних пар електронів, що і спричиняють їх взаємне притяжіння, яке утримує їх у молекулі _ При взаємодії атомів з однаковою електронегативністю утворяться молекули з ковалентним неполярним зв'язком. _ Ковалентний полярний зв'язок -при взаємодії атомів, значення електронегативностей яких відрізняються, але не різко, відбувається зміщення загальної електронної пари до більш електронегативного атома. Йо́нний зв'язо́к — це тип зв'язку, при якому електрони переходять із одного атома до іншого, й основний вклад в притягання вноситься електростатичною взаємодією. Металі́чний зв'язо́к — тип хімічного зв'язку, при якому валентні електрони атомів делокалізуються і починають взаємодіяти з атомними остовами усього тіла. Водне́вий зв'язо́к — різновид хімічного зв'язку, що реалізується за донорно-акцепторним механізмом між двома ковалентно зв'язаними атомами з великим значенням електронегативності (О, N, F) за посередництвом атома Гідрогену Н. 11 Типи хімічних реакцій. Типи кристалічних граток. Оборотні реакції – це такі хімічні реакції, які одночасно протікають і в прямому, і у зворотному напрямах. Необоро́тні реа́кції — реакції, при яких узяті речовини без остачі перетворюються на продукти реакції, що не реагують між собою за даних умов, наприклад, розкладання вибухових речовин, горіння вуглеводнів, утворення малодисоціюючих з'єднань, випадання осаду, утворення газоподібних речовин. -реакції сполучення — реакція, під час якої з двох або кількох речовин утворюється одна нова речовина. - реакції розкладу — реакція, під час якої з однієї речовини утворюється дві або кілька нових речовин. - реакції заміщення — реакція між простою і складною речовинами, у процесі якої атоми простої речовини заміщують атоми одного з елементів у складній речовині, внаслідок чого утворюються нова проста і нова складна речовини. - реакції обміну — реакція, у процесі якої дві складні речовини обмінюються своїми складовими частинами. Кристалічні гратки: Йонні кристалічні гратки характерні для сполук з іонним типом хімічного зв’язку. У вузлах таких граток знаходяться протилежно заряджені йони. Сили міжіонної взаємодії є досить значними, тому речовини з таким типом кристалічної гратки є нелеткими, твердими, тугоплавкими, їх розчини та розплави проводять електричний струм. Атомні кристалічні гратки характерні для сполук із ковалентним типом хімічного зв’язку. У вузлах таких граток знаходяться окремі атоми, зв’язані ковалентними зв’язками. Усі зв’язки є рівноцінними та міцними, тому речовини з таким типом кристалічної гратки характеризуються великою твердістю, високими температурами плавлення, хімічною інертністю. Молекулярні кристалічні гратки характерні для сполук із ковалентним типом хімічного зв’язку. У вузлах таких граток знаходяться неполярні або полярні молекули. Унаслідок слабких сил взаємодії речовини з таким типом кристалічної гратки мають незначну твердість, низькі температури плавлення та кипіння, характеризуються леткістю. 12 Оксиди. Окси́д — бінарна сполука, до складу якої входить Оксиген. Класифікація: - Основні оксиди - це оксиди, яким відповідають основи - До кислотних оксидів відносять такі оксиди, які взаємодіють з основними та амфотерними оксидами, а також з їх гідроксидами з утворенням солей. - Амфотерними називають такі оксиди, які взаємодіють як з кислотами, так і з основами, утворюючи сіль і воду. - Несолетвірні називають такі оксиди, які не взаємодіють ні з кислотами, ні з основами і солей не утворюють. Номенклатура: Назви оксидів утворюються так: СО – карбону (ІІ) оксид; СО2 – карбону (IV) оксид; FeO – феруму (ІІ) оксид; Al2O3 – алюмінію оксид. Якщо елемент утрвоює кілька оксидів, то в їх назвах зазначається ступінь окислення елемента римською цифрою в дужках. Існують сполуки елементів з оксигеном, які лише формально належать до класу оксидів. До них належать пероксиди. Їх розглядають як солі пероксиду гідрогену Н2О2-1. Способи добування оксидів. Горіння простих і складних речовин: - СН4 + 2О2=СО2 + 2Н2О Розклад під час нагрівання складних оксигеновмісних сполук: солей, гідроксидів, кислот: -СаСО3=CaO + CO2 Взаємодія металів з кислотами – окисниками: - 3Сu + 8HNO3= 3Cu (NO3)2 + 2NO2 + 4H2O Окислення нищих оксидів і розкладання вищих оксидів: - 2NO + O2=2NO2 Фізичні властивості Всі основні і амфотерні властивості речовини, без запаху. Вони можуть мати різне забарвлення. ZnO, MgO – білий, CuO – чорний, Cr2O3 – зелений, Al2O3 – червоний або синій (рубін і сапфір) і ін.Твердими є деякі кислотні оксиди: P2O5 SiO2 і ін.Газоподібними кислотними оксидами є CO2 SO2 і ін. Хімічні властивості Основні оксиди 1.Взаємодіють (реагують) з водою: тільки оксиди активних металів (Na, K, Ca, Ba і т.д.) При цьому утворюються розчинні основи (луги).
СаО + Н2О = Са (ОН)2 Na2O + H2O =2NaOH
2.Взаємодіють з кислотами СuO + H2SO4 =CuSO4 + H2O 3.Взаємодіють між собою
СaO + SiO2 =CaSiO3 CaO + CO2 = CaCO3 Кислотні оксиди 1.Не всі кислотні оксиди взаємодіють з водою. SiO2 і деякі інші з водою не реагують.
SO3 + H2O =H2SO4 P2O5 + 3H2O = 2H3PO4
2. Взаємодіють з основами
CO2 + Ca (OH)2 = CaCO3 + H2O
Амфотерні оксиди
1. Взаємодіють з кислотами:
ZnO + 2HCl = ZnCl2 + H2O
2.Взаємодіють з лугами:
ZnO + 2NaOH +H2O = Na2 [Zn (OH)4] Zn + 2NaOH =Na2ZnO2 + H2O Застосування
13 Основи. Основи — складні речовини, до складу яких входять атом металу й одна або кілька гідроксильних груп.
Класифікація Основи класифікуються за розчинністю у воді: - на розчинні, або луги, — добуті лужними або лужноземельними металами: Li, Na, K, Rb, Cs, Ba, Sr, Ca; - нерозчинні — всі інші основи.
Номенклатура Назви основ утворюються від назви відповідного металу в називному відмінку і слова «гідроксид»:
NaOH — натрій гідроксид;
Fe2O2 — ферум(ІІ) гідроксид;
Fe2O3 — ферум(ІІІ) гідроксид.
Застосовуються й інші традиційні назви:
NaOH — їдкий натр;
Ca(OH)2 — гашене вапно.
Способи добування основ 1) Луги добувають: — взаємодією води з лужними або лужноземельними металами:
— взаємодією води з оксидами лужних і лужноземельних металів:
BaO + 2H2O = Ba(OH)2 2) Нерозчинні основи добувають унаслідок взаємодії розчинних солей з лугами:
Фізичні властивості
За нормальних умов усі луги — тверді речовини білого кольору, милкі на дотик, їдкі, роз’їдають шкіру, тканини, папір. Нерозчинні основи — тверді речовини різного кольору. Хімічні властивості
1) Луги мають такі хімічні властивості: — змінюють забарвлення індикаторів: фенолфталеїну без кольору на малинове, метилового оранжевого на жовте, фіолетового лакмусу на синє, універсального індикаторного паперу на синє; взаємодіють із кислотними оксидами:
— взаємодіють із кислотами:
— реагують із солями:
2) Нерозчинні основи мають такі хімічні властивості: — не змінюють забарвлення індикаторів; — практично не взаємодіють із кислотними оксидами; — взаємодіють із кислотами:
— розкладаються при нагріванні:
Реакція взаємодії кислот з основами називається реакцією нейтралізації і належить до реакцій обміну. Застосування Використовують здебільшого NaOH, CaOH. Здебільшого використовують СаОН – гашене вапно. Використовується в виготовлені будівельних сумішей. Вапняним молоком навесні підбілюють дерева. КОН – в цукровій промисловості для виготовлення зубних паст. NaOH – в виробництві ліків, мила.
14 Кислоти. Кислоти — це складні речовини, що складаються з одного чи декількох атомів Гідрогену та кислотного залишку.
Класифікація - за силою (сильні, слабкі, середні); - за основністю За наявністю атомів Оксигену кислоти поділяють на оксигеновмісні (H2SO3, H2SiO3) та безоксигенові (HCl, H2S) За основністю кислоти поділяють на одноосновні (HCl, HNO3), двоосновні (H2SO4, H2CO3) та триосновні (H3PO4). Номенклатура · хлоридна кислота HCl;
· сульфатна кислота H2SO4;
· сульфітна кислота H2SO3;
· сульфідна кислота H2S;
· нітратна кислота HNO3;
· ортофосфатна кислота H3PO4;
· карбонатна кислота H2CO3;
· силікатна кислота H2SiO3. Способи добування 1) Оксигеновмісні розчинні у воді кислоти можна добути взаємодією оксидів з водою:
2) Оксигеновмисні нерозчинні у воді кислоти добувають взаємодією відповідної солі з більш сильною кислотою:
3) Безкисневі кислоти добувають взаємодією водню з неметалом:
з наступним розчиненням продукту реакції у воді. Фізичні властивості
Більшість кислот — рідини, але є і тверді кислоти, наприклад ортофосфатна і метафосфатна, силікатна. Усі кислоти важчі за воду й у більшості випадків добре в ній розчиняються. Деякі леткі кислоти (хлоридна, нітратна) мають характерний запах. Майже всі кислоти безбарвні. Хімічні властивості 1) Дія на індикатори. Речовини, які змінюють своє забарвлення під дією кислот або лугів, називаються індикаторами. 2) Взаємодія з металами. Метали, що стоять у ряді напруг до Гідрогену, витісняють його з розведених кислот (крім нітратної кислоти):
2) Кислоти реагують з оксидами, що утворені металами:
3) Кислоти реагують з основами:
Застосування Кислоти є одними з найважливіших речовин. Найбільшу увагу приділяють сульфатній. Нітратній, хлорид ній, фосфатній. Сульфатну кислоту використовують у всіх галузях народного господарства. Без кислот неможливо виготовляти папір, тканини, метали. мінеральні добрива. Сульфатну кислоту використовують у пробці нафти і виробництві кольорових металів. Хімічних засобів. Також використовують у харчовій промисловості. 15 Солі. Солі — це складні речовини, утворені атомами металів і кислотними залишками. Класифікація Назви солей складаються з назви металу і назви кислотного залишку. Добування Реакція нейтралізації: КОН + HNО3 = KNО3 + Н2О Взаємодія кислот з основними оксидами: CuO + H2SО4 = CuSO4 + Н2О Взаємодія кислот із солями: ВаСl2 + H2S04 = BaS04↓ + 2НСl Взаємодія кислот з металами: Mg + 2HCl = MgCl2 + H2↑ Взаємодія двох різних солей: AgNО3 + КСl = AgCl↓ + KNО3 Взаємодія солей з металами: Fe + CuSO4 = FeSО4 + Cu Взаємодія солей з лугами: ЗКОН + FeCl3 = Fe(OH)3↓ + ЗКСl Взаємодія лугів з кислотними оксидами: Са(ОН)2 + СО2 = СаСО3 + Н2О Взаємодія основних оксидів з кислотними: СаО + SiО2 = CaSiО3 Взаємодія металів із неметалами: Fe + S = FeS
Номенклатура
Фізичні властивості солей За нормальних умов усі солі — тверді кристалічні речовини різного кольору. Розчинність їх у воді різна.
Хімічні властивості 1. Солі можуть взаємодіяти з кислотами лише в тому випадку, коли реагуюча кислота сильніша за ту, від якої походить дана сіль: FeS + 2HCl = FeCl2 + H2S ↑ Na2SiO3 + Н2SO4 = Na2SO4 + H2SiO3 ↓ 2. Солі можуть взаємодіяти з лугами, коли внаслідок реакції утворюється нерозчинна основа або нерозчинна сіль: FeCl3 + 3NaOH = 2NaCl + Fe(OH)3 ↓ K2CO3 + Ba(OH)2 = 2KOH + BaCO3 ↓
3. Розчини солей можуть взаємодіяти з металами, коли даний метал в електрохімічному ряду напруги стоїть лівіше від металу солі: CuSO4 + Fe = FeSO4 + Cu HgCl2 + Cu = CuCl2 + Hg
4. Багато солей у розчинах можуть взаємодіяти одна з одною, коли одна із солей, що утворюється внаслідок реакції, є нерозчинною: Na2CO3 + CaCl2 = 2NaCl + CaCO3 ↓ FeSO4 + BaCl2 = FeCl2 + BaSO4 ↓
Застосування
Натрій хлорид незамінний для приготування їжі. Натрій карбонат. Як кальциновану соду (вона є ефективним засобом для прання білизни). Калій карбонат також використовують у пранні. Натрій сульфат – використовують для виготовлення скла.
16 Загальна характеристика неметалів. Положення їх у періодичній системі, будова атомів і молекул, поширення в природі. Неметали – прості речовини, які не мають властивостей металів, а саме: металічного блиску, непридатні для кування, погано проводять тепло, електричний струм. За електронною будовою зовнішнього енергетичного рівня атомів більшість неметалічних елементів є р-елементи, а Гідроген і Гелій - s-елементами. На зовнішньому енергетичному рівні мають від 4 до 8 електронів. У хімічних реакціях атоми неметалів, як правило, приєднуютьелектрони і перетворюються на негативно заряджені йони - аніони. Неметалічний характер елементів і хімічна активність неметалів посилюються в періодах зліва направо, а в головних підгрупах - знизу догори. До неметалів зараховують 22 хімічних елементи: водень (гідроґен), азот, арсен, силіцій, кисень (оксиґен), флуор, хлор, інертні гази, бром, карбон, фосфор, сульфур, селен, йод, астат, телур, бор. Типові оксиди неметалів є ангідридами. Різкої межі між металами, металоїдами та неметалами немає. Частина неметалів має атомну будову. Із окремих атомів складаються інертні гази - гелій, неон, аргон, криптон, ксенон і радон. У графіті, алмазі, силіції, борі, червоному фосфорі всі атоми сполучені один з одним. Водень, азот, кисень, фтор, хлор, бром, йод мають двохатомні молекули. Більшу кількість атомів містять молекули озону О3, білого фосфору Р4, сірки S8, фулерену С60. Атоми в неметалах сполучені ковалентними неполярними зв'язками.
17 Реакції йонного обміну. Йонний обмін - це оборотна хімічна реакція, при якій відбувається обмін іонами між твердою речовиною і розчином електроліту. Йонний обмін може відбуватися як в гомогенному середовищі (істинний розчин декількох електролітів), так і в гетерогенному, в якому один з електролітів є твердим (при контакті розчину електроліту з осадом, іонітом та ін.) 18 Властивості оксидів, гідроксидів і солей у світлі вчення про електронну будову речовини.
19 Теорія електролітичної дисоціації. Електроліти та неелектроліти. Стан електролітів у розчинах. Електролітична дисоціація — явище розпаду нейтральних молекул на іони, що відбувається в електролітах. Наприклад, молекула солі NaCl розпадається при розчиненні на іони Na+ та Cl-. Процес електролітичної дисоціації є зворотним.
Неелектролітами називають речовини, водні розчини або розплави яких не проводять електричний струм. До таких речовин належать кисень, водень, цукроза, спирт. Для них характерним є ковалентний неполярний або слабополярний зв’язок. Розчини або розплави неелектролітів не проводять електричний струм. Електроліти – речовини з йонним або ковалентним полярним типами хімічного зв’язку. Електролітами є солі, кислоти, луги. Речовини, водні розчини або розплави яких проводять електричний струм, називають електролітами.
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 1368; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.60.175 (0.012 с.) |