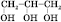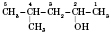Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Фізичні властивості алкінів.Содержание книги
Поиск на нашем сайте
У гомологічному ряду алкінів перші три представники С2-С4 – гази, С5-С15 – рідини, а С16 – тверді речовини. Температури плавлення та ки-піння в ряду алкінів підпорядковані таким же закономірностям, що і у ряду алканів та алкенів, табл. 2.10. Аліфатичні супряжені полієни (алкадієни, алкатриєни) розкладаються з вибухом. Ацетилен при підвищеному тиску – вибухонебезпечний, тому його зберігають у балонах із кізельгуром у аце-тоні при тиску 14,0 атм. Хімічні властивості приєднання галогенів (Cl2, Br2) HCºCH + Cl2 → ClCH=CHCl; ClCH=CHCl + Cl2 → Cl2CH-CHCl2 приєднання галогеноводнів (HCl, HBr) за правилом Марковникова
Гідрогенізація
реакція Кучерова (реакція приєднання води)
Застосування бензену. Хімічна сировина для виробництва ліків, пластмас, барвників, отрутохімікатів і багатьох інших органічних речовин. Часто застосовується як розчинник. Додавання бензену поліпшує якість моторного пального. 15 Природні джерела вуглеводнів та їх переробка. Нафта. Продукти нафтопереробки та їх застосування Природні джерела вуглеводів. 1. Вуглеводні зустрічаються в природі у вигляді переважно природного газу, нафти, кам’яного вугілля. Є 2 способи використання цих горючих копалин: а) у вигляді палива – як джерело енергії, б) у вигляді сировини для подальшої переробки – органічний синтез. З вуглеводнів, виділених з нафти, природний газ і вугілля, можна добути багато різних речовин, а з них виробити ще більше корисних матеріалів. Природний газ, нафта, вугілля належать до не відновлюваних природних ресурсів. Тому розвідують нові родовища, експлуатують уже відкриті так, щоб максимально вилучити з них копалини і раціонально використовувати їх. Зрозуміло, що доцільніше хімічно переробляти природні джерела вуглеводів, ніж палити в котельнях, двигунах, промислових печах і т.д. 16 Одноатомні спирти Одноатомні спирти — це органічні сполуки, до складу яких входить одна або декілька гідроксильних груп (гідроксигруп), сполучених з вуглеводневим радикалом. Ізомерія спиртів зумовлена будовою карбонового скелета й положенням функціональної групи. При складанні назви ізомеру нумерація атомів Карбону починається з того кінця карбон-карбонового ланцюга, до якого ближча функціональна група. Номер атома Карбону, при якому знаходиться гідроксигрупа, указується в кінці назви спирту. Положення вуглеводневого радикала вказується на початку назви. Добування спиртів Приєднання води до алкенів (гідратація):
Із галогенопохідних:
Каталітичний синтез метанолу з карбон(ІІ) оксиду і Гідрогену за температури близько, тиску 7 МПа, каталізатор — суміш цинк оксиду і купрум(II) оксиду:
Етанол утворюється в результаті бродіння глюкози:
Гомологічний ряд Метанол Метиловий спирт Етанол Етиловий спирт Пропанол Пропіловий спирт Бутанол Бутиловий спирт Пентанол Аміловий спирт
17 Фізичні та хімічні властивості одноатомних спиртів. Застосування. Отруйність спиртів та їх згубна дія на організм людини. Фізичні властивості Метанол і етанол – за нормальних умов рідини, легші за воду, мають специфічний запах, як полярні сполуки, вони добре розчинні у воді. Температура кипіння метанолу дорівнює 65 °С, етанолу – 78 °С. Метиловий спирт – дуже отруйна рідина. У разі потрапляння в організм 10 мл метанолу спричиняють сліпоту, а 25 мл – смерть. Етиловий спирт за дією на організм є наркотиком, що в невеликих дозах спричинює сп’яніння, у великих – смерть. Зловживання напоями, що містять етанол (інакше алкоголь), викликає стрне захворювання – алкоголізм. Метанол і етанол – дуже подібні рідини, розрізнити їх можна лише хімічним способом або за температурою кипіння. Хімічні властивості спиртів (на прикладі етанолу). 1) Горіння:
Утворюються вуглекислий газ і вода (при достатній кількості кисню). Реакція проходить із великим виділенням теплоти. 2) Взаємодія з активними металами:
Утворюються водень і алкоголяти (у даному випадку — калій етилат). 3) Взаємодія з галогеноводнями:
4) Внутрішньомолекулярна дегідратація (за температури, що перевищує у присутності концентрованої сульфатної кислоти):
5) Міжмолекулярна дегідратація (при надлишку спирту і температурі, що не перевищує):
Застосування спиртів. Етанол застосовують для добування синтетичного каучуку, пластмас, різних органічних речовин: діетилового естеру, барвників, оцтової кислоти. Його використовують як розчинник для виготовлення парфумів, одеколонів, ліків, лаків і т. д. Етанол у суміші з бензином можна використовувати як пальне для двигунів внутрішнього згоряння. Метанол застосовують як розчинник або сировину для одержання формальдегіду, деяких барвників, фотореактивів, фармацевтичних препаратів. Отруйна дія спиртів Метанол — дуже сильна отрута, якщо потрапляє в організм у малих дозах (5—10 мл), викликає сліпоту, у великих (30 мл) — смерть. Етанол — наркотична речовина, у невеликих дозах викликає сп’яніння, у великих — смерть. При постійному вживанні етанолу розвивається захворювання — алкоголізм. 18 Багатоатомні спирти. Етиленгліколь і гліцерин Багатоатомними називаються спирти, у молекулах яких два або більше атомів Гідрогену заміщені на гідроксигрупи. Будова Якщо в молекулі спирту містяться три гідроксигрупи, він належить до триатомних спиртів. У назві такого багатоатомного спирту присутній суфікс -тріол. Загальна формула триатомних спиртів Ізомерія спиртів зумовлена будовою карбонового скелета й положенням функціональної групи. При складанні назви ізомеру нумерація атомів Карбону починається з того кінця карбон-карбонового ланцюга, до якого ближча функціональна група. Номер атома Карбону, при якому знаходиться гідроксигрупа, указується в кінці назви спирту. Положення вуглеводневого радикала вказується на початку назви. Наприклад:
4-метилпентанол-2 (але не 2-метилпентанол-4) Номенклатура
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 1190; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.120.64 (0.005 с.) |

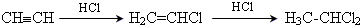
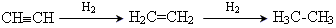

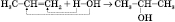
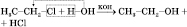
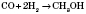

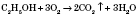
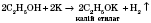
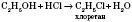
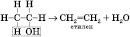

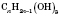 . Наприклад, формула пропантріолу-1,2,3 (гліцерину):
. Наприклад, формула пропантріолу-1,2,3 (гліцерину):