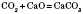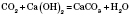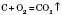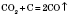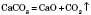Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Фізичні властивості Алотропні модифікаціїСодержание книги
Поиск на нашем сайте
Відомі чотири кристалічні модифікації вуглецю: графіт, алмаз, карбін і лонсдейліт. Графіт Темно-сіра непрозора дрібнокристалічна речовина, жирна на дотик. Графіт добре проводить електричний струм і тепло і дуже м'який. В кристалах графіту атоми вуглецю розміщені у кутах правильних шестикутників в одній площині і утворюють окремі шари. Віддаль між окремими шарами більша, ніж між атомами в тому ж шарі. Внаслідок цього зв'язок між окремими шарами значно слабший, ніж між атомами того ж шару. Тому кристали графіту легко розщеплюються на окремі лусочки, які самі по собі досить міцні Алмаз Прозора та безбарвна або трохи забарвлена домішками в різноманітні відтінки кристалічна речовина. Він яскраво блищить внаслідок сильного заломлення проміння. Алмаз — найтвердіша речовина серед усіх відомих. Завдяки своїй надзвичайній твердості він широко застосовується при бурінні твердих гірських порід, обробці твердих металів і їх сплавів тощо. Відшліфовані безбарвні кристали алмазу — діаманти — коштовні прикраси. Карбід Має лінійну будову. Це тверда речовина білого кольору. Інертна. Може бути провідником. Букибол Чорна речовина, тверда, розчиняється в органічних розчинниках, напівпровідник. Використовується в нанотехнологіях. Хімічні властивості 1) Відновні: З оксидами металів FeO + C = Fe + CO ZnO + C = Zn + CO 2) Як окисник Ca + C = CaC H2 + C = CH4 3) Взаємодія з кислотами C + HNO3 = CO 2 + NO2 + H 2O C + H 2SO4 = CO2 + SO2 + H 2O Застосування Адсорбція Деревне вугілля має здатність адсорбувати (поглинати) на своїй поверхні різні гази і деякі речовини з розчинів. Адсорбція відбувається поверхнею вугілля, тому воно здатне поглинати (адсорбувати) тим більшу кількість речовин, чим більша його сумарна поверхня, тобто чим більше воно подрібнене або пористе. Пористість, а разом з тим і адсорбційна здатність деревного вугілля різко збільшується при попередньому нагріванні в струмені водяної пари. При цьому пори вугілля очищаються від смолистих речовин і його внутрішня поверхня дуже збільшується. Таке вугілля називається активованим. Активоване деревне вугілля широко використовують у цукровому виробництві для очистки цукрового сиропу від домішок, що надають йому жовтого забарвлення, в спиртовому виробництві для очистки винного спирту від сивушних олій, в деяких виробництвах для вловлювання парів цінних летких речовин — бензину, ефіру, сірковуглецю, бензолу тощо з наступним видаленням їх при нагріванні. Активоване вугілля як адсорбент застосовується і в сучасних протигазах. Графіт використовується в олівцевій промисловості. Також його використовують як мастило при особливо високих або низьких температурах.
У фармакології та медицині широко використовуються різні сполуки вуглецю — похідні вугільної кислоти та карбонових кислот, різні гетероцикли, полімери та інші сполуки. Так, карболен (активоване вугілля), застосовується для абсорбції та виведення з організму різних токсинів; графіт (у вигляді мазей) — для лікування шкірних захворювань; радіоактивні ізотопи вуглецю — для наукових досліджень (радіовуглецевий аналіз).
Вуглець є основою всіх органічних речовин. Будь-який живий організм складається в значній мірі з вуглецю.
34 Оксиди карбону. Карбонатна кислота та її солі. Якісна реакція. Твердість води та способи її усунення. Кругообіг Карбону в природі. Карбон(IІ) оксид (чадний газ) — газ без кольору і запаху. Погано розчиняється у воді, скраплюється при атмосферному тиску і температурі. Надзвичайно отруйний, викликає ядуху. Карбон(IV) оксид (вуглекислий газ) — газ без кольору, смаку і запаху, важчий за повітря, добре розчиняється у воді, реагуючи з нею, легко скраплюється при кімнатній температурі й тиску 5 МПа. Твердий вуглекислий газ називають «сухим льодом». Хімічні властивості карбон оксидів Взаємодія карбон(IV) оксиду з водою:
Взаємодія карбон(IV) оксиду з основними оксидами:
Взаємодія карбон(IV) оксиду з основами:
Взаємодія карбон(IІ) оксиду з киснем іде з виділенням великої кількості енергії:
Одержання карбон оксидів Горіння вуглецю: у надлишку кисню: у недостачі кисню: Одержання карбон(IІ) оксиду: Взаємодія карбонатів із кислотами:
Розкладання карбонатів при нагріванні:
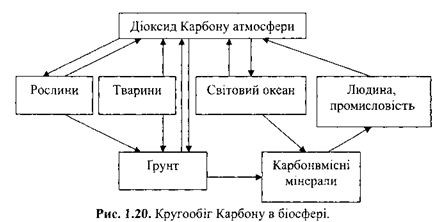
Карбонатна кислота — слабка двоосновна кислота, утворює два ряди солей: середні(карбонати)і кислі(гідрокарбонати). Фізичні властивості карбонатної кислоти. Добре розчиняється у воді, взаємодіючи з нею. У чистому вигляді карбонатна кислота не виділена й існує в розчинах у вигляді йонів. Утворює два ряди солей: кислі солі з аніоном НСО3- і нормальні — з аніоном СО32-. Нормальні солі називають карбонатами, а кислі — гідрогенкарбонатами. Солі значно стійкіші за кислоту і можуть існувати в чистому вигляді. Тве́рдість води́ — якщо вода містить значні кількості солей кальцію і магнію, то таку воду називають твердою, а коли цих солей зовсім немає, або вони містяться в незначних кількостях, то — м'якою. Усунення твердості води: Для зниження твердості води застосовують різні способи. Серед них найбільш поширеним є так званий содово-вапняний спосіб. Суть його полягає в тому, що до води додають розраховану кількість розчину гідроксиду кальцію Са(ОН)2 (вапняна вода) і соди Na2CO3. Сода знижує сталу твердість води. Також дієвим та економічно вигідним є використання іонітів(іоннообмінних смол) які за рахунок заміщення металу солей твердості на натрій, при повному насиченні смоли, її регенерують. Кругообіг карбону в природі
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 757; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.25.26 (0.006 с.) |