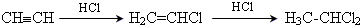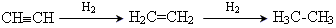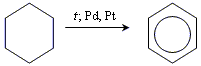Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Найважливіші класи органічних сполукСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Алкани Алкени Алкіни Альдегіди Аміни Амінокислоти Ароматичні вуглеводні Вуглеводні Естери Жири Карбонові кислоти Протеїни Органічні полімери Спирти Феноли Ізомері́я — існування сполук, однакових за хімічним складом, але різних за будовою і властивостями. Такі сполуки називають ізомерами. Є структурна (конституційна), просторова (конформаційна) та оптична (конфігураційна) ізомерія. Ізомерія — одна з причин різноманітності та численності органічних сполук. 4 Електронна будова атома Карбону. Основний і збуджений стан атома Карбону. Особливості хімії Карбону обумовлені, перш за все, значеннями величин електроненгативності, енергії іонізації і будовою валентних електронних підрівнів. Досить високі значення енегрії іонізації (I1=11,26 еВ) і невелике порівняно з іншими неметалами значення електроненгативності (за шкалою Полінга ЕН=2,5) обумовлюють схильність атому Карбону до утворення ковалентного хімічного зв’язку зі значною кількістю інших елементів. У нормальному стані електронна конфігурація атому Карбону має формулу [He]2s22p2, що відповідає валентності рівної двом. Завдяки невеликій різниці в енергії 2s і 2p підрівнів атом Карбону може переходити у збуджений велентний стан 2s12p3, що відповідає чотирьохвалентному стану. Чотирьохвалентний стан для атому Карбону є найбільш харатерним. У чотирьохвалентному стані атом Карбону може мати координаційне число рівне двом (sp-гібридизація), трьом (sp2-гібридизація) і чотирьом (sp3-гібридизація). На відміну від всіх інших елементів (за винятком водню) у атомі Кабону число валетних електронів співпадає з числом валентних орбіталей. Вказана особливість будови електронних підрівнів обумовлює, в основному, значну стійкість зв’язку C-C і схильність Кабону до утворення вуглецевих ланцюгів. У хімічних сполуках Карбон часто проявляє ступені окислення -4, +2, +4. В переважній більшості органічних сполук Карбон утворює малополярний ковалентний зв’язок і тому використовувати поняття ступінь окислення у даному випадку недоцільно. 5 Алкани. Алкани, насичені вуглеводні насичені ациклічні вуглеводні, що мають загальну формулу CnH2n+2, їх також називають парафінами. Мета́н — найпростіша органічна сполука вуглецю з воднем, природний безбарвний газ без запаху, хімічна формула — CH4. Зустрічається в осадовому чохлі земної кори у вигляді вільних скупчень (покладів), в розчиненому (в нафті, пластових і поверхневих водах), розсіяному, сорбованому (породами і органіч. речовиною) і твердому (газогідратному) станах. При використанні в побуті, до метану звичайно додають одоранти зі специфічним «запахом газу». Сігма-зв'язок або σ-зв'язок — різновид ковалентного зв'язку, для якого характерна осьова симетрія. Сігма-зв'язки — найміцніші із ковалентних зв'язків. Прикладами є зв'язки у двоатомних молекулах на зразок H2, N2, O2. Сігма-зв'язки утворюються також між атомами Карбону в хребтах полімерів, причому в насичених полімерах — це єдиний тип зв'язку, у ненасичених полімерах існують ще додаткові пі-зв'язки.
Ізомерія. Для алканів характерна структурна ізомерія, яка зумовлена можливістью розгалуження вуглецевого ланцюга молекули. Вуглеводень з прямим, нерозгалуженим ланцюгом назівається нормальним ізомером. У алканах з розгалуженим ланцюгом замісники (бічні ланцюги) можуть займати різне положення відносно головного ланцюга. Речовини, що мають однаковий склад,але різняться будовою вуглецевого ланцюга, називаються структурними ізомерами. Номенклатура. Для того щоб дати розгалуженому вуглеводню назву згідно з цією номенклатурою, необхідно виконувати такі правила. Вибирають найдовших ланцюг атомів вуглецю в молекулі, Нумерують атоми вуглецю в головному вуглеводневому ланцюгу, починаючи з того кінця, до якого ближче розміщені розгалуження (пр. а). Якщо замісники знаходяться на рівних віддалях від кінця ланцюга, то нумерацію починають з того кінця. Склад молекул усіх алканів відповідає загальній формулі СnН2n+2, де п = 1, 2, 3, 4… 6 Фізичні і хімічні властивості насичених вуглеводнів. Добування, застосування Фізичні властивості насичених вуглеводнів закономірно змінюються залежно від їх складу. Як видно з таблиці, перші чотири гомологи (від C1 до C4) при звичайній температурі є газами, наступні одинадцять (від C6 до C15) — рідини, а починаючи з гексадекану C16H34 — тверді речовини. Із збільшенням молекулярної маси їх точки плавлення і точки кипіння поступово підвищуються, а також збільшується і їх густина. У воді насичені вуглеводні практично нерозчинні, але добре розчиняються в багатьох органічних розчинниках. Хімічні властивості С2Н6+7О2=4СО2+6Н2О С2Н6+Сl2=C2H5Cl+HCl CH4+H2O=3H2+CO Застосування: Як паливо, у хімічній промисловості, для виготовлення свічок. 7 Циклоалкани Циклоалка́ни — вуглеводні з одним чи кількома вуглецевими циклами. Загальна формула CnH2n або (CH2)n. За розмірами циклу поділяють на малі (циклопропан, циклобутан), середні (циклопентан, циклогексан, циклогептан) та великі (n>7). 8 Алкени Алкени ненасичені ациклічні вуглеводи, називані також олефінами, що мають загальну формулу CnH2n. Легкі алкени, наприклад, етилен і пропілен — гази, які отримують з фракцій при крекінгу нафти. Алкени мають один або більше подвійних зв'язків між атомами вуглецю, тому називаються ненасиченими. Інша назва — олефіни. 9 Фізичні та хімічні властивості етиленових вуглеводнів. Добування та застосування алкенів. Хімічні властивості Реакція гідрування
Реакція Вагнера (окиснення перманганатом Калію у лужному середовищі)
Реакції приєднання Br2 і Cl2
Реакції полімеризації
Фізичні властивості Перші три члени ряду олефінів є газами, далі йдуть рідини, що не змішуються з водою; вищі олефіни — це тверді речовини. Зі збільшенням молекулярної маси підвищуються температури плавлення і кипіння. Алкени нормальної будови киплять при більш високій температурі, ніж їх абітурієнти, що мають ізобудову. Температури кипіння цис-ізомерів вище, ніж транс-ізомерів, а температури плавлення - навпаки. Алкени погано розчиняються у воді (проте краще, ніж відповідні алкани), але добре - в органічних розчинниках. Отримання Промислові методи Крекінг алканів нафти
Лабораторні методи Дегідратація спиртів
Відщеплення галогенів (Cl, Br)
Гідрування алкінів
Застосування алкенів При цьому утворився етиленгліколь - в'язка, схожа з гліцерином рідиназастосовується у виробництві антифризів, синтетичного волокна лавсану,вибухових речовин. Етиленгліколь дуже отруйний. Оксид етилену застосовується для синтезу різних органічних речовин,виробництва оцтового альдегіду, виробництва лаків, пластмас,косметичних препаратів, і.т.д. . Етилен приєднує воду, і виходить етиловий спирт: . При реакції з галогеноводородамі виходить етілхлорід, що застосовується для місцевої астенезіі: В результаті утворюється поліетилен з якого отримують безліч різнихпластмас, високооктанове пальне, синтетичний каучук, і.т.д. 10 Ацетиленові вуглеводні АЦЕТИЛЕНОВІ ВУГЛЕВОДНІ (алкіни) — вуглеводні аліфатичного ряду, які містять один потрійний зв’язок –С≡С–. Загальна формула алкінів СnH2n-2. Найпростішим представником ряду є ацетилен (етин) С2Н2. Ізомерія
Номенклатура Назва за номенклатурою IUPAC: вуглеводень + суфікс –ін (ин) + ци-фра, що показує положення потрійного зв’язку в алкіні. Нумерацію вугле-водневого радикала починаємо з того кінця, до яког ближче розташований потрійний зв’язок: 11 Фізичні та хімічні властивості алкінів. Добування та застосування. Отримання Промислові методи отримання ацетилену гідроліз ацетилениду (карбіду) кальцію
піроліз метану
Лабораторні методи отримання через галогенпохідні
Хімічні властивості приєднання галогенів (Cl2, Br2) HCºCH + Cl2 → ClCH=CHCl; приєднання галогеноводнів (HCl, HBr) за правилом Марковникова
Гідрогенізація
12 Алкадієни Алкадієни — ненасичені аліфатичні вуглеводні, з загальною формулою CnH2n-2. Алкадієни містять два подвійних зв'язки між атомами вуглецю. Натуральний каучук – високоеластичний матеріал природного походження, який одержують із латексу – соку каучуконосних рослин (гевея, гваюла, кок-сагиз, тау-сагиз та ін.) - при дії на нього коагулянтом – оцтовою кислотою. 13 Арени Аромати́чні вуглево́дні — органічні сполуки, які належать до класу карбоциклічних сполук. У складі молекули ароматичних вуглеводнів є одна або кілька груп з 6 атомів вуглецю(Карбону), сполучених у кільце (бензенове ядро) простими і подвійними зв'язками (формула Кекуле). За сучасними уявленнями, атоми Карбону в бензеновому ядрі сполучені електронами двох типів: одні електрони містяться в площині молекули, інші розміщені перпендикулярно до неї. Отримання Промислові методи отримання бензолу і його гомологів 1. перегонка кам'яновугільної смоли 2. каталітичний риформінг нафти 3. реакція Реппе
Лабораторні методи дегідрогенізація циклогексану
дегідроциклізація гептану
14 Алкіни
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 1662; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.186.153 (0.008 с.) |