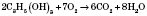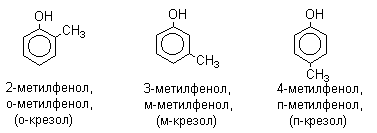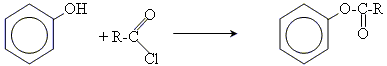Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Фізичні властивості гліцерину.Содержание книги
Поиск на нашем сайте
Безбарвна, в’язка, гігроскопічна рідина, солодка на смак. Змішується з водою в будь-яких співвідношеннях. Температура плавлення —
Хімічні властивості багатоатомних спиртів (на прикладі гліцерину). 1) Горіння:
Утворюються вуглекислий газ і вода (за достатньої кількості кисню). 2) Взаємодія з активними металами (може відбуватися ступінчасто):
3) Взаємодія з галогеноводнями (може відбуватися ступінчасто):
4)Нітрування (нітруюча суміш — суміш концентрованих нітратної і сульфатної кислот)
Нітрогліцерин — вибухова речовина, вибухає від легкого струсу і нагрівання. Із нітрогліцерину виробляють динаміт. 5) Взаємодія з купрум(ІІ) гідроксидом(якісна реакція на багатоатомні спирти):
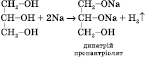
Купрум(ІІ) гліцерат, що утворюється, — розчин синього кольору. Застосування гліцерину. Гліцерин застосовується для добування нітрогліцерину (вибухова речовина), антифризів, у шкіряному виробництві для пом’якшення шкір, у медицині. Етиленгліколь і гліцерин – солодкуваті безбарвні сироподібні рідини. Вони добре розчиняються у воді і в етанолі. Етиленгліколь – дуже отруйна речовина! 19 Феноли Феноли – це органічні сполуки, у молекулах яких гідроксильні групи безпосередньо зв’язані з бензольним ядром. Найпростішим представником фенолів є гідроксибензол, або фенол. Молекулярна формула фенолу C6H5OH. Електронна будова
Феноли являють собою полярні сполуки (диполі). Бензольне кільце є негативним кінцем диполя, група - OH - позитивним. Дипольний момент направлений в сторону бензольного кільця. Фенол є слабкою кислотою. В цьому полягає головна відмінність фенолів від спиртів, які є неелектролітами. Ізомерія Можливі 2 типу ізомерії: ізомерія положення заступників в бензольному кільці; ізомерія бічного ланцюга (будови алкильного радикала і числа радикалів). Номенклатура За наявності декількох заступників початок нумерації визначає гідроксильна група і ці з’єднання розглядаються як похідні фенолу. Багато фенолів мають тривіальні назви (вказані в дужках), які зберігаються і в систематичній номенклатурі:
Застосування • виробництво полімерних матеріалів • виробництво барвників • виробництво лікарських препаратів • виготовлення парфумів і косметичних засобів
Охорона навколишнього середовища від промислових відходів, що містять фенол Фенол – сильний антисептик, використовується як дезинфікуюча речовина в медицині. Особливо багато його витрачають для виробництва пластмас – фенопластів, а також барвників, лікарських речовин, фотографічних проявників. Але треба зважати на те, що фенол вбиває не лише шкідливі мікроорганізми. Потрапляючи в довкілля, він згубно діє на флору і фауну. Тому виробництво і промислове використання фенолу тісно пов’язане з питаннями екології, з охороною природи від промислових відходів, що містять фенол. З цією метою застосовують різні методи: гази, що містять фенол, піддають каталітичному окисненню, видаляють фенол розчинниками тощо. Ведеться постійна робота з удосконалення цих методів. Так, великого значення набуває біохімічний метод, який забезпечує глибоке очищення стічних вод від фенолу. Перспективним є також обробка їх озоном. Запровадження таких методів очищення дає можливість перейти до замкнутих безвідхідних технологій з багаторазовим використанням промислових вод. 20 Фізичні та хімічні властиивості фенолів. Добування Фізичні властивості Фенол – безбарвна кристалічна речовина з характерним запахом. Під час зберігання він поступово окиснюється киснем повітря і набуває рожевого забарвлення. Фенол плавиться за температури 43 °С. Добре розчиняється в гарячій воді. Фенол отруйний, при потраплянні на шкіру викликає опіки. Він всмоктується через шкіру і може викликати отруєння. Хімічні властивості 1. кислотні властивості фенолів
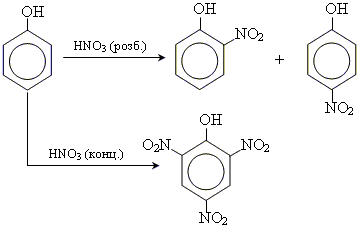
2. реакції заміщення • реакція нітрування
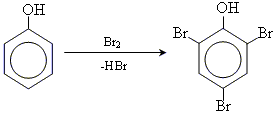
• реакції галогенування (Cl, Br)
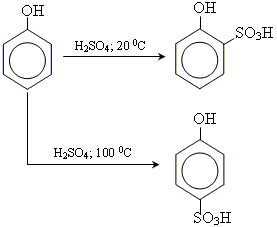
• реакція сульфування
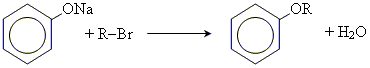
3. утворення простих ефірів
4. утворення складних ефірів
5. заміщення гідроксогрупи на галоген (протікає значно гірше, ніж у випадку спиртів)
6. відщеплення гідроксогрупи
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 747; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.225.188 (0.007 с.) |

 , кипіння —
, кипіння —