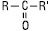Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Взаємний вплив атомів в молекулі фенолівСодержание книги
Поиск на нашем сайте
Феноли являють собою полярні сполуки (диполі). Бензольне кільце є негативним кінцем диполя, група - OH - позитивним. Дипольний момент направлений в сторону бензольного кільця.
Як відомо, гідроксильна група -OH є заступником I роду, тобто вона сприяє підвищенню електронної щільності в бензольному кільці (особливо в орто-і пара-положеннях). Це обумовлено тим, що одна з неподілених пар електронів атома кисню OH-групи вступає в пару з π-системою бензольного кільця. Зсув неподіленої пари електронів атома кисню в бік бензольного кільця призводить до збільшення полярності зв'язку OH. Таким чином, має місце взаємний вплив атомів і атомних груп у молекулі фенолу. Це взаємний вплив відображається у властивостях фенолу. [1] По-перше, підвищується здатність до заміщення атомів водню в орто-і пара-положеннях бензольного ядра, і в результаті реакцій заміщення зазвичай утворюються тризаміщений похідні фенолу. По-друге, збільшення полярності зв'язку OH під дією бензольного ядра і поява досить великого позитивного заряду на атомі водню призводить до того, що молекули фенолу дисоціюють у водних розчинах по кислотному типу. Фенол є слабкою кислотою. В цьому полягає головна відмінність фенолів від спиртів, які є неелектролітами. Добування Промислові методи отримання 1. з кам'яновугільної смоли 2.отримання з бензолу і пропену
21 Альдегіди Альдегідами називаються органічні сполуки, у молекулах яких міститься альдегідна функціональна група: – Назви альдегідів за міжнародною номенклатурою утворюються від назв відповідних вуглеводнів із додаванням суфікса -аль. Тривіальні назви утворюються від назв кислот, які можуть бути одержані з цих альдегідів. Загальна формула альдегідів:
Будова Група атомів Порівняно зі спиртами у складі молекул альдегідів на два атоми Гідрогену менше. Це відбивається у назві «альдегіди», що походить від слів «алкоголь» і «дегідрування», тобто дегідрований алкоголь. Номенклатура Систематичні назви альдегідів будують за назвою відповідного вуглеводню і додаванням суфікса-аль. Нумерацію ланцюга починають з карбонільного атома вуглецю. Тривіальні назви виробляють від тривіальних назв тих кислот, в які альдегіди перетворюються при окисленні. H 2 C = O метан аль мурашиний альдегід (формальдегід) CH 3 CH = O етан аль оцтовий альдегід (ацетальдегід) (CH 3) 2 CHCH = O 2-метил-пропан аль ізомасляний альдегід CH 3 CH = CHCH = O Бутен-2-аль кротоновий альдегід Ізомерія альдегідів зумовлена зміною в будові карбонового скелета, сполученого з альдегідною групою. Карбон, що входить до альдегідної групи, вважається першим. Наприклад:
Добування 1) Окиснення спиртів із гідроксигрупою біля першого атома Карбону: 2) Окиснення алкенів
3) Метаналь добувається каталітичним окисненням метану (каталізатори — нітроген оксиди):
3) Реакція Кучерова:
Представники гомологічного ряду альдегідів
22 Фізичні і хімічні властивості альдегідів Фізичні властивості Формальдегід — безбарвний газ із різким задушливим запахом. Добре розчиняється у воді. Температура кипіння Ацетальдегід — безбарвна легколетка рідина з різким запахом, добре розчинна у воді. Температура кипіння
Хімічні реакції 1) Повне окиснення — горіння:
2) Часткове окиснення — купрум(II) гідроксидом до кислоти (у даному випадку — оцтової):
Це якісна реакція для визначення альдегідів. 4) Окиснення амоніачним розчином аргентум оксиду — «реакція срібного дзеркала»:
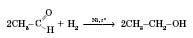
Ця реакція також є якісною для визначення альдегідів. Реакції приєднання проходять за рахунок розриву подвійного зв’язку в альдегідній групі. 5) Приєднання водню (відновлення альдегідів до спиртів):
23 Кетони Кетони – органічні речовини, які містять карбонільну (кето-) групу Будова Карбонільна група >С = О присутня в молекулах альдегідів, що зумовлює схожість хімічних властивостей альдегідів і кетонів. Проте схожість не є повною, оскільки в молекулах альдегідів один із зв’язків карбонільною групою витрачається на з’єднання з воднем, а в молекулах кетону обидва зв’язки йдуть на з’єднання з вуглеводневими радикалами. Це позначається, зокрема, на тому, що кетони окиснюються значно важче, ніж альдегіди, і не є такими енергійними відновниками, як альдегіди. У практичному плані найбільш важливим з кетонів є диметилкетон, або ацетон. 24 Одноосновні карбонові кислоти Карбонові кислоти — це органічні сполуки, до складу молекул яких входить карбоксильна функціональна група: –
Застосування карбонових кислот. Мурашина кислота застосовується як протрава для фарбування шерсті, консервант фруктових соків і силосу, використовується для дезінфекції місткостей у харчовій промисловості, у хімічних синтезах. Оцтова кислота застосовується для добування пластмас, барвників, ліків, штучних волокон, кіноплівки в хімічних синтезах. Вона використовується як приправа до їжі, для консервації овочів. Солі оцтової кислоти використовують для фарбування тканин, а також для боротьби зі шкідниками сільського господарства.
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 1069; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.140.108 (0.006 с.) |


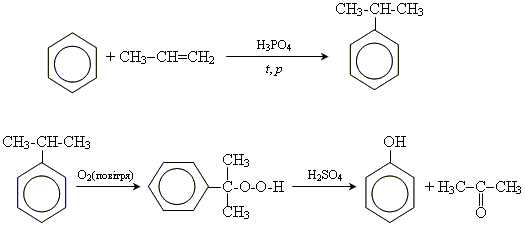
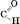
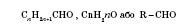

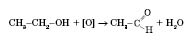

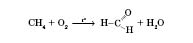
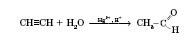

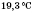 . Водний 40%-й розчин формальдегіду називається формаліном.
. Водний 40%-й розчин формальдегіду називається формаліном. .
.

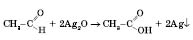
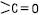 , зв’язану з двома вуглеводневими радикалами.
, зв’язану з двома вуглеводневими радикалами.