
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ііі . Розв’язок типових задач з елементарної хімії
Миколаїв 2007
УДК 041 Камінська Е.Г. Кельїна С.Ю. Мащенко В.В. Класи неорганічних сполук. (методичні вказівки)
Кафедра хімії Ці методичні вказівки містять довідки з основних понять хімії і класів неорганічних сполук, які необхідні для вивчання університетського курсу хімії. Окрім того, розібрані методи розв’язку основних типів задач з відповідних тем та запропоновані вправи і задачі для самостійної підготовки та самоконтролю знань. Вказівки призначені для студентів всіх спеціальностей.
Рецензент – к.т.н., доцент Соловйова Ж.Ф.
Ó Український державний морський технічний університет ім. С.Й.Макарова
І. Основні хімічні поняття Хімія -це наука про склад та будову речовин, їх властивості та взаємні перетворення. Окремий вид матерії, який за певних умов має сталі фізичні та хімічні властивості, називається речовиною. Речовина складається з елементарних частинок, які мають масу покою. Будь-які зміни з речовиною називають явищами. Фізичними явищами є такі, під час яких не змінюється склад речовини, але можуть змінюватися форма, агрегатний стан, температура, тощо. Хімічні явища зв’язані із зміною складу та властивостей речовини. Будь-яка хімічна речовина складається з хімічних елементів. Елементом називається сукупність атомів, які мають однаковий заряд ядра. Кожний елемент має свою назву та хімічний символ. Носієм властивостей елемента є атом. Атом –хімічно неподільна електронейтральна частинка речовини, яка складається з ядра і електронів. Ядро (центральна частина атома) складається з протонів і нейтронів. Маси протонів і нейтронів у» 10000 разів більше маси електронів, тому в ядрі зосереджена маса атома, яка дорівнює» 10-25- 10-27 кг. Електрони утворюють електронну оболонку, розміри якої визначають розміри атома (»10-10 м). Позитивний заряд ядра, який відповідає числу протонів, дорівнює негативному заряду електронної оболонки, що визначається числом електронів. Кількісними характеристиками атома є його маса і заряд ядра,що збігається з порядковим номером (Z) елемента у Періодичній системі. Елементи можуть утворювати атоми з різною кількістю нейтронів у ядрі. Такі атоми одного елементу називають ізотопами. Наприклад, елемент Гідроген складається з ізотопів трьох видів: Протію (11Н, тобто до складу ядра входить тільки протон), Дейтерію (21D, до складу ядра входить один протон і один нейтрон) і Тритію (31Т, до складу ядра входять один протон і два нейтрони). Кожний елемент має кілька ізотопів, тому в Періодичній системі наведено середню атомну масу елементів з урахуванням їх поширення у природі. Атомна одиниця маси – це сучасна позасистемна одиниця вимірювання атомних та молекулярних мас (позначається а.о.м.) Вона є 1/12 часткою маси атому ізотопу Карбону 12С. Маса цього ізотопу дорівнює 19,93 10-27 кг. З цього випливає, що 1 а.о.м = Ця величина – одна з фундаментальних фізичних сталих. Відносна атомна маса (Аr, r- relаtive - відносний) – це величина, що визначається відношенням маси атома елемента до величини 1 а.о.м.: Аr(ат) = m (ат) / 1 а.о.м Аr (Н) = 1,67 10-27 кг / 1 а.о.м. =1,67.10-27 кг / 1,66 . 10-27 кг = 1,008 Аr (U) = 3,9513. 10-25 кг / 1 а.о.м. = 3,9513. 10-25 кг / 1,66 . 10-27 кг = 238,03. Основною властивістю атомів хімічних елементів є їх схильність до сполучення з утворенням хімічних речовин. Молекула – здатна до самостійного існування частинка речовини, що зберігає її хімічні властивості. Молекули складаються з атомів, які з’єднані між собою хімічними зв’язками в певній послідовності та певним чином орієнтовані у просторі. Число атомів в молекулах становить від двох (Н2, О2) до кількох тисяч (гормони, білки). Атоми інертних газів іноді називають одноатомними молекулами (Не, Аr). Усі молекули одної речовини молекулярної будови мають однаковий склад, розміри, масу і властивості. Молекули різних речовини різняться за цими характеристиками. Молекули безперервно рухаються. У твердих речовинах вони здійснюють коливальний рух навколо положень рівноваги, в рідких – теж коливаються і прямолінійно переміщуються в нові положення, в газах – здійснюється прямолінійний хаотичний рух. Відстань між молекулами у твердих речовинах і рідинах складає» 10-10 м, у газах – 10-8-10-7 м. Під час фізичних явищ молекули зберігаються, під час хімічних перетворень – руйнуються, поєднуються в нові комбінації, утворюючи нові речовини. Сполуки, які складаються з атомів одного елементу, називаються гомосполуками. Найбільш стійка за звичайних умов гомосполука елементу називається простою речовиною. Наприклад, Карбон утворює графіт і алмаз, Оксиген утворює атомарний кисень О, молекулярний кисень О2 і озон О3. Серед цих прикладів простими сполуками є графіт та молекулярний кисень, як більш стійки за звичайних умов. Явище існування кількох гомосполук одного елементу називається алотропією. Сполуки, які складаються з атомів різних елементів називають гетеросполуками, або складними речовинами, наприклад, вода Н2О, амоніак NH3, сульфатна кислота H2SO4, тощо. Найважливішою характеристикою молекули є її склад, який описується хімічними формулами. Використовують декілька видів хімічних формул. Для сполук з молекулярною будовою використовуються молекулярні формули, які відображають якісний склад та кількісні співвідношення атомів у молекулі. Наприклад, молекула СО2 складається атомів Карбону і Оксигену у співвідношеннях 1:2. В електронних формулах зображуються зв'язки між атомами у молекулі, які утворюються спільними електронними парами, наприклад, Н: Н, О :: О, Н: О: Н. Такими формулами користуються, коли треба розібрати механізми утворення зв’язків у молекулі. Структурні формули показують порядок з’єднання атомів в молекулах:
Не всі речовини складаються з молекул. Молекулярну будову мають більшість органічних речовин та частина неорганічних, наприклад, прості речовини водень Н2, кисень О2, йод І2; складні – галогеніди, сульфіди, гідриди, оксиди неметалів (CО2, SO3, РСІ3, Н2S, AsH3) і безводні неорганічні кислоти (HBr, HI). Більшість твердих неорганічних речовин (основні оксиди, луги, солі) складаються з іонів або поляризованих атомів. Носієм хімічних властивостей речовини в них є сукупність частинок, кількісне співвідношення в якій відображає склад речовини, наприклад, NaCl, KOH, K2SO4. Тому не можна застосовувати поняття “молекула” щодо речовин з немолекулярною будовою. Формули немолекулярних сполук базуються на результатах дослідів елементного аналізу і теж показують якісний і кількісний склад сукупності частинок, що утворюють ці речовини. Наприклад, речовина калій карбонат складається з сукупності атомів Калію, Карбону і Оксигену у співвідношенні 2:1:3, тому формула буде К2СО3.
Відносна молекулярна маса – це величина, що визначається відношенням маси молекули до величини 1 а.о.м. Відносна молекулярна маса розраховується за хімічною формулою і дорівнює сумі відносних атомних мас усіх атомів, які входять до складу молекули. Мr (АаВв) = а . Аr(A) + в . Ar (B) Наприклад, Мr (Н2О) = 2 . Аr(Н) + 1 . Ar (О) = 2. 1,008 + 1. 15,99 = 17,9916» 18. Відносні атомні і молекулярні маси – безрозмірні величини. Вони чисельно дорівнюють атомній і молекулярній масам, вираженим у а.о.м. Наприклад, молекулярна маса води А (Н2О) = 18 а.о.м. Кількість речовини (n) визначається числом частинок – структурних одиниць речовини, з яких вона складається: молекул, атомів, іонів, електронів, протонів, тощо. Одиницею вимірювання кількісті речовини є моль. Моль – кількість речовини, що містить стільки структурних або формульних одиниць, скількі атомів містяться у ізотопі Карбону 12С масою 0,012 кг. Один моль містить 6,02 .1023 частинок. Ця величина називається сталою Авогадро, позначається NA і має розмірність моль -1. Наприклад, 1 моль води Н2О містить 6,02 .1023 молекул, 1 моль хлориду натрію NaCl містить 6,02 .1023 формульних одиниць, 1 моль іонів міді Сu 2+ містить 6,02 .1023 іонів міді. n = m/M; n = N/NА; n = V/Vm де m – маса речовини, г; М-молярна маса речовини, г/моль; N - число часток речовини, NА - число Авогадро, моль-1; V - об¢єм речовини, л; Vm- молярний об¢єм речовини, л/моль. Молярна маса – це маса одного моля речовини, позначається через М і має розмірність г/моль (кг/моль, кг ´моль-1). У г/моль вона чисельно дорівнює відносній молекулярній масі. Доведемо це. Нехай n = 1моль., тоді маса 1 молю є масою NА молекул; m – маса однієї молекули, m = Мr´1 а.о.м. М = Мr´(1,66.10-24 г) ´ (6,02 .1023моль-1) = Мr,(г . моль-1) Молярний об¢єм - об¢єм газоподібної речовини або суміші газів, в якому міститься один моль речовини (6,02 .1023 молекул). Vm = V/n На відміну від молярної маси, молярний об¢єм газу залежить від умов – тиску і температури. В хімії найчастіше використовують молярний об¢єм газу за нормальних умов (Т°= 273 К, Р°= 101,325 кПа)- V° = 22,4 л/моль.
Класи неорганічних сполук Предметом вивчення хімії є хімічні елементи. За хімічними властивостями розрізняють елементи з металічними та неметалічними властивостями. З 107 елементів Періодичної системи більш 80 мають металічні властивості. Хімічні властивості металічних елементів зумовлені здатністю їх атомів віддавати електрони і перетворюватись у катіони, тобто проявляти відновлюючі властивості: Me - ne —Меn+ . До металів належать всі елементи побічних або В груп Періодичної системи, елементи ІА (крім Гідрогену), ІІА груп, лантаноїди, актіноїди. З елементів ІІІА-VІІІА груп, ті, які розміщуються нижче діагоналі, проведеної крізь В-Sі-Аs-Те-Аt, належать до металів, останні - до неметалів. Наприклад, до металічних елементів належать Літій, Калій, Кальцій, Ферум, Купрум, Неодим. Елементи, які розміщені поблизу вказаної межі, проявляють властивості одночасно металів і неметалів. Це, наприклад, Бор, Арсен, Станум, Плюмбум. Проявляючи різний ступінь окиснення, елементи можуть мати різні властивості (Ферум, Манган, Хром та інші.). До елементів - неметалів відносяться Гідроген, Нітроген, Оксиген, Галогени (F, Cl, Br, I), інертні гази (He, Ar, Ne та ін.), Сульфур, Фосфор. Для більшості з них характерною особливістю є здатність приймати електрони і утворювати аніони: S° + 2e ® S 2-, тобто проявляти окиснювальні властивості. Іноді вони можуть виявляти і відновні властивості. Більшість інертних газів не утворюють іони. В зв’язку з новою українською номенклатурою багато елементів змінило свої назви. В таблиці 1 наведені нові назви деяких елементів і простих речовин, які вони утворюють. Прості сполуки металів, або просто метали відрізняються від неметалів своїми фізичними, хімічними та механічними властивостями. Для металів характерні високі електро - і теплопровідність, металевий блиск, твердість, ковкість, здатність до пластичної деформації і т.п. Всі метали, крім ртуті за звичайними умовами є твердими речовинами. Серед простих сполук неметалів є гази (H2, N2, O2, Cl2, F2), рідини (Br2), тверді речовини (S, P, Si). Більшість з них є диелектриками (але графіт, силіцій проводять електричний струм), не мають металевого блиску, мають невелику твердість і є крихкими. Класифікація неорганічних сполук має велике значення для успішного вивчення хімії. Вона складена за класифікацією елементів згідно з Періодичним законом Д.І. Менделєєва і враховує властивості утворених ними сполук. Хімічні властивості елементів проявляються в хімічних реакціях. Таблиця 1. Стандартизовані назви елементів і простих речовин Символ елементу Назва елементу Назва простої. речовини Ag Аргентум срібло As Арсен арсен Ві Бісмут бісмут С Карбон вуглець, графіт F Флуор флуор (фтор) Н Гідроген водень Нg Меркурій ртуть Mn Манган манган N Нітроген азот Ni Нікол,Нікель нікель О Оксиген кісень S Сульфур сірка Si Силіцій силіцій
Важливими класами неорганічних сполук є оксиди, основи, кислоти і солі. Генетичний зв’язок між класами неорганічнихсполук такий
Солі
Оксиди. Оксидами називаються сполуки елементів з Оксигеном. Наприклад: Na2О —натрій оксид, AІ2О3 — алюміній оксид, ZnO — цинк оксид. Якщо елемент утврює декілька оксидів, то після назви вказується його ступінь окиснення: FeO ферум (ІІ) оксид, Fe2О3 — ферум (ІІІ) оксид, Cl2О7 — хлор (VІІ) оксид. Назви оксидів. Назви оксидів можна побудувати за допомогою числових префіксів: Sb2O3 — дистибій триоксид (стибій (ІІІ) оксид), N2О5 — динітроген пентаоксид, Аl2О3 - алюміній сесквіоксид (сескві = півтора). Оксиди поділяються на солеутворюючі і несолеутворюючі (СО, NО, N2О). Перші поділяються на основні, кислотні і амфотерні. Основними називаються оксиди, що утворюють солі при взаємодії з кислотами або кислотними оксидами. Їм відповідають основи: СаО - Са(ОН)2, FеО - Fе(ОН)2, К2О - КОН. Основними можуть бути тільки оксиди металів. Кислотними називаються оксиди, що утворюють солі взаємодією з основами або основними оксидами. Їм відповідають кислоти SО2 - Н2SО3, Р2О5 - Н3РО4, N2О5 - НNО3. Ці оксиди називаються ангідридами кислот. Кислотні оксиди утворюються неметалами і деякими металами, які проявляють вищий ступінь окиснення. Наприклад: манган (VІІ) оксиду Мn2О7 відповідає манганатна (VІІ) кислота НМnО4, хром (VI) оксиду СrО3 - хроматна (VІ) кислота Н2СrО4. Амфотерними називаються оксиди, що утворюють солі як з кислотами, так і з основами, наприклад: ZnО; Аl2О3; РbО; Сr2О3. Властивості оксидів пов’язані з положенням елементів у Періодичній системі. Так, властивості оксидів елементів ІІІ періоду (Na2O, MgO, Al2O3, SіO2, Р2О5, SO3, Сl2O7) змінюються зі збільшенням порядкового номера елемента від основних (Na2O, MgO) через амфотерні (Al2O3) до кислотних (SіO2, Р2О5, SO3, Сl2O7). Ступінь окиснення елементів також впливає на властивості їх оксидів: оксиди елементів нижчого ступеню окиснення проявляють основні властивості, середнього — амфотерні, вищого — кислотні. Наприклад: CrO — основний оксид, Cr2O3 — амфотерний, CrО3 — кислотний. Одержання оксидів. І. Окиснення простих речовин: С + О2 = СО2; 2Мg + О2 = МgО 2. Горіння складних речовин: СН4 +2О2 = СО2 + 2Н2О 3. Розкладання солей: СаСО3 = СаО + СО2; 2Рb(NО3)2 = 2РbО + 4NО2 + О2 4. Розкладання основ: Mg(OH)2 = MgО + H2O; Hg(OH)2 = HgО + H2O 5. Розкладання кислот: 4НNО3 = 4NО2 + 2Н2О + О2; 2Н3ВО3 = В2О3 + 3Н2О. Хімічні властивості оксидів. І. Основні оксиди взаємодіють з кислотами з утворенням солі і води: FeO + H2SO4 = FeSO4 + H2O 2. Кислотні оксиди взаємодіють з основами з утворенням солі і води: SO3 + 2NaOH = Na2SO4 + H2O 3. При взаємодії кислотних і основних оксидів утворюється сіль: СаО + СО2 = СаСО3 4. Більшість кислотних оксидів і оксиди лужних і лужно-земельних металів взаємодіють з водою: SO3 + H2O = H2SO4; Na2O + H2O = 2NaOH 5. Амфотерні окисди реагують з кислотами і основами: ZnO + HCl ® ZnCl2 + H2O ZnO + 2NaOH ® Na2ZnO2 + H2O
Кислоти Кислотами називаються речовини, які при електролітичній дисоціації з катіонів утворюють тільки катіони Гідрогену. Наприклад: HCІ «H+ + CІ-; СН3СООН «Н+ + СН3СОО- Кислоти поділяються за кількістю утворених іонів Гідрогену при дисоціації; наявності у їх складі Оксигену, силі кислот (їх ступені дисоціації) та їх окиснювальними властивостями. Основність кислоти визначається числом утворених при дисоціації іонів Гідрогену. Поділяють кислоти на одноосновні (НСІ, НNO3 ), двоосновні (H2SO4, H2S), триосновні (Н3РО4). Дво- і багатоосновні кислоти дисоціюють ступінчасто: Наприклад: Н3РО4 «Н++ Н2РО4-(перший ступінь); Н2РО4- « Н+ + НРО42- (другий ступінь); HPO42- «H+ + PO4 3- (третій ступінь); Дисоціація проходить частіше по першому ступеню, менше - по другому і ще менше — по третьому. Тому в розчині фосфатної кислоти є молекули Н3РО4 та іони Н2РО4-, НРО42-, РО43- і Н+ . Розрізняють кислоти оксигеновмісні (HNO3; H2SO4 ; Н3РО4), які є гідратами відповідних оксидів, і безоксигенові (HCІ; H2S; HCNS). За кількістю іонів Гідрогену, утворених при дисоціації (ступеню дисоціації кислоти - a), розрізняють сильні кислоти – НСІ, HBr, HI, H2SO4, HNO3, HCIO4 (a > 30%), слабкі кислоти - Н2СО3, Н2SO3, H2S, H2SiO3, HNO2 (a<3%) і кислоти середньої сили –Н3РО4 і т. і. За елементом-окиснювачем розрізняють звичайні кислоти, у яких окиснювачем є іон Гідрогену і кислоти-окиснювачи, де окиснювачем є елемент, який утворює кислоту. Кислотами - окиснювачами є нітратна кислота будь-якої концентрації і сульфатна кислота концентрована. Всі інші кислоти, в тому числі і сульфатна кислота розбавлена є звичайними (простими) кислотами. Назви кислот. Систематичні назви кислот будуються з назв аніонів і починаються з назви катіона — «гідроген»: HNO3 — гідроген нітрат (V), гідроген триоксонітрат, H2SeO3 — дигідроген триоксоселенат. Назви деяких аніонів: SO42- — cульфат (тетраоксосульфат), SO32- — (сульфіт, триоксосульфіт), РО43- — фосфат (тетраоксофосфат), NO3- — нітрат, NO2- — нітрит, ClO2- — хлорит, СlO- — гіпохлорит, Cl- — хлорид, Br- — бромід, F- — флуорид, CN- — ціанід. Назву кислоти можна будувати, використовуючи назву аніона замість прикметника, додаючи до нього іменник “кислота”: H2SO4— cульфатна (VІ) кислота, сульфатна кислота. Якщо оксигеновмісна кислота містить елементи у найвищому ступені окиснення, то ступінь окиснення і число атомів оксигену можна не вказувати: H2SeO4 — селенатна, HNO3 — нітратна, H2CrO4 — хроматна, H2SO4 — сульфатна кислоти. Назви безоксигенових кислот походять від аніонів із суфіксом -ід (ид): HCl — гідроген хлорид, H2S — дігідроген сульфід, HCN — гідроген ціанід, Їх можна також називати так: HІ — іодидна кислота, H2Se — cеленідна кислота. Можно також використовувати традиційні назви, наприклад, HCl — хлороводнева кислота. Одержання кислот. 1. Взаємодія кислотних оксидів з водою: SO3+ H2O= H2SO4; P2O5+3H2O= 2H3PO4 2. Взаємодія солей з кислотами: Na2SіО3+H2SO4= Na2SO4 + H2SіО3; 2NaCl+H2SO4= 2HCl+Na2SO4 Одержана кислота повинна бути більш слабкою, менш розчинною або більш леткою, ніж взята. 3. Взаємодія неметалів з воднем: Н2 + Сl2 = 2HСl; H2 + S = H2S Хімічні властивості кислот. 1. Взаємодія з металами: а) метали, розміщенні в ряду напруг до водню, реагують з звичайними кислотами (НСl, Н2SО4 розб., H2S) і витісняють водень: 2НСl + Mg = H2 + MgCl2; 2Н+ + 2е ® Н2 - окиснювач Mg° -2e ® Mg 2+ - відновник б) метали, розміщені у ряді напруг після водню із звичайними кислотами не реагують: Сu + HCl в) кислоти-окиснювачи (HNO3, H2SO4 конц) реагують з більшістю металів, причому відновлюються нітроген (V) і сульфур (VI): Ступінь відновлення залежіть від активності металів і ступеню розбавлення (для нітратної кислоти). Активні метали (до цинку у ряді напруг) відновлюють нітратну кислоту до солей амонію NH4NO3, вільного азоту, N2O, а сульфатну кислоту до Н2S i S°. 4Zn + 10HNO3 (розб) = 4Zn(NO3)2 + N2O +5H2O Zn° - 2e ® Zn2+ 2N5+ + 8e ® 2N+ Метали середньої активності (від цинку до свинцю) відновлюють нітратну кислоту до N2O, NO, а сульфатну – до S° та SO2. Малоактивні метали (після водню до срібла) відновлюють HNO3 до NO i NO2, H2SO4 – до SO2 або солей Н2SO3. Благородні метали (Аu, Pt, Pd) не реагують з цими кислотами. З концентрованими НNO3 i H2SO4 не реагує залізо внаслідок утворення нерозчинних у цих кислотах первинних продуктах окислення, тому їх транспортують у залізних цистернах. Приклади: Сu + 4HNO3(конц) = Cu(NO3)2 + 2NO2 + 2H2O Сu° -2e ® Cu2+ N5+ + 1e ® N4+ 3Сu + 8HNO3 (розб.) = 3Сu(NO3)2 + 2NO + 4Н2О Сu° -2e ® Cu2+ N5+ + 3e ® N2+ Cu + 2H2SO4 (конц) ® CuSO4 + SO2 + 2H2O Сu° - 2e ® Cu2+ S6+ + 2e ® S4+ 2. Взаємодія з основними оксидами: СuO + H2SO4 = CuSO4 + H2O; Fe2O3 + 6HCl = 2FeCl3 + 3H2O 3. Взаємодія з основами (реакція нейтралізації): NaOH + HCl = NaCl + H2O; Cu(OH)2 + H2SO4= CuSO4 + 2H2O 4. Взаємодія з солями: H2SO4 + BaCl2 = BaSO4¯ + 2HCl; HCl+AgNO3 = HNO3 + AgCl¯
Основи. Основами називають речовини, при електролітичній дисоціації яких утворюються аніони у вигляді гідроксид-іонів. Основами є гідрати основних оксидів. Загальна формула основ - Me(OH)n. Кількість гідроксильних груп дорівнює ступеню окиснення металу і визначає кислотність основи. Так, NaOH — однокислотна, Са(ОН)2 — двокислотна основа. Багатокислотні основи дисоціюють ступінчасто: Са(ОН)2 «СаОН+ + ОН- (перший ступінь) СаОН+ «Са2+ + ОН- (другий ступінь) Назва основ. Назва складається з назви катіона і слова “гідроксид”. Наприклад: КОН — калій гідроксид. Якщо елемент утворює декілька основ, то вказують ступінь його окиснення: Fe(OH)2 — ферум (ІІ) гідроксид, Fe(OH)3 — ферум (ІІІ) гідроксид. Основи, розчинні у воді, називають лугами. Це гідроксиди лужних і лужно-земельних металів: LіОН; NaOH; КОН; RbOH; CsOH; Са(ОН)2; Sr(OH)2; Ва(ОН)2 (три останні сполуки малорозчинні). Одержання основ. 1. Взаємодія лужних і лужно-земельних металів з водою: 2Na + 2H2O = 2NaOH + H2; Ва + 2Н2О = Ва(ОН)2 + Н2 2. Взаємодія оксидів лужних і лужно-земельних металів з водою: Na2O + H2O = 2NaOH; СаО + Н2О = Са(ОН)2 3. Взаємодія солей з лугами. Цей спосіб використовується для одержання нерозчинних в воді основ: FeSO4 + 2NaOH = Fe(OH)2¯ + Na2SO4; CuCl2 + 2KOH = Cu(OH)2¯ + 2KCl
Хімічні властивості основ. 1. Взаємодія з кислотою (реакція нейтралізації): KOH + HCl = KCl + H2O; Cu(OH)2 + H2SO4 = CuSO4 +2H2O 2. Взаємодія з кислотними оксидами (ангідридами кислот): 2NaOH+CO2 = Na2CO3 + H2O; Ca(OH)2 + SO3 = CaSO4 + H2O 3. Взаємодія з солями: Fe2(SO4)3 + 6NaOH = 3Na2SO4 + 2Fe(OH)3 Амфотерні гідроксиди. Гідрати амфотерних оксидів (Zn(OH)2; Al(OH)3; Cr(OH)3; Sn(OH)2 та інші) мають амфотерні властивості. При взаємодії з кислотами амфотерні гідроксиди проявляють основні властивості: Zn(OH)2 + 2HCl = ZnCl2 + 2H2O; 2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
Натрій цинкат -реакції відбуваються при. Al(OH)3 + NaOH = NaАlO2 + 2 H2O сплавленні
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4] - реакції відбуваються у Al(OH)3 + 3NaOH = Na3[Al(OH)6] розчинах Натрій гідроксоалюмінат
Солі. Сіллю називають продукт заміщення атомів водню в кислоті на метал. В водних розчинах солі дисоціюють на катіон металу і аніон кислотного залишку: Na Cl «Na+ + Cl-; K3PO4 «3K+ +PO43- Розрізняють середні, кислі, основні, подвійні солі. Будь-яку сіль можна вважати, як продукт взаємодії основи з кислотою: 2NaOH + H2SO4 = Na2SO4 + 2H2O; Na2SO4 — середня сіль — продукт повної нейтралізації. При недостатній для повної нейтралізації кількості лугу утворюється кисла сіль: NaOH + H2SO4 = NaНSO4+ H2O, яка дисоціює за рівнянням: NaHSO4 «Na+ + HSO4- Кислі солі утворюються багатоосновними кислотами. Перевести кислі солі в основні можна діючи на них основами: NaHSO4 + NаOH = Na2SO4 + H2O Основні солі можна представити як продукт неповного заміщення гідроксогруп основи на кислотні залишки. Вони утворюються з багатокислотних основ: Mg(OH)2 + HCl = MgOHCl + H2O Дисоціює основна сіль з утворенням катіону MgOH+: MgOHCl «MgOH+ + Cl- Перевести основні солі в середні можна, діючи на них кислотою: MgOHCl + HCl = MgCl2 + H2O Назви солей. Назви середніх солей утворюються з назви катіону метала і назви кислотного залишку. Якщо іон металу може мати різні ступені окислення, вказується ступінь окислення металу: Na2CO3 - натрій карбонат, Al2(SO4)3 -алюміній сульфат, Fe(NO3)2- ферум (ІІ) нітрат. Назва кислих солей утворюється додаванням до аніону префікса гідроген, а якщо необхідно, то з відповідним числівником: NaHSO4 — натрій гідрогенсульфат; КН2РО4 — калій дігідрогенфосфат. Назви основних солей утворюють, додаючи до назви катіону слово “гідроксид”: Al(OH)Cl2 — алюміній гідроксид дихлорид, Fe(OH)2NO3 — ферум (ІІІ) дигідроксид нітрат. Подвійні солі складаються з іонів двох різних металів і кислотного залишку: КАІ(SO4)2 – калій - алюміній сульфат; NH4Fe(SO4)2 – аммоній ферум(ІІІ) сульфат. Одержання солей. 1. Реакція нейтралізації: КОН + HNO3 = KNO3+ H2O 2. Взаємодія кислот з основними оксидами: H2SO4 + CuO = CuSO4 + H2O 3. Взаємодія кислот з солями: HCl + AgNO3 = AgCl¯ + HNO3 4. Взаємодія солей: Na2SO4 + BaCl2 = 2NaCl + BaSO4¯ 5. Взаємодія основ з кислотними оксидами: Сa(OH)2 + CO2 = CаСО3¯ + H2O 6. Взаємодія солей з лугами: 3КОН + FeCl3 = 3KCl + Fe(OH)3¯ 7. Взаємодія основних оксидів з кислотними: CaO + SіO2 = CaSіO3 8. Взаємодія металів з неметалами: 2К + Сl2 = 2КCl. 9. Взаємодія металів з кислотами: Mg + HCl = MgCl2 + H2 10. Взаємодія металів з солями: Fe + CuSO4 = FeSO4 + Cu Хімічні властивості солей. 1. Метали, які мають менше алгебраїчне значення стандартного електродного потенціалу, витісняють із солі метал, який має більше алгебраїчне значення стандартного електродного потенціалу: Zn + FeSO4 = Fe + ZnSO4. 2. Солі взаємодіють з кислотами: CuSO4 + H2S = CuS¯ + H2SO4 3. Солі взаємодіють з лугами: CuSO4 + 2KOH = Cu(OH)2¯ + K2SO4 4. Солі взаємодіють між собою: CaCl2+Na2СO3=CaCO3¯+ 2NaCl Три останні типи взаємодій відбуваються у випадку, коли утворюються гази (SO2, CO2) або нерозчинні речовини (Cu(OH)2, CaCO3).
Миколаїв 2007
УДК 041 Камінська Е.Г. Кельїна С.Ю. Мащенко В.В. Класи неорганічних сполук. (методичні вказівки)
Кафедра хімії Ці методичні вказівки містять довідки з основних понять хімії і класів неорганічних сполук, які необхідні для вивчання університетського курсу хімії. Окрім того, розібрані методи розв’язку основних типів задач з відповідних тем та запропоновані вправи і задачі для самостійної підготовки та самоконтролю знань. Вказівки призначені для студентів всіх спеціальностей.
Рецензент – к.т.н., доцент Соловйова Ж.Ф.
Ó Український державний морський технічний університет ім. С.Й.Макарова
І. Основні хімічні поняття Хімія -це наука про склад та будову речовин, їх властивості та взаємні перетворення. Окремий вид матерії, який за певних умов має сталі фізичні та хімічні властивості, називається речовиною. Речовина складається з елементарних частинок, які мають масу покою. Будь-які зміни з речовиною називають явищами. Фізичними явищами є такі, під час яких не змінюється склад речовини, але можуть змінюватися форма, агрегатний стан, температура, тощо. Хімічні явища зв’язані із зміною складу та властивостей речовини. Будь-яка хімічна речовина складається з хімічних елементів. Елементом називається сукупність атомів, які мають однаковий заряд ядра. Кожний елемент має свою назву та хімічний символ. Носієм властивостей елемента є атом. Атом –хімічно неподільна електронейтральна частинка речовини, яка складається з ядра і електронів. Ядро (центральна частина атома) складається з протонів і нейтронів. Маси протонів і нейтронів у» 10000 разів більше маси електронів, тому в ядрі зосереджена маса атома, яка дорівнює» 10-25- 10-27 кг. Електрони утворюють електронну оболонку, розміри якої визначають розміри атома (»10-10 м). Позитивний заряд ядра, який відповідає числу протонів, дорівнює негативному заряду електронної оболонки, що визначається числом електронів. Кількісними характеристиками атома є його маса і заряд ядра,що збігається з порядковим номером (Z) елемента у Періодичній системі. Елементи можуть утворювати атоми з різною кількістю нейтронів у ядрі. Такі атоми одного елементу називають ізотопами. Наприклад, елемент Гідроген складається з ізотопів трьох видів: Протію (11Н, тобто до складу ядра входить тільки протон), Дейтерію (21D, до складу ядра входить один протон і один нейтрон) і Тритію (31Т, до складу ядра входять один протон і два нейтрони). Кожний елемент має кілька ізотопів, тому в Періодичній системі наведено середню атомну масу елементів з урахуванням їх поширення у природі. Атомна одиниця маси – це сучасна позасистемна одиниця вимірювання атомних та молекулярних мас (позначається а.о.м.) Вона є 1/12 часткою маси атому ізотопу Карбону 12С. Маса цього ізотопу дорівнює 19,93 10-27 кг. З цього випливає, що 1 а.о.м = Ця величина – одна з фундаментальних фізичних сталих. Відносна атомна маса (Аr, r- relаtive - відносний) – це величина, що визначається відношенням маси атома елемента до величини 1 а.о.м.: Аr(ат) = m (ат) / 1 а.о.м Аr (Н) = 1,67 10-27 кг / 1 а.о.м. =1,67.10-27 кг / 1,66 . 10-27 кг = 1,008 Аr (U) = 3,9513. 10-25 кг / 1 а.о.м. = 3,9513. 10-25 кг / 1,66 . 10-27 кг = 238,03. Основною властивістю атомів хімічних елементів є їх схильність до сполучення з утворенням хімічних речовин. Молекула – здатна до самостійного існування частинка речовини, що зберігає її хімічні властивості. Молекули складаються з атомів, які з’єднані між собою хімічними зв’язками в певній послідовності та певним чином орієнтовані у просторі. Число атомів в молекулах становить від двох (Н2, О2) до кількох тисяч (гормони, білки). Атоми інертних газів іноді називають одноатомними молекулами (Не, Аr). Усі молекули одної речовини молекулярної будови мають однаковий склад, розміри, масу і властивості. Молекули різних речовини різняться за цими характеристиками. Молекули безперервно рухаються. У твердих речовинах вони здійснюють коливальний рух навколо положень рівноваги, в рідких – теж коливаються і прямолінійно переміщуються в нові положення, в газах – здійснюється прямолінійний хаотичний рух. Відстань між молекулами у твердих речовинах і рідинах складає» 10-10 м, у газах – 10-8-10-7 м. Під час фізичних явищ молекули зберігаються, під час хімічних перетворень – руйнуються, поєднуються в нові комбінації, утворюючи нові речовини. Сполуки, які складаються з атомів одного елементу, називаються гомосполуками. Найбільш стійка за звичайних умов гомосполука елементу називається простою речовиною. Наприклад, Карбон утворює графіт і алмаз, Оксиген утворює атомарний кисень О, молекулярний кисень О2 і озон О3. Серед цих прикладів простими сполуками є графіт та молекулярний кисень, як більш стійки за звичайних умов. Явище існування кількох гомосполук одного елементу називається алотропією. Сполуки, які складаються з атомів різних елементів називають гетеросполуками, або складними речовинами, наприклад, вода Н2О, амоніак NH3, сульфатна кислота H2SO4, тощо. Найважливішою характеристикою молекули є її склад, який описується хімічними формулами. Використовують декілька видів хімічних формул. Для сполук з молекулярною будовою використовуються молекулярні формули, які відображають якісний склад та кількісні співвідношення атомів у молекулі. Наприклад, молекула СО2 складається атомів Карбону і Оксигену у співвідношеннях 1:2. В електронних формулах зображуються зв'язки між атомами у молекулі, які утворюються спільними електронними парами, наприклад, Н: Н, О :: О, Н: О: Н. Такими формулами корист
|
||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 204; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.190.219.178 (0.014 с.) |
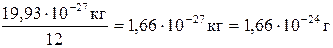



 О Н Н О О
О Н Н О О

 Са S
Са S
 О Н Н О О
О Н Н О О

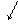 Неметали Метали
Неметали Метали


 Кислотні оксиди Основні оксиди
Кислотні оксиди Основні оксиди
 Амфотерні гідроксиди
Амфотерні гідроксиди
 Кислоти Основи
Кислоти Основи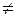
 Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O



