
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Аналітична реакція на арсен (ІІІ)Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Ця реакція базується на отриманні гідроген арсену (ІІ), який віднов- 2Na3AsO3 + 6Zn + 9H2SO4 = 2AsH3 + 6ZnSO4 + 3Na2SO4 + 6H2O
AsH3 + 6AgNO3 + 3H2O = H3AsO3 + 6Ag +6HNO3 AsH3 + 6Ag+ + 3H2O = H3AsO3 + 6Ag +6H+ Ця реакція використовується для визначення арсену в біологічних матеріалах та водах, забруднених промисловими відходами.
Реакція на йон Ві3+ з йодидом калію До 0,5 мл розчину солі бісмуту добавити 2–3 краплі розчину КІ. Ви- Ві(NO3)3 + 3KI = BiI3 + 3KNO3 Bi3+ + 3I– = BiI3 До одержаного осаду прилити ще (надлишок) розчину КІ та збовтати. Осад розчиняється з утворенням комплексної солі оранжевого кольору: BiI3 + KI = K[BiI4] BiI3 + I– = [BiI4]– Реакція використовується для перевірки фармакопейного препарату ВіONO3.
Реакція на йон У пробірку налити 5 мл розчину K2SO4, Na2SO4 або H2SO4 та 1 мл розчину ВаСl2. Скласти рівняння реакції. Впевніться, що осад, який утворюється, не розчинний у HNO3 і HCl. Реакція використовується для визначення йонів
Реакція на йон У пробірку налити 0,5 мл розчину K2SO3 або Na2SO3, 1 мл розчину HCl та нагріти. Виділяється сірчистий газ з характерним запахом. Записати рівняння цієї реакції.
Реакція на йон У пробірку налити 0,5 мл розчину Na2S2O3 та 1 мл розчину HCl. Трохи підігріти. Що при цьому бачимо? Рівняння реакції: Na2S2O3 + 2HCl = S + SO2 + H2O
Приведена реакція лежить в основі існуючого методу лікування сверблячки.
Реакція на йон У пробірку налити 0,5 мл розчину Na2S2O3 та декілька крапель розчину йоду. Розчин йоду знебарвлюється. 2 Na2S2O3 + I2 = Na2S4O6 + 2NaI
За допомогою вказаної реакції встановлюються фармакопейні пре-
АНАЛІТИЧНІ РЕАКЦІЇ НА ЙОНИ d-ЕЛЕМЕНТІВ ТА ЇХ СПОЛУКИ
При порівнянні з розглянутими раніше s-елементами, d-елементи міс- 2KCl + Na3[Co(NO2)6] = K2Na[Co(NO2)6] + 2NaCl 2K+ + Na+ + [Co(NO2)6]3– = K2Na[Co(NO2)6] Реактив не може бути застосований в лужному або кислому розчині внаслідок руйнування комплексного йону: [Co(NO2)6]3– + 3OH– = Co(OH)3 + 6NO [Co(NO2)6]3– + 6H+ = Co3+ + 6HNO Цією реакцією користуються для осадження йонів калію в біологічних рідинах при перманганатометричному визначенні калію в них (кількість йонів калію в осаді визначається після розчинення шляхом титрування йонів NO
Реакція на йон Mg2+ з гідрофосфатом натрію Na2HPO4 у присутності водного розчину аміаку та хлориду амонію У пробірку наливають 0,5 мл розчину солі магнію, а потім додають туди у вказаній послідовності по 0,5 мл таких розчинів: NH4Cl, NH3ОН та Na2HPO4. При цьому випадає білий дрібнокристалічний осад подвійної солі MgNH4PO4: MgCl2 + Na2HPO4 + NH3 = MgNH4PO4 + 2 NaCl Mg2+ + HPO Присутність NH4Cl в розчині необхідна для того, щоб запобігти утворенню гідроксиду магнію за рівнянням реакції: Mg2+ + 2NH3 + 2H2O = Mg(OH)2 + 2NH збільшення NH Отриманий осад розділити на дві частини та перевірити його роз- MgNH4PO4 + 3HCl = MgCl2 + NH4Cl + H3PO4 MgNH4PO4 + 3H+ = Mg2+ + або MgNH4PO4 + 2CH3COOH = Mg(CH3COO)2 + NH4H2PO4 MgNH4PO4 + 2CH3COOH = Mg2+ + Реакція утворення MgNH4PO4 застосовується в біохімічному аналізі для визначення йонів Mg2+ у крові та тканинах.
Реакція на йон Са2+ з оксалатом амонію (NH4)2C2O4 У пробірку наливають 0,5 мл розчину солі кальцію і таку ж кількість розчину (NH4)2C2O4. Утворюється білий кристалічний осад: СаСl2 + (NH4)2C2O4 = CaC2O4 + 2 NH4Cl Ca2+ + C2O42- = CaC2O4 Осад розділяють на дві частини та випробовують його на розчинність в соляній та оцтовій кислотах. В якій кислоті осад розчиниться? Записують рівняння хімічної реакції. Розглянута реакція застосовується для визна-
Реакція на йон Ва2+ з хроматом калію К2СrO4 Налити в пробірку 0,5 мл розчину солі барію та 0,5 мл розчину хромату калію. Випадає жовтий кристалічний осад хромату барію: ВаCl2 + K2CrO4 = BaCrO4 + 2KCl Ba2+ + CrO42- = BaCrO4 Отриманий осад розділити на дві частини і перевірити його роз- 2 BaCrO4 + 2HCl = BaCl2 +BaCr2O7 + H2O 2 BaCrO4 + 2H+ = Реакція на йон Sr2+ з сірчаною кислотою H2SO4 До 1 мл розчину солі стронцію прилити 0,5 мл розчину сірчаної кис- SrCl2 + H2SO4 = SrSO4 + 2HCl Sr2+ +
Аналітична реакція на йон Cr2+ У пробірку налити 1–2 мл розчину солі Cr2(SO4)3, долити 3–5 мл розчину NaOH та добавити 3–4 краплі розчину H2O2. Нагріти до появи жовтого забарвлення
Аналітична реакція на йон Mn2+ У пробірку налити 1–2 краплі дуже розведеного розчину MnSO4, 1–2 краплі AgNO3 (каталізатор), 1 мл розчину NaOH з с(NaOH) = 2 моль/л та
Аналітичні реакції на йон Ni2+ з диметилгліоксимом (реакція Л.А. Чугаєва) У пробірку налити краплю розчину солі нітрату нікелю (ІІ), додати
Аналітичні реакції на йон Со2+ з нітратом калію 2–3 краплі розчину нітрату кобальту (ІІ) налити у пробірку, додати декілька крапель розчину СН3СООН до рН=3 (проба універсальним індикатором) та 1–2 краплі розчину нітрату калію. Випадає жовтий кристалічний осад K3[Co(NO2)6].
Co(NO3)2 + 7KNO2 + 2СН3СООН = K3[Co(NO2)6]↓ + NO + + 2KNO3 + 2СН3СООK + H2O
Co+2 +
Реакція на йон Hg2+ із SnCl2 У пробірку до 0,5 мл розчину хлориду меркурію (ІІ) (сулеми) додати по краплям розчин SnCl2. Утворюється білий осад каломелю (Hg2Cl2), який поступово чорніє. а) 2HgCl2 + SnCl2 = Hg2Cl2↓ + SnCl4 2HgCl2 + Sn2+ = Hg2Cl2↓+ Sn4+ + 2Cl– б) Hg2Cl2 + SnCl2 = 2Hg + SnCl4 Hg2Cl2 + Sn2+ = 2Hg + Sn4+ + 2Cl–
КОНТРОЛЬНІ ПИТАННЯ ДО КОЛОКВІУМІВ
|
||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 494; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.57.239 (0.007 с.) |

 + 3Zn +9H+ = AsH3 + 3Zn2+ + 3H2O
+ 3Zn +9H+ = AsH3 + 3Zn2+ + 3H2O із розчином хлориду барію
із розчином хлориду барію в звичайних та стічних водах.
в звичайних та стічних водах. із розчином мінеральної кислоти
із розчином мінеральної кислоти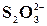 із розчином мінеральної кислоти
із розчином мінеральної кислоти +2H+ = S +SO2 + H2O
+2H+ = S +SO2 + H2O + 2I–
+ 2I–
 + NH3 = MgNH4PO4
+ NH3 = MgNH4PO4 ,
, + H3PO4
+ H3PO4
 + H2O
+ H2O = SrSO4
= SrSO4 . Написати рівняння відповідних реакцій.
. Написати рівняння відповідних реакцій. . Написати рівняння реакцій. Чи мож-
. Написати рівняння реакцій. Чи мож-
 + 3K+ + 2СН3СООН = K3[Co(NO2)6]↓ + NO + 2СН3СОО- + H2O
+ 3K+ + 2СН3СООН = K3[Co(NO2)6]↓ + NO + 2СН3СОО- + H2O


