Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дослідження адсорбції ізоамілового спирту із розчину за допомогою активованого вугілляСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Для роботи необхідно: 0,1 моль/л розчин ізоамілового спирту; сталагмометр; штатив з пробірками; активоване вугілля.
Поверхневий натяг розчину визначити сталагмометричним мето-
ВИЗНАЧЕННЯ ПОВНОЇ ОБМІННОЇ ЄМНОСТІ (ОЄ) КАТІОНІТУ
Для роботи необхідно: 0,1 моль/л NaOH; 0,1 моль/л розчин НСl; мірна колба на 250 мл; катіоніт; індикатор.
Обмінна ємність – це кількість еквівалентів (ммоль) речовини адсор-
ВИЗНАЧЕННЯ ВМІСТУ ЛІКАРСЬКОЇ РЕЧОВИНИ (ГЛЮКОНАТУ КАЛЬЦІЮ) В РОЗЧИНІ МЕТОДОМ ЙОНООБМІННОЇ АДСОРБЦІЇ
Для роботи необхідно: глюконат кальцію; Н-катіоніт; 0,1 М розчин NaOH; індикатор метиловий оранжевий. УВАГА! При роботі з колонкою не допускається проникнення повітря в йоніт. Рівень рідини не повинен опускатися нижче верхнього рівня йоніту. Через колонку з Н-катіонітом повільно пропускають 20 мл дослід-
ОБЕЗСОЛЮВАННЯ ВОДИ ЗА ДОПОМОГОЮ ЙОНІТІВ
Для роботи необхідно: Н-катіоніт; ОН-аніоніт; оксалат амонію; нітрат аргентуму; піпетка; штатив з пробірками; метилоранж.
Для обезсолювання води взяти воду з водогону. За допомогою якісних реакцій виявити у воді йони хлору (реакцією з AgNO3) і йони кальцію (реакцією з оксалатом амонію (NH4)2C2O4). Через колонку з Н-катіонітом пропустити повільно 25 мл води з водогону, потім промити 25 мл дистильованої води. З отриманого розчину відібрати піпеткою по декілька крапель у 2 пробірки. В 1-й перевірити наявність Са2+ (реакція з (NH4)2C2O4), в 2-й – наявність йонів Н+ (ме-
9. РОЗДІЛЕННЯ ЙОНІВ Fе3+, Cu2+,Co2+ МЕТОДОМ ХРОМАТОГРАФІЇ НА ОКСИДІ АЛЮМІНІЮ
Для роботи необхідно: А12О3; металевий штатив; розчини CuSO4, FeCl3 i CoCl2.
Колонку з адсорбентом (А12О3) закріпити у штатив і пропустити через неї 1 мл суміші, що складається з рівних об’ємів розчинів CuSO4, FeCl3 i CoCl2 з масовою часткою 0,1. Спостерігати забарвлення розчину. У про-
VI. РОЗЧИНИ НЕЕЛЕКТРОЛІТІВ
ВИЗНАЧЕННЯ КРИТИЧНОЇ ТЕМПЕРАТУРИ ВЗАЄМНОГО РОЗЧИНЕННЯ РІДИН Для роботи необхідно: прилад для визначення критичної температу-
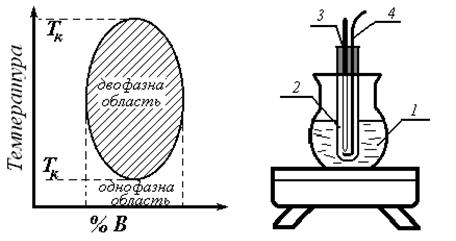
У випадку обмеження взаємної розчинності двох рідин у певній області концентрації завжди має місце рівновага між двома розчинами різного складу. Очевидно, при заміні температури ця рівновага буде змінюватися в ту чи іншу сторону. Всі ці співвідношення можуть бути подані графічно на діаграмах температура – склад. Температура, вище або нижче якої рідини взаємно розчинні у всіх співвідношеннях, називається критичною температурою розчинення. Роз-
Нижче приводяться приклади діаграм температура – склад систем з верхньою і нижньою критичними температурами розчинення (рис. 1, 2, 3). Криву взаємної розчинності двох рідин найпростіше знайти, визна- Колба 1 служить водяною або масляною банею, в пробірку 2 помі- Виходячи з загальної наважки і процентного вмісту, розраховують ва-
Якщо другими компонентами буде рідина, то її можна брати в об’єм- Для дослідження беруть дві речовини, що погано розчиняються одна в одній, наприклад система фенол – вода. Готують декілька сумішей з різним процентним складом, який вка-
Рис. 3. Система з верхньою і Рис. 4. Схема приладу для нижньою критичними визначення критичної температурами розчинення температури розчинення. (нікотин – вода).
Спочатку зважують необхідну кількість фенолу, потім відмірюють не- Встановлюють пробірку в прилад для визначення критичної темпера- Для одержання точних даних потрібно змінювати температуру повіль- При роботі з фенолом потрібно слідкувати за тим, щоб він не потра- По одержаних даних будують діаграму: температура – склад, по якій визначають критичну температуру розчинення і проводять контрольне визначення процентного складу по температурі взаємного розчинення. Результати дослідів заносять у таблицю:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 436; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.218.72 (0.01 с.) |

 .
. .
.