
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Речовини кріоскопічним методомСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Для роботи необхідно: кріоскоп; пробірка для розчину з мішалкою; термометр Бекмана; стаканчик фарфоровий; лід; сіль; речовина і розчини для дослідження.
Виходячи з сучасної теорії розведених розчинів, встановлена залеж-
де Ккр – кріоскопічна стала; g – вага розчиненої речовини, кг; gо – вага розчинника, кг; М – молекулярна маса розчиненої речовини. Це рівняння справедливе для розведених розчинів, що не дисоціюють на йони, а також неасоційованих. Розв’язавши це рівняння відносно молекулярної маси М, експери-
де gо – вага розчинника, кг (її можна брати і в об’ємних одиницях, знаючи густину розчинника). Для води густина приблизно дорівнює 1. Визначаючи експериментально пониження температури замерзання розчину неелектроліту, можна розрахувати його молярність, виходячи з того, що кріоскопічна стала Ккр – молярне пониження точки замерзання розчинника, тобто таке пониження температури, яке спостерігається, коли в 1 кг розчинника розчинений 1 моль речовини. Молярну концентрацію розчину неелектроліту визначають за фор-
Значення кріоскопічної сталої залежить від властивостей і виража-
де R – газова стала в калоріях; T – абсолютна температура замерзання розчинника; Mo – молекулярна маса розчинника; lзам. – молекулярна теплота замерзання розчинника; lзам. – питома теплота замерзання роз- Температури замерзання деяких розчинників, а також кріоскопічні сталі приведені в табл. 2, що знаходиться в кінці опису. У випадку слабких електролітів число молекул і йонів у і разів більше числа початково взятих молекул:
де і – коефіцієнт Вант-Гоффа; a – ступінь дисоціації; п – число йонів, які утворюються з однієї молекули. Тому рівняння для пониження темпе-
Для електролітів, молекулярна маса яких невідома, розв’язуючи це рівняння, одержимо:
У випадку слабких електролітів, при відомій молекулярній масі, можна підрахувати коефіцієнт Вант-Гоффа:
Знаючи і, підраховують ступінь дисоціації електролітів
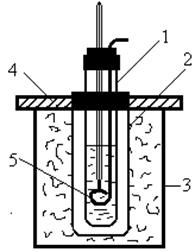
Прилад для кріоскопічних вимірювань, зображений на рис. 1, складається з таких частин. Пробірка 1 закріплена на коркові в металевому посуді 2, який відіграє роль повітряної сорочки. Стакан 3, в який помі- Перш ніж приступити до роботи, необ-
Особливістю цього термометра є велика довжина шкали (приблизно Шкала термометра розділена на 5 К, кожний градус ділиться на десяті долі, а кожна десята доля в свою чергу ділиться на соті долі; тисячні долі можуть бути при- Термометр для кріоскопічних вимірів налагоджується так, щоб при температурі замерзання рівень ртуті знаходився між третім і п’ятим градусами. Перед наладкою термометра перевіряють його покази при умовах, необхідних для роботи. Якщо рівень ртуті в капілярі не буде встановлюватися між 3 К і 5 К, термометр необхідно налагодити. Це робиться наступним чином: затискують рукою нижній резервуар ртуті, тобто нагрівають його і з’єднують із стовпчиком ртуті в верхньому резервуарі. Якщо в нижньому резервуарі був надлишок ртуті, тобто ртуть піднімалась у попередньому досліді вище п’ятого градусу, то після з’єднання обох резервуарів необхідно частину ртуті перевести в верхній резервуар. Для цього термометр повертають верхнім резервуаром вниз. Якщо ртуть у попередньому досліді опускалась нижче нуля, тобто в нижньому резервуарі ртуті недостатньо, то частину ртуті необхідно перелити з верхнього в нижній резервуар. Для цього з’єднують верхній і нижній резервуар, і нижній резервуар охолоджують в суміші льоду і води. Після того, як ртуть перейде в деякій кількості в потрібному напрямку, розривають стовпчик ртуті в капілярі. Нижній резервуар затискають у долоні і легким постукуванням однієї руки по другій розривають стовпчик ртуті. У випадку, коли ртуть не зупи- Налагоджений термометр залишають у стакані з льодом і присту- Розчинник наливають у пробірку в такій кількості, щоб після зану- Потім готують охолоджену суміш із води, льоду і солі з температурою на 3–4 К нижче температури замерзання розчинника. Заповнюють охо- Після наближеного визначення температури пробірку виймають з охолоджуючої суміші і розплавляють утворені кристали, опускаючи про- Вимірювання температури замерзання чистого розчинника повто- Середнє арифметичне з окремих вимірів приймають за дійсне зна- Для визначення молекулярної маси досліджуваної речовини беруть наважку g 0,2–0,3 г з точністю зважування до 0,0001 г і розчиняють її в даному розчиннику. Наближену температуру кристалізації визначають так, як і для роз- Визначення проводять 3 рази. Середнє значення трьох вимірів беруть за дійсне.
В даній роботі студент повинен виконати наступні завдання: 1. Визначити молекулярну масу речовини. 2. Визначити ступінь дисоціації слабкого електроліту або коефіцієнт активності сильного електроліту. 3. Визначити молярну концентрацію розчину неелектроліту. Результати роботи і розрахункові дані записують по формі: Об’єм розчинника V = Вага розчинника go = Вага розчиненої речовини g = Електроліт для визначення ступені дисоціації Об’єм, взятий для досліджування молярної концентрації Vk = Вага розчинника go = Вага розчиненої речовини g = Досліджувані і розрахункові дані заносяться в табл. 1. Таблиця 1
Таблиця 2
VII. РОЗЧИНИ ЕЛЕКТРОЛІТІВ
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 690; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.57 (0.009 с.) |

 розчинника від концентрації роз-
розчинника від концентрації роз- ,
, ,
, .
. ,
, ,
, .
.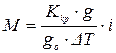 .
.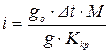 .
.
 .
. Рис. 2.
Рис. 2.



